体外膜式氧合(extracorporeal membrane oxygenation,ECMO)是一种持续体外生命支持(extracorporeal life support,ECLS)手段,静脉-静脉方式ECMO(V-V ECMO)是呼吸衰竭救治最为常用的方式,在有效改善氧合及通气的同时,通过降低吸氧浓度、气道压、潮气量和呼吸频率,使肺脏得以充分休息,从而最大程度降低呼吸机相关肺损伤的发生风险[1]。拟行ECMO的重症呼吸衰竭患者可归为两类[2]:一类是潜在可逆性病变引起的急性呼吸衰竭,比如重症肺炎等;一类是肺移植术前的过渡治疗。但对于免疫抑制肺部感染导致的难治性呼吸衰竭患者是否给予ECMO支持,国内外尚无统一意见;现报道1例我中心应用体外膜肺氧合成功救治的重症肺孢子菌肺炎免疫抑制患者,并结合文献对该病例进行讨论。
临床资料
患者,男,58岁,医生。主因「发热寒战伴喘憋7天,加重1天」于2015年08月15日入院。7天前着凉后出现发热,体温最高39.2℃,伴寒战、全身酸痛、喘憋,自行口服「感冒解毒颗粒、头孢羟氨苄」3天病情无改善,至当地医院,诊断为「发热待查、肺炎?」,予以「炎琥宁、头孢呋辛钠」治疗3天、「美罗培南、伏立康唑、增效联磺片」治疗1天,患者病情无好转且喘憋加重,肺CT示「间质性肺炎」,为进一步诊治来我院。病程中偶有咳嗽,无咳痰,无晕厥或意识障碍,无恶心呕吐,无腹痛腹泻,无盗汗及浮肿。2个月前在北大人民医院确诊「急性血小板减少性紫癜」,予以地塞米松40mg/日冲击4天治疗共两次,现口服甲强龙24mg/d。
入院查体
体温36.2℃,脉搏125次/分,呼吸24次/分,血压 128/85mmHg,SpO2 95%,神志清楚。双肺听诊双侧呼吸音低,未闻及干湿性罗音和胸膜摩擦音。心前区无隆起,心尖搏动正常,心浊音界正常,律齐,各瓣膜听诊区未闻及杂音,无心包摩擦音。腹平坦,无压痛、反跳痛、肌紧张。双下肢无水肿。
入院初步诊断
重症肺炎,肺孢子菌肺炎?急性呼吸窘迫综合征,高血压病(2级),血小板减少性紫癜。
主要诊治经过
第一阶段:发病至ECMO支持治疗(2015年8月15日-8月17日)
入院时患者呼吸窘迫,诉胸闷憋气、无胸痛,未见咳嗽咳痰,无发热,予无创呼吸机(模式CPAP,压力6cmH2O,FiO2 1.0)呼吸支持,静点头孢哌酮舒巴坦(舒普深)3.0 q12h+莫西沙星(拜复乐)0.4qd+更昔洛韦0.25 q12h+卡泊芬净50mg qd+口服磺胺甲氧苄啶1.44 q6h联合抗感染治疗,原发病方面予甲强龙24mg qd口服,患者喘憋好转不明显,体温逐渐升高,最高达39℃,SpO2 92-95%。
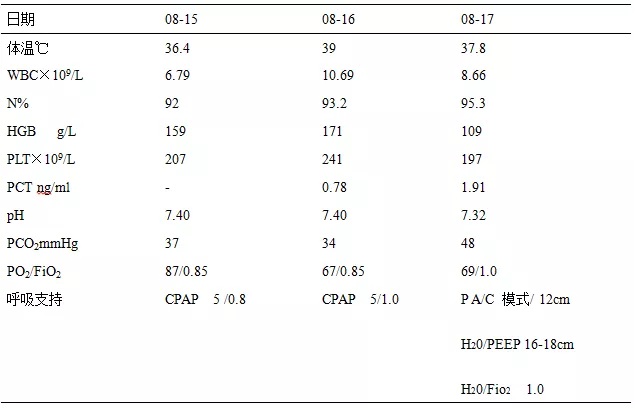
入院第2天,患者病情突然加重,烦躁不安,喘憋明显,呼吸急促(RR为35-51次/分),血氧饱和度下降至65-80%,血压下降80/50mmHg,急查血气分析pH:7.37,PO242mmHg,PCO2:43mmHg。立即给予气管插管,有创呼吸机辅助通气(模式PA/C,Pi:12cmH2O,PEEP:16-18 cmH2O,FiO2 1.0),同时予补液、去甲肾上腺素升压等治疗,完善支气管肺泡灌洗送病原学检查,并行俯卧位通气治疗,但患者仍间断低热,血氧改善仍不明显,于79%-92%之间波动(表1),胸部影像学改变见图1、2。
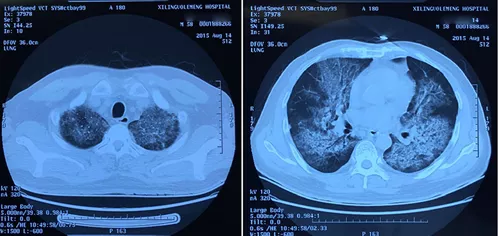
图1:患者入院时肺CT(2015-8-14)
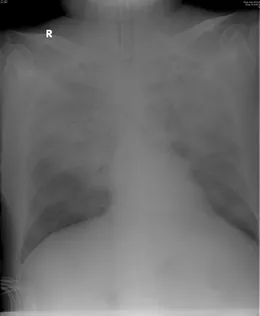
图2:ECMO支持前胸片(2015-8-17)
表1:患者ECMO治疗前感染指标及呼吸支持变化
第二阶段:ECMO支持治疗(2015年8月18日-8月25日)
1、ECMO支持及抗感染方面
患者仍有间断发热,体温波动在37.2-39.0℃之间,PEEP设置较高,氧合指数差,呼吸机及俯卧位通气效果差,为改善氧合、避免气压伤,与家属沟通后于2015-08-18给予ECMO治疗,血流量4.33L/min、转速3545转/min、气流量4L/min,持续呼吸机辅助通气(模式PC,Pi:10cmH2O,PEEP 18cmH2O,f 12次/分,FiO2 0.3),SpO2 波动于94-97%之间,予丙泊酚+力月西泵入镇静、芬太尼泵入镇痛、肝素泵入抗凝(监测APTT),调抗生素为泰能0.5g q6h+更昔洛韦0.25q12h+卡泊芬净50mg qd+万古霉素0.5g qd+磺胺甲氧苄啶1.44g q6h抗感染治疗,于08.18-08.22予丙球10g治疗,同时积极补液,去甲肾上腺素1.8ml/h泵入维持血压,心率114-125次/分,血压90-115/40-60mmHg。后患者有间断发热,体温波动在36.9-37.5℃之间,血压及心率较平稳,减停去甲肾泵入,病原学回报为肺孢子菌核酸阳性,停用更昔洛韦。
2、肾功能不全
8月19日患者出现急性肾功能不全,尿素氮 22.22mmol/L、肌酐 407.50umol/L,给予床旁血滤CVVH前稀释模式肾替代治疗(图3),因患者存在消化道出血而降低肝素抗凝水平,为保证CVVH顺利进行以枸橼酸钠局部抗凝。
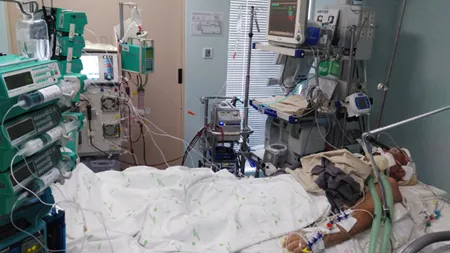
图3:患者ECMO联合CRRT治疗过程
3、消化道出血
8月19日患者胃液引流液呈血性,考虑为应激性溃疡出血,停止肠内营养液泵入,予洛赛克及思他宁抑酸、止血治疗及静脉营养支持,胃内容物由持续抽出鲜血转为咖啡样并明显减少,3天后出血得到控制,试用胃肠营养,适当调整ECMO及血滤的抗凝水平避免出血加重。
4、抗凝及凝血功能系统监测
因患者有消化道出血,采用的抗凝策略是静脉肝素泵入、APTT目标值初期40-50秒、后出血停止后50-60秒,同时CVVH管路局部枸橼酸钠抗凝。8月21日凝血四项危急值回报:Fbg38mg/dl,同期血小板 141×109/L,予输注人纤维蛋白原纠正出血风险。另患者双下肢静脉超声检查回报右下肢腘静脉血栓形成。血栓弹力图(TEG)检测多次回报血小板功能异常。
5、ECMO脱机
患者ECMO治疗7天,肺影像较前有所吸收、氧合较前改善(图4、5),8.25停止ECMO,继续机械通气(PSV模式,△Ps 10cmH2O,PEEP 8cmH2O,FiO2 0.5),SpO2 波动于96-99%之间。
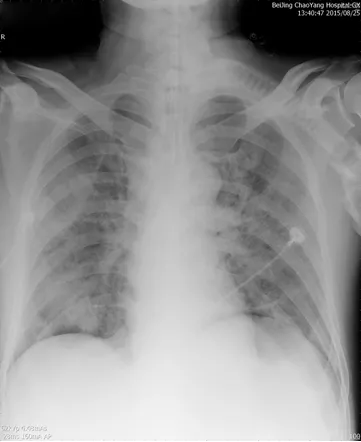
图4:患者撤离ECMO时胸片(2015年8月25日)
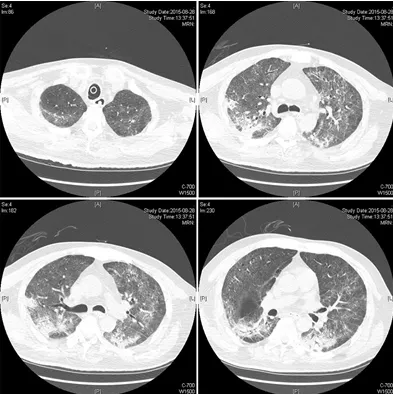
图5:ECMO撤离3日后患者肺HRCT(2015年8月28日)
第三阶段:康复阶段(2015年8月26日-10月20日)
1、感染方面
8月27日患者发热,白细胞明显上升,PCT较前升高,考虑为院内获得性肺炎。经家属同意后气管切开,接呼吸机辅助通气(模式PSV,压力 12cmH2O,PEEP 8cmH2O,FiO2 0.45)。调整抗感染方案为头孢哌酮舒巴坦3.0g q12h+替加环素100mg q12h+伏立康唑400mg q12h,磺胺甲氧苄啶减为0.96 q6h,继续甲强龙20mg鼻饲,经上述治疗后感染逐步控制。9.23停有创呼吸机辅助通气,给予文丘里加气切面罩,加温、加湿吸氧,氧浓度35%。10.4拔除气切套管,予鼻导管吸氧(患者细胞免疫学变化见表2)
2、原发病方面
患者血小板减少性紫癜,予甲泼尼龙20mg qd口服20日,后每周减量4mg,后口服8mg维持治疗。
3、肾功能不全方面
8月30日患者尿量逐渐增加(每日约1000ml),后患者肌酐水平维持于200-300umol/L之间,酸碱平衡及电解质稳定,尿量逐渐恢复,遂停用CVVH治疗。
4、脑血管疾病
患者撤离ECMO后意识不清,8月28日头颅CT示:左侧额叶、右侧顶叶梗塞伴少量出血,后撤离机械通气后患者表现为运动性失语;停用抗凝并维持血压等支持治疗后患者病情逐渐恢复,因患者合并下肢DVT给予预防量抗凝(低分子肝素钙0.4ml qd),出院前患者已能基本进行正常交流。
10月20日患者出院情况:无发热,无咳嗽、咳痰,无发憋、气短,食欲尚可,大小便尚可。查体:T36.5℃,HR 88次/分,R 13次/分,BP142/89mmHg,神志清楚,时有言语混乱,能完成基本语言交流,听诊双肺呼吸音粗,双肺未闻及干湿性啰音,心率88次/分,律齐,腹软,双下肢无水肿,病理征阴性。继续甲泼尼龙4mg qd及低分子肝素钙注射液0.4mlqd抗凝等治疗,头颅及肺部影像学明显好转(图6、图7)。
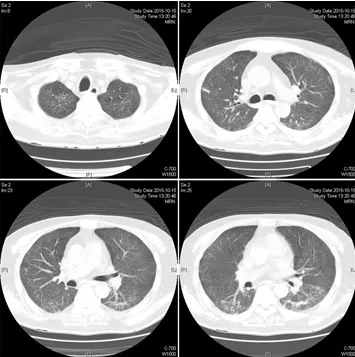
图6:患者出院前肺HRCT表现(2015年10月15日)
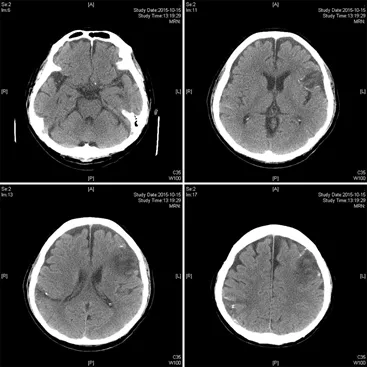
图7:患者出院前头颅CT(2015年10月15日)
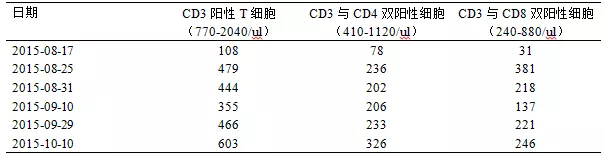
表2:患者的细胞免疫学变化
讨论
ECMO作为一种脏器支持治疗手段,对原发病本身没有直接治疗作用,因此在行ECMO治疗之前,应综合判断原发病的潜在可逆性。对于该例患者,结合病史、临床表现、影像学及病原学资料,诊断为肺孢子菌肺炎、ARDS,病情危重,作为非HIV免疫抑制罹患PCP患者,死亡率高达30-40%(而PCP的AIDS患者仅为10-20%),需要有创机械通气和ARDS的患者死亡率分别高达80.9和86.8%[3]。尽管该患者给予早期磺胺类药物治疗肺孢子菌,但其呼吸衰竭进行性加重,给予高水平PEEP及俯卧位通气支持等处理后氧合未改善,氧合指数(PaO2/FiO2)小于80mmHg,有应用ECMO的指征[4]。该例患者糖皮质激素治疗2月余存在免疫抑制状态,且在入院后三天内PCT进行性增高,是决定ECMO是否应用的最大困扰。结合相关文献,De Rosa曾报道2例肺孢子菌、1例军团菌感染导致重症肺炎、ARDS的HIV患者,经过ECMO救治后2例存活[5]。Sun等[6]回顾调查1996年至2007年334例ECMO患者院内感染的资料,其中因自身免疫病接受免疫抑制治疗的患者发生院内感染的OR值为6.997、P值0.012;但Aubron等回顾性调查所在中心2005年至2011年146例ECMO患者中发现64例免疫抑制患者未因为免疫功能低下而导致感染增加,其中20例发生院内感染(P值0.123)、导管相关性血流感染为11例(P值0.478)[7]。权衡利弊后,我们给患者应用VV-ECMO治疗,期间未出现院内感染征象。
尽管该患者成功撤离ECMO,但在管理过程中患者的凝血系统紊乱及出血并发症是我们面临的巨大挑战。ECMO抗凝的基本目标是:不出血,适度抗凝,适度纤溶;我中心ECMO的抗凝主要通过部分凝血活酶时间(activated partial thromboplastin time,APTT)、D-二聚体、凝血四项、血栓弹力图(Thromboelastography, TEG)来监测[8];一般而言,ECMO抗凝所用肝素剂量较心胸手术CPB时的剂量小很多,血中的肝素浓度较低, 此时APTT 较全血凝血时间(ACT)更加敏感[9]。该原发病为「急性血小板减少性紫癜」,入院时血小板计数正常、但血栓弹力图多次回报血小板功能异常,结果在ECMO治疗应用普通肝素泵入抗凝后出现消化道出血、纤维蛋白原低下(小于50 mg/dl),不得不暂停肝素抗凝及补充纤维蛋白原、输注新鲜冰冻血浆纠正。暂停肝素期间我们尝试提高ECMO血流量来防止膜肺内血栓形成、但4小时内可见膜肺内4-5处小血栓形成,遂继续泵入肝素,维持APTT为40-50s、出血停止后控制于50-60s之间;尽管持续给予抗凝,但撤离ECMO后双下肢超声检查发现右下肢(股静脉置管侧)出现下肢腘静脉血栓形成。另该患者出现急性肾功能不全需CVVH治疗;但初期APTT维持在40-50s之间时CVVH管路内血栓形成快、治疗时间小于6小时,查阅相关文献后我们给予CVVH管路内局部枸橼酸钠泵入抗凝治疗,管路治疗时间能保证48-72小时,CVVH顺利维持[10]。
出血是ECMO最常见的并发症,该患者除开始治疗后的消化道出血,在撤离ECMO停用镇静后仍意识不清,经头颅CT确诊为脑梗死伴脑出血,因出血量小、不需要进行开颅手术引流,此刻面临的问题是患者有下肢DVT需要抗凝,有加重脑出血的潜在可能;另患者存在肾功能不全,停用CVVH后肌酐清除率仍低于正常,抗凝的剂量应如何把握。结合文献报道,对于脑出血的患者给予早期抗凝治疗,能显著降低肺血栓栓塞症的发生,不会导致脑出血的加重[11],对于该患者我们给予低分子肝素钙0.4ml 每日1次抗凝治疗,患者为出现肺栓塞并发症、亦未出现脑出血加重及其他出血并发症,出院时患者神经系统功能恢复良好。
通过本病例的讨论我们认识到,尽管重症呼吸衰竭的免疫抑制患者进行ECMO支持存在院内感染加重的困扰,但对于潜在可逆性病变(如重症肺孢子菌肺炎)的患者,其呼吸衰竭有成功救治的可能。但ECMO期间的凝血系统紊乱及其他并发症让我们举步维艰,需要多学科的协作和配合。因此ECMO的支持不仅仅是呼吸功能的支持,成功与否需要综合考虑所在单位及当地的对疾病的综合诊治能力。
参考文献
[1] Collins SR, Blank RS. Approaches to refractory hypoxemia in acute respiratory distress syndrome: current understanding, evidence, and debate. Respir Care 2011;56:1573-82.
[2] MacLaren G, Combes A, Bartlett RH. Contemporary extracorporeal membrane oxygenation for adult respiratory failure: life support in the new era. Intensive Care Med 2012;38:210-20.
[3] Toper C, et al. Pneumocystis jirovecii pneumonia in non-HIV infectedpatients: a study of 41 cases. Rev Pneumol Clin 2011;67(4):191–8.
[4] Ferguson ND, Fan E, Camporota L, Antonelli M, Anzueto A, Beale R, et al.The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Med. 2012;38:1573–82.
[5] De Rosa FG, Fanelli V, Corcione S, et al. Extra Corporeal Membrane Oxygenation (ECMO) in three HIV-positive patients with acute respiratory distress syndrome. BMC anesthesiology 2014;14:37.
[6] Sun HY, Ko WJ, Tsai PR, et al. Infections occurring during extracorporeal membrane oxygenation use in adult patients. The Journal of thoracic and cardiovascular surgery 2010;140:1125-32.e2.
[7] Aubron C, Cheng AC, Pilcher D, et al. Infections acquired by adults who receive extracorporeal membrane oxygenation: risk factors and outcome. Infection control and hospital epidemiology 2013;34:24-30.
[8] 中华医学会呼吸病学分会危重症医学学组. 体外膜氧合治疗成人重症呼吸衰竭临床操作推荐意见.中华结核和呼吸杂志,2014,37:572—578.
[9] Hirsh J, Raschke R, Warkentin TE, Dalen JE, Deykin D, Poller L (1995) Heparin: mechanism of action, pharmacokinetics, dosing considerations, monitoring, efficacy, and safety. Chest,1995, (108, 4 Suppl):258S–275S.
[10] Shum HP, Kwan AM, Chan KC, Yan WW. The use of regional citrate anticoagulation continuous venovenous hemofiltration in extracorporeal membrane oxygenation. ASAIO journal (American Society for Artificial Internal Organs : 1992) 2014;60:413-8.
[11]Paciaroni M, Agnelli G, Venti M, Alberti A, Acciarresi M, Caso V. Efficacy and safety of anticoagulants in the prevention of venous thromboembolism in patients with acute cerebral hemorrhage: a meta-analysis of controlled studies. Journal of thrombosis and haemostasis : JTH 2011;9:893-8.
作者: 李绪言,王睿,孙兵 - 首都医科大学附属北京朝阳医院呼吸与危重症医学科
本文转载自订阅号「重症与康复」(ID:CriticalAndRehabCare)
本文完
排版:Jerry


