引言
我们从形态学方面分析,影像学是宏观的,病理学是微观的。如果把影像学比作一片森林,病理学就是一棵树,如果把影像学比作一棵树,病理学就是一张树叶。所以影像和病理是分不开的,是侦查和辨别微小肺癌的孪生兄弟,要互相取长补短。
一、认识将肺癌扼杀在早期微小阶段的重要性
早期微小肺癌的定义是什么?

IASLC第8版TNM新分期标准
国际上把早期肺癌定义为≤3cm且没有淋巴结转移,其中≤1cm的是0期原位癌(AIS)和ⅠA1期的微浸润癌(MIA),因瘤体仅在≤1cm的范围内,故又称微小肺癌,它们的5~10年的术后生存率可达98%~100%。如果在早期肺癌的ⅠA2期和ⅠA3期,5年生存率不是很理想,明显下降到84%。ⅠB期、ⅡA期、ⅡB期的5年生存率更低,分别为65.8%、46%、36%。
我们必须要重视微小肺癌的特点,能够把肺癌扼杀在早发现、早诊断、早治疗的阶段。因为从单个癌细胞开始通过血管的进入,倍增发育到直径1cm、重量1g的原位癌、微浸润癌约需5~10年的生长期。也就是说你发现这个磨玻璃结节是肺癌的话,5mm的结节至少长了5年,那么为什么要三个月随访一次?完全可以半年或者一年的时间随访一次,不必每三个月随访。因为在原位癌的阶段的时候,它是一个发展非常缓慢的、处于休眠期的、没有任何症状的、没有毒性的、无害的「懒癌」,英文称为harmless nodule/cancer without disease。原位癌(AIS)是癌,但是别害怕,不要把它当做一个「恐怖分子」,只是个[坏分子]而已。所以这样一个长期的5~10年的病史,你刚发现就非常紧张了。患者往往是「见癌就慌,见磨就恐」,医者往往是「见磨就切,见磨就动」。其实这两个极端都不太必要。只有当原位癌上升到微浸润癌(MIA)的时候,才会出现较快的发展阶段,因为我们知道1mm³的癌组织含有100万个癌细胞,那么1cm³的癌组织就有1000万个癌细胞,这才是很可怕的。你不抓住这个10mm以下的微小肺癌,就容易使得癌细胞窜到血液中去。所以我们往往将1cm作为早期微小肺癌的临界值并用来作为有无风险的评估,我们叫它cut off值,不能再留了,不能再等了。
如果不抓住10mm以下的微小肺癌的话,让它发展下去,IIA期、IIB期、III期肺癌的5年生存率将急速下降,分别降至46%、36%、20%。因此,对于微小肺癌来说,要把诊断和治疗的关口前移到10mm以下,才是提高肺癌治疗水平与提高肺癌五年生存率的关键所在,把握好AIS与MIA的影像诊断是关键。
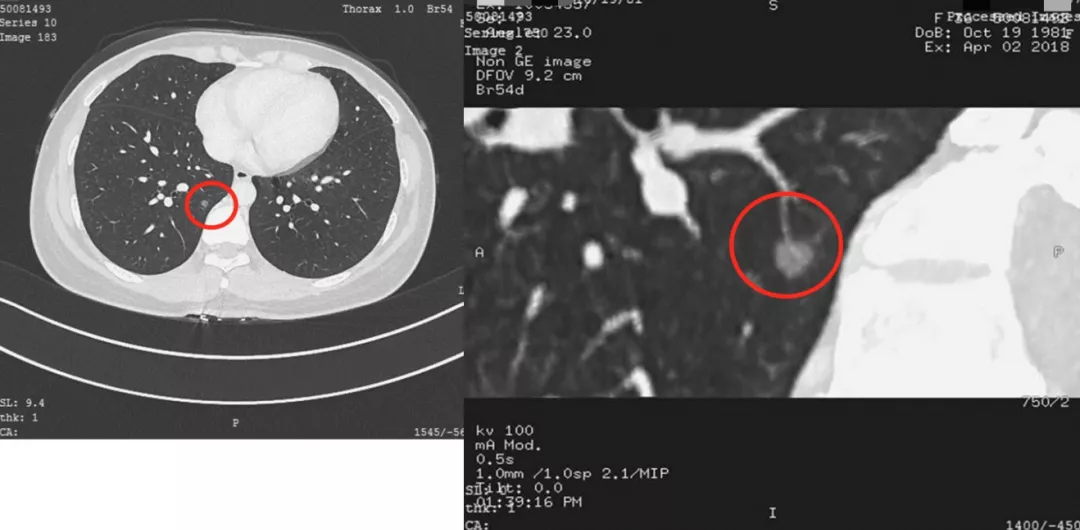
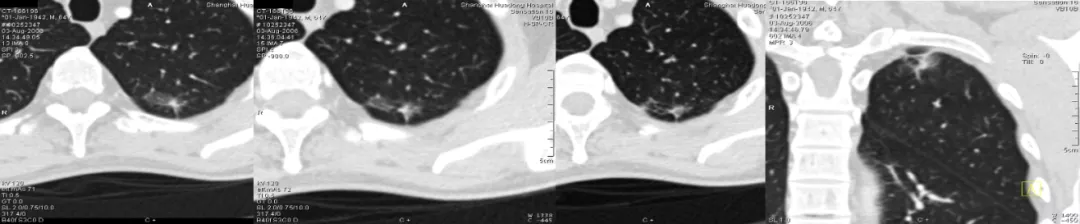
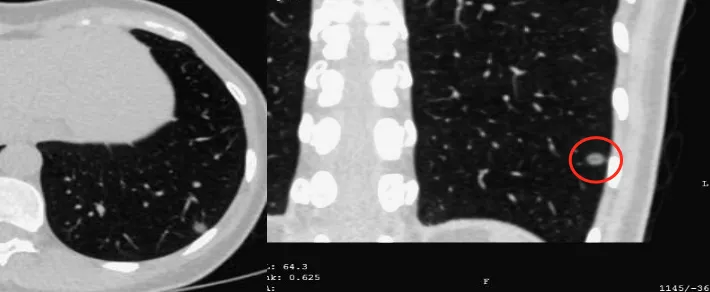
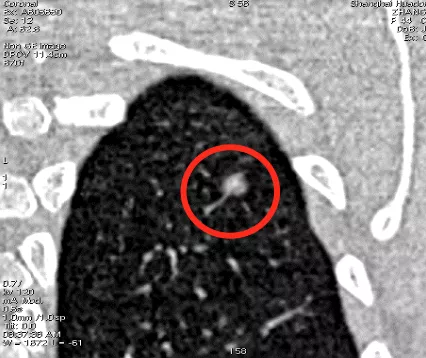
这是一张CT横断面图片。可以看到在右下肺内基底段有一个非常小的4~5mm的磨玻璃病灶(小红圈),你能诊断它是癌吗?我不敢。为什么?周围没看到血管、气管充气征等情况,我只能诊断是一个磨玻璃病灶。但是只要做了图像后处理,把这个结节放大观察,可以看到血管直接进入结节内,因此我马上就可以拍板这是原位癌(大红圈)。但是不要紧张,我刚才提到原位癌有五个特点,我们叫做dormant,它处于休眠期,还不会害你,不至于成为「恐怖分子」,但是现在至少它是个「坏分子」了。
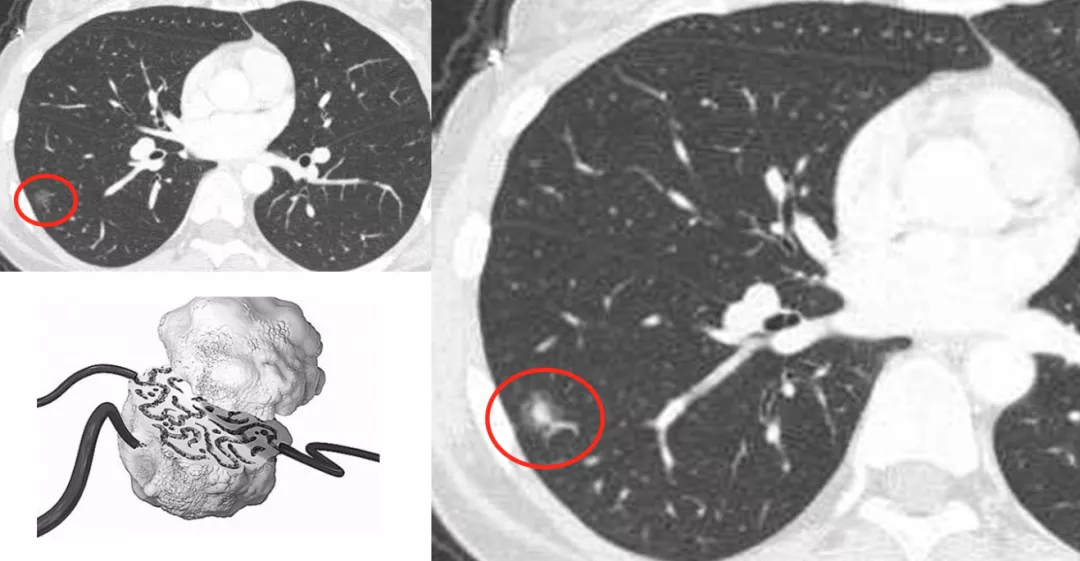
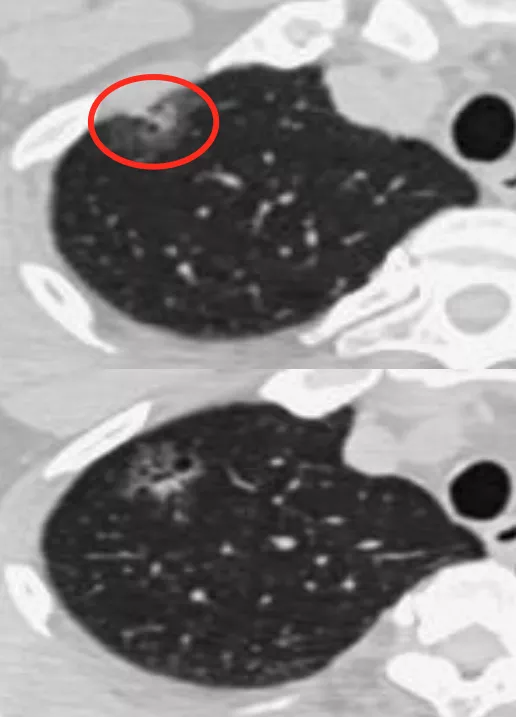
这是另一张CT横断面图片,可以看到在右肺下叶外侧基底段有一个磨玻璃病灶,你能诊断它是癌吗?不能。但是当进行了图像后处理与增强扫描后,可以看到有一根血管进入了磨玻璃结节,磨玻璃结节内部有一个高密度的白颜色的浸润灶,但是都在5mm以下。所以可以明确地告诉患者,这是微浸润腺癌,必须手术。因为刚才提到微浸润腺癌的阶段是一个急速上升期,高危程度明显增加。
目前来讲,七、八十年代CT横断面统治的时代就要结束了,现在进入三维时代或者是四维时代了。因此,在2015年我们医院联合了上海胸科医院、肺科医院、华山医院、河南省肿瘤共同合作,编写了一本国内外首部专门论述微小肺癌的专著,受到好评。在2018年,又出版了英文版,但是英文版的书名改为《Early-stage Lung Cancer》,没有把微小肺癌突出来,因为早期肺癌本身就包括了微小肺癌。同样让全世界听到了中国学者的声音,也获得了非常好的评论。
二、0~IA1期微小肺癌CT诊断处置原则的新理念
诊治端口要前移 重点必须在零期
四增
对于微小肺癌的影像特征的新理念是什么?我向大家提出「四增」这个理念。因为在对体检发现的纯磨玻璃结节(GGN)长期随访的过程中:1.GGN有增大,比原先的大小增加2mm以上;2.GGN有增密/实,即CT值增加至-300HU,而且病灶内有高密度的白色小点出现;3.GGN有增强,指在结节内密度有强化;4.血管有增粗,指肿瘤血管的增粗。有这样的「四增」的征象,就意味着GGN从原位癌逐渐演变、转化、发展到了微浸润阶段,就是微小肺癌早期的影像特征。刚才所说的分叶征、毛刺征、空泡征还是有用的,但这是相对稍晚期的征象。
四抓
同时还要做到什么?做到抓早(0期 Tis)、抓小(IA1期 MIA),就是抓住微小肺癌;要抓准,即术前正确定性、定位;还要抓好,这个意思就是说胸外科、放射科和病理科这三个科室一定要联合协作,提高5mm微小病灶病理取材的准确性。因为切下来的病灶非常小,可能只有4~5mm,病理科都不太容易找到,有时候我们还要把标本先到CT室去充气,再重新定位,最后才送病理科,这样就能保证病理取材的准确性。
四要素
在CT扫描技术处理上,我们要求CT图像要进行薄层重建,至少是1mm层厚;要作增强扫描;要测数据,即测量平均CT值;还要用软件,用图像后处理的软件,包括MPR、MIP、CPR、VR等。
四重点
如果能够测量结节的平均CT值;寻找出肿瘤微血管;运用3D成像技术;观察影像和血管的关联,那就没有解决不了的问题。对微小肺癌是可以作出正确的影像提示判断的。
三、纯磨玻璃结节CT量化数据所提示的病理意义
CT值是组织密度值,纯磨玻璃结节的平均CT值对良恶性的判断是有一定参考价值的。病理上纯磨玻璃结节从AAH演变、转化、发展至MIA的过程中,由于其肿瘤细胞增殖能力逐渐增大,排列密度逐渐增加,侵袭能力逐渐增强,因而纯磨玻璃结节的平均CT密度值随之会有较大的升高。
在肺微小结节的动态随访过程中,纯磨玻璃结节(GGN)密度的平均CT值有以下三种情况:
GGN CT值在 -700~-600 HU的范围,提示是良性阶段,处在安全区;
GGN CT值在 -600~-500 HU的范围,提示恶性几率较低,处在中间灰色区,是个坏分子,还达不到恐怖分子,但它还是安全的,处于休眠期;
GGN CT值在 -500~-400 HU的范围且有进行性增高,提示恶性几率加大,处在风险区。
四、肿瘤血管生成过程
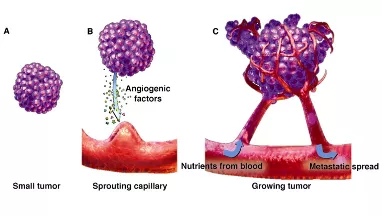
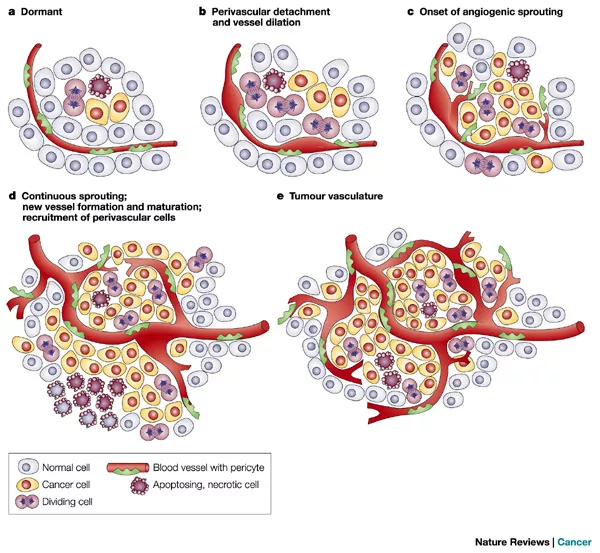
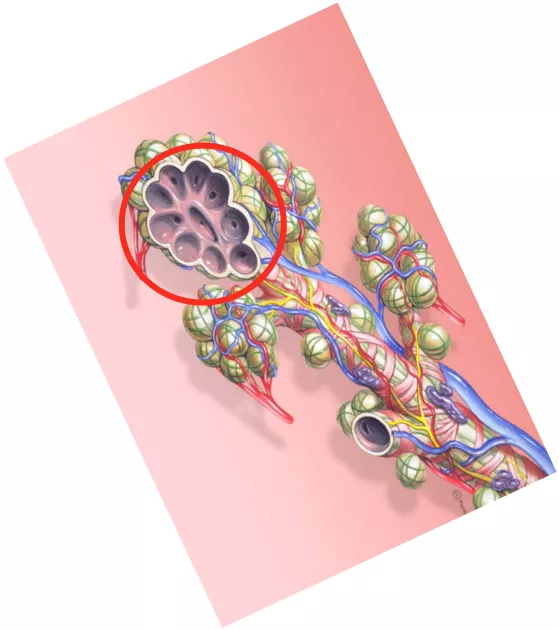
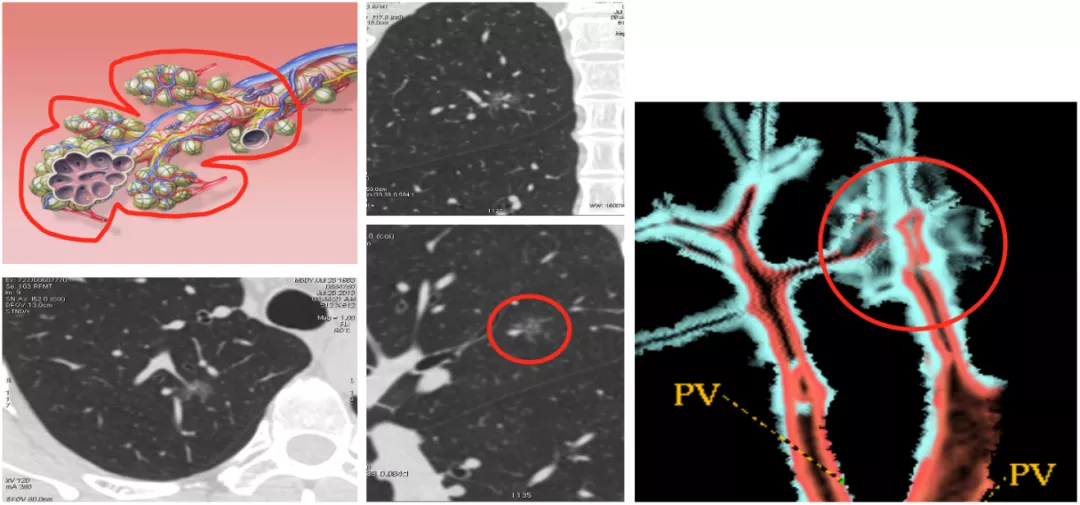
肿瘤体积小于2mm的早期生长阶段,没有血管也可以通过扩散获得周围组织的营养和氧气;当实体瘤直径大于2mm时,需要诱导生成新血管来获取血供,否则肿瘤就会缺血坏死。随着肿瘤体积增大,肿瘤营养和氧气供应不足,会诱导肿瘤细胞释放多种血管生成因子。要记住,只有肿瘤细胞才会分泌血管内皮生成因子,血管内皮生成因子有多种,主要是VEGF(vascular endothlial growth factor),还有少量的VPF、EGF等。它分泌这些血管生成因子是什么意思呢?引起血管内皮细胞形态改变、迁移、增殖,随后可以不断刺激肿瘤周围的毛细血管,长出毛细血管芽并移动进入肿瘤内,再形成联通的微血管网,我简称它为「移动+联通的血管」。
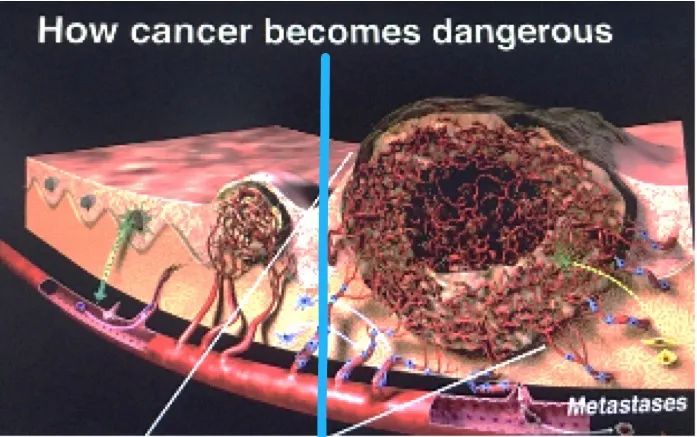
有了这样的征象,就达到了微浸润腺癌的诊断标准了。在这个时候如果不进行干预,任其再发展下去,肿瘤会发展长大,丰富的血管急速生长,很快就可以形成转移。所以非常小的5~6mm微浸润肿瘤怎么也会变成有危险性的呢?就是由于血管越多,转移的可能性就越大。而其他良性的结节,如炎性肉芽肿、结核球、错构瘤、结节病等,它们都没有VEGF的分泌,没有肿瘤血管的生成,没有这些移动+联通的血管征的出现,所以可以很明显地把它们区分开。
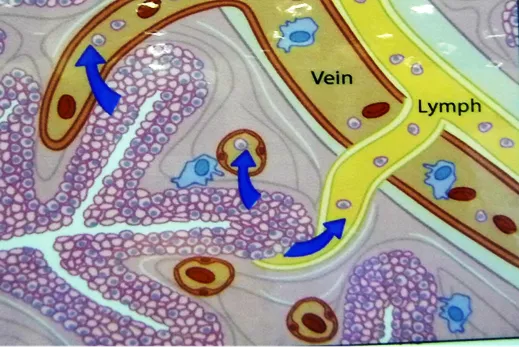
上图显示肿瘤转移的途径:一是肿瘤细胞可以向间质渗透、浸润(invasion),因为肺泡间隔、小叶间隔的结缔组织内有丰富的淋巴管和静脉。
二是肿瘤细胞通过血管壁内渗(intravasation)入血液形成远处转移。所以即便是早期(IA1期)肿瘤,同样也存在癌转移的风险。
肿瘤微血管CT成像征
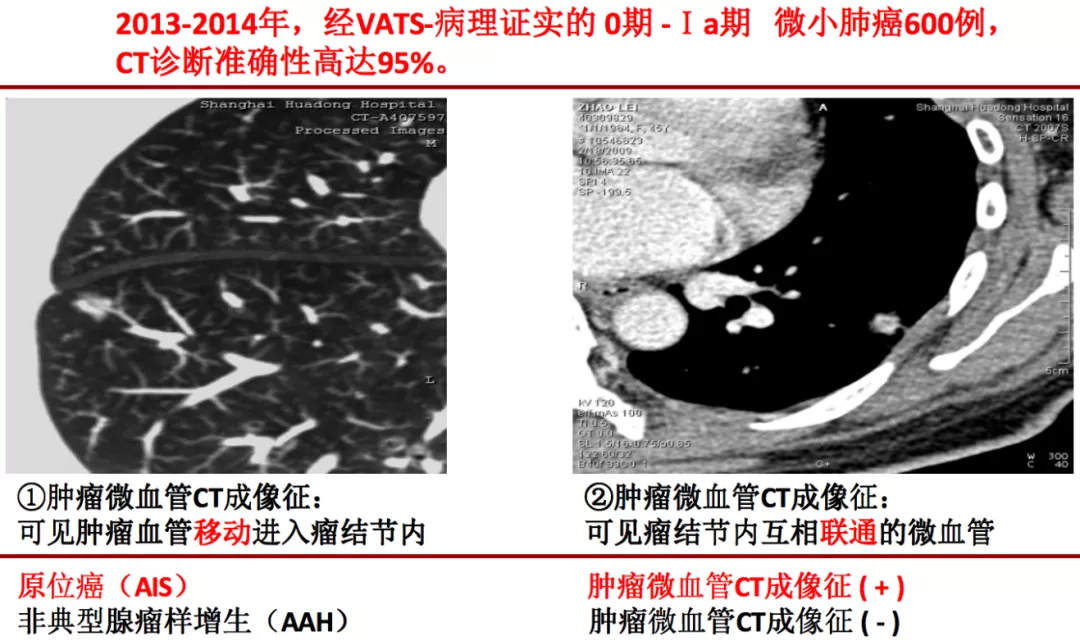
肿瘤微血管CT成像征是我们团队总结出的一种新征象,它与以前的血管集束征和CT血管影像征不属同一来源,它是评价微小肺癌的一个很重要的CT征象。我们把它系统化,归纳为肿瘤微血管CT成像征。
肿瘤微血管CT成像征是肿瘤细胞内部分泌的血管生成因子刺激周围毛细血管产生毛细血管芽,毛细血管芽长大成血管后可移动进入肿瘤内部,即称作为「移动血管」,再在肿瘤内部形成相互联通的、丰富的血管网,即称作为「联通血管」,这包括微小血管进入瘤结节后形成穿过、连接、汇合、截断、变窄、僵直、扭曲、牵拉、聚集、强化、增粗等多种CT征象,可总称为「肿瘤微血管移动-联通征」或称「肿瘤微血管CT成像征」。
要特别注意的是什么?如果血管很自然地穿过,可能在极早期;如果血管受阻、有截断、弯曲、扩张,那就严重一些。所以要具体分析,有的就在旁行,也可有一小分枝进到结节里,这种都是原位癌的表现。所以原位癌和微浸润癌的界限就在于虽都有移动血管,但是原位癌没有联通血管,而非典型腺瘤样增生(AAH)根本就没有移动和联通的血管。所以这样就可以在影像学上大体把它分成三类:AAH,AIS,MIA。
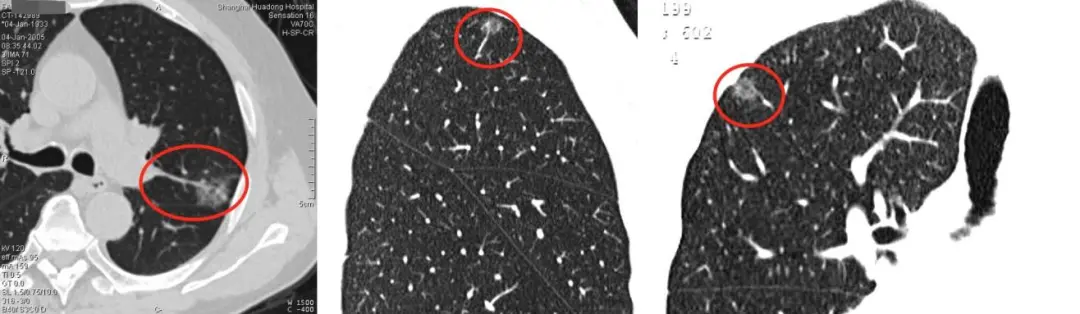
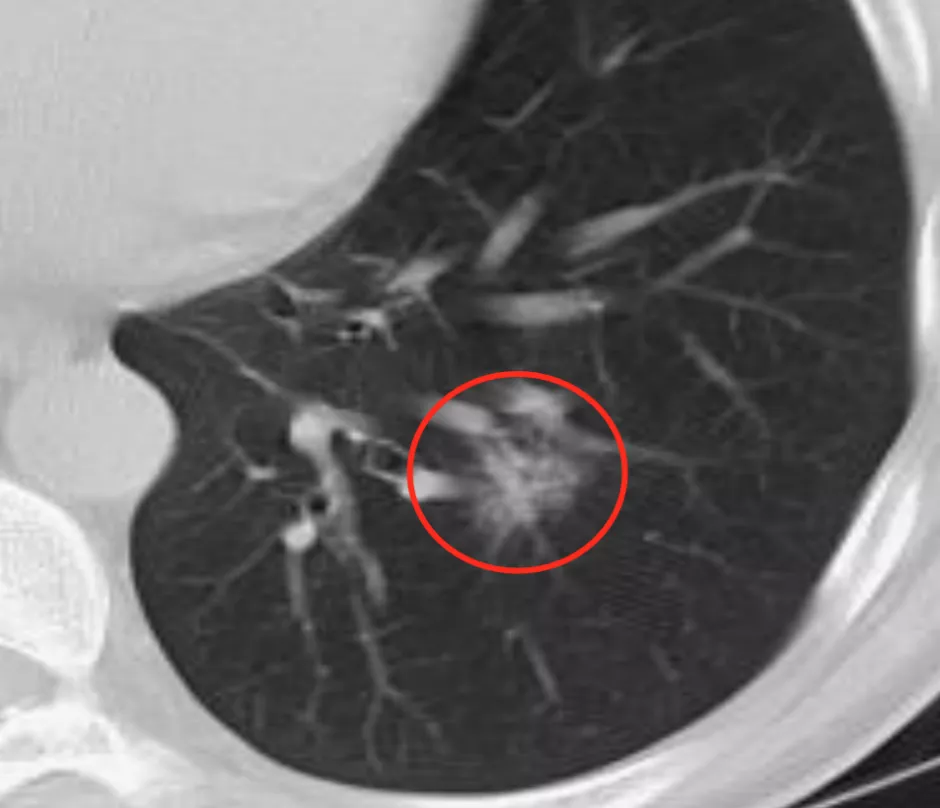
上图红圈处均为移动血管加联通血管,这是肿瘤微血管CT成像征。
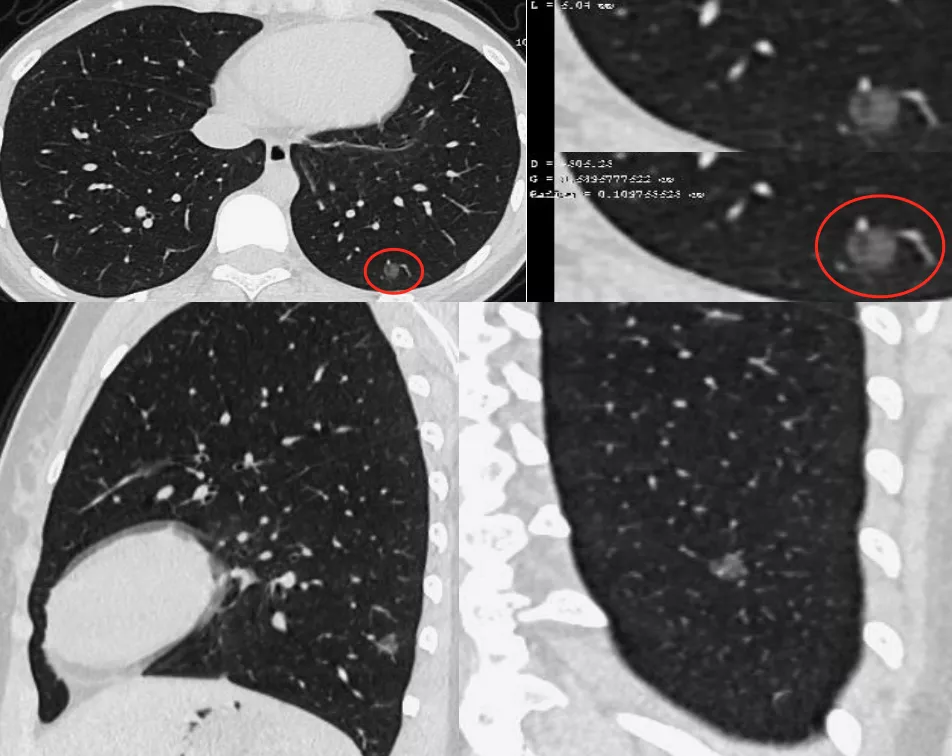
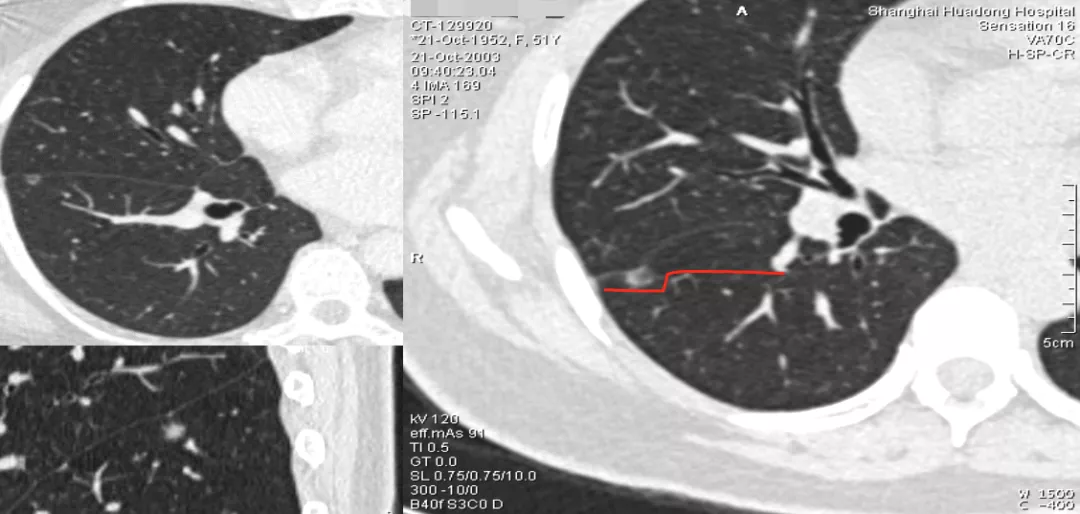
上图为支气管血管集束征,这是从肺门侧走向肿瘤的多条肺血管、支气管、淋巴管周围的结蹄组织鞘显著聚拢、增粗并使邻近血管被牵引拉向结节所形成的,它不进入结节内,并非是真正的肿瘤供血血管,也可称谓「中轴间质增粗、增厚」。所以完全和肿瘤微血管CT成像征是两码事,不要混为一谈。
上图红圈处为肿瘤微血管CT成像,一看就知道是移动血管加联通血管。
五、0~IA1期微小肺癌影像诊断上的新标准
GGN + 肿瘤微血管CT成像征 = 肺微小腺癌
发现1:「肿瘤血管」,肿瘤微血管CT成像征或称肿瘤微血管移动-联通征;
发现2:微小肺癌的血供具随机性,可以是肺动脉,肺静脉,支气管动脉来源;
发现3:(与传统观点不同)增强CT扫描对于判断微小肺癌的影像诊断非常重要。
我们总结的「肿瘤微血管CT成像征」这一个创新概念是基于 1. 1971年 Folkman J .Tumor angiogenesis therapeutic implication .N Engl J Med. 1971,285:1182-1186. 2. 1993年Gaeta M, Barone M, Russi EG, et al . Carcinomatous solitary pulmonary nodules:evaluation of the tumor-bronchi relationship with thin section CT. Radiology,1993,187:535-539. 3. 2001年周清华:「肿瘤血管生成与肺癌发生」这些理论的基础上通过不断实践得来的。
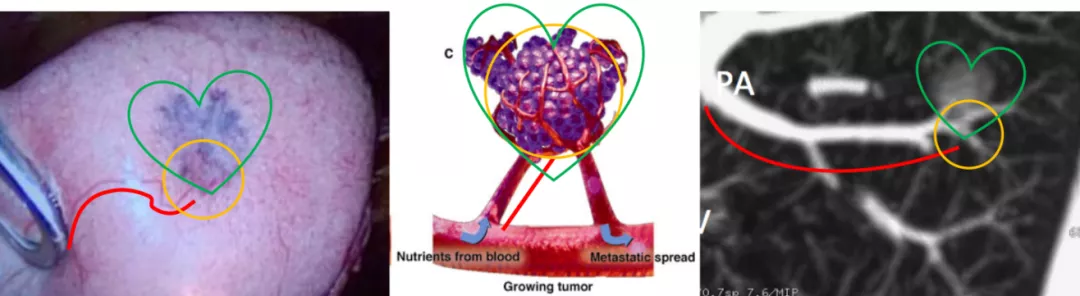
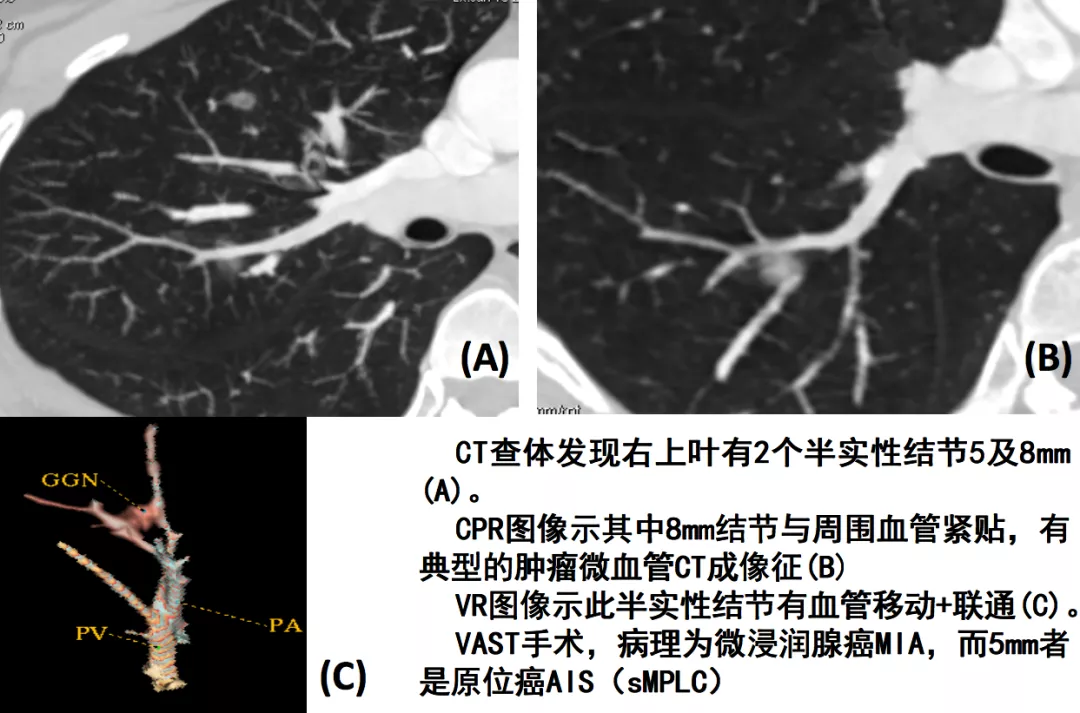
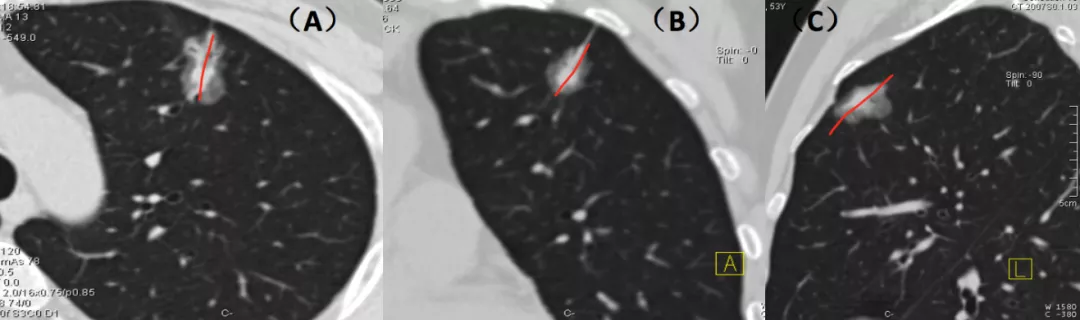
如上图所示,从左至右分别为手术所见、线条图、CT技术图像后处理的图像(红线处为移动血管,黄圈处为联通血管,绿心处为肿瘤长成鸡心状)。这就是微浸润肺癌。但是您要在术前诊断它,事前要做很多图像后处理的工作。我们提出CT技术图像后处理的新模式:多平面图像重组(multi-planar reformation,MPR)、最大密度投影(maximum intensity projection,MIP)、曲面重组(curved planar reformat,CPR)、容积再现(volume rendering technique,VRT)、肺血管三维图像后处理。这已成为发现肿瘤血管的基石,极大地提高了对微小肺癌,特别是AIS与MIA影像诊断的精准性。这些软件都是CT的标准件,也就是购买CT的时候都附加在里面的标准配置的软件。
下面介绍两个病例
病例1
一名17岁的来自丽水的高二女生,无家族史,抗炎无效,左下肺有一个6mm GGN,放大以后可以看到血管有旁行(红圈),是不是进入结节内呢?
我们必须做图像后处理,沿着血管做了CPR,可以看到左下肺后段有移动血管加联通血管(红圈)。
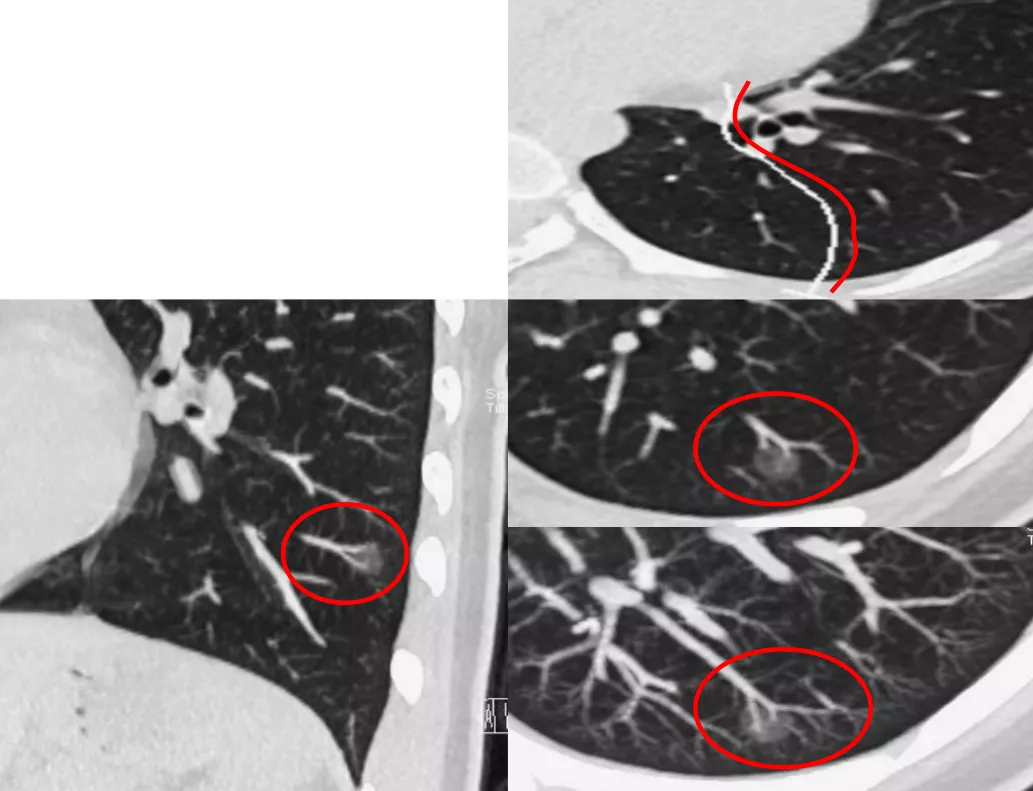
这个时候要胸有成竹的、直截了当的和家属谈话,尽管孩子只有17岁,但是患有微浸润腺癌,必须手术。最后通过手术病理证实为微浸润腺癌。
点评:所以既不能对肺微小结节长期姑息,不断随访,不做定性;也不能在没有明确诊断的前提下对肺微小结节进行不必要的手术,切不可「见磨色变」、「见磨就开」!
病例2
无独有偶,另一杭州15岁的高一女生,右上肺前段6mm部分实性GGN,有家族史,抗炎无效,你能诊断她是微小肺癌吗?她已经「周游全国」看病了,谁都没有给她诊断,到你这再不做出一个良、恶性的诊断,就不应该了。可是一个横断面的CT检查,只是做了一半,没有作图像后处理,还是不能明确诊断。
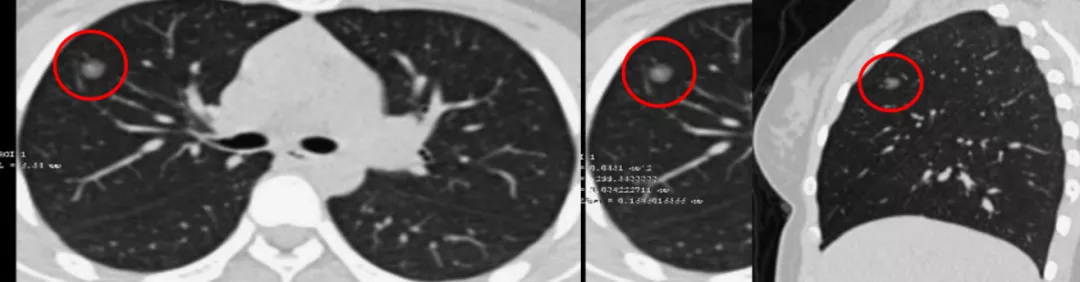
做了图像后处理(红圈、红线),可以看到移动血管和联通血管进入,CT诊断为微浸润腺癌。
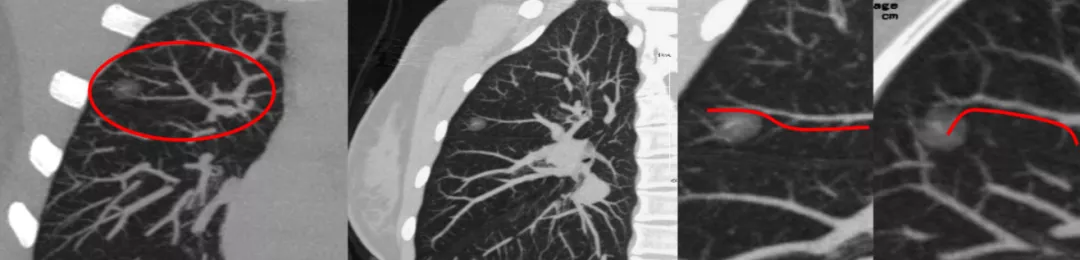
点评:所以对付癌中霸主的肺癌:早期筛查、早期诊断、早期治疗是最有效的手段与办法!
附注:为什么说无独有偶呢?因为病例中的这两个孩子,一个上午来住院,一个下午来住院,同收一个病房,同一间病室,同一天手术,同一天的病理报告都是微浸润腺癌。做了微创手术,你就救了这两个孩子,她们现在都读大学了。
所以只要有移动血管加联通血管,是长期随访的磨玻璃病灶或者部分实性的病灶,并且不消失的,可以考虑是原位癌或者微浸润腺癌。因为原位癌是在浸润前期的良性阶段,我们有时給出的CT报告有时是这样写的「目前虽处在良性阶段,但可以进一步向恶性的微浸润阶段演变、转化,发展」。
六、使用3D成像技术作鉴别诊断
用三维成像技术进行微小肺癌的鉴别,主要是与良性结节做鉴别。
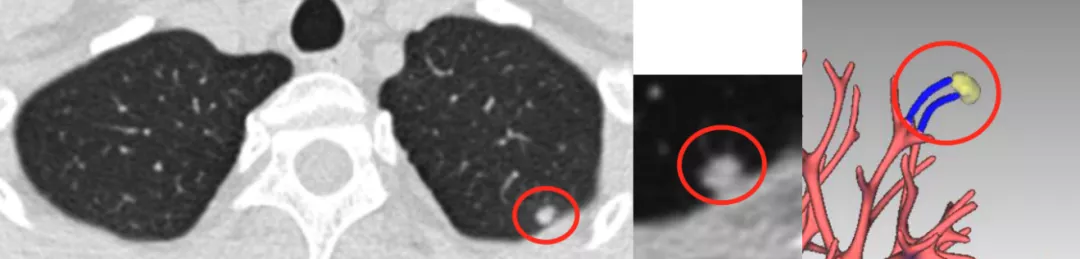
上图是左肺上叶尖段一个非常典型的高密度结节,我们作了三维成像,蓝色的血管进入到结节里面了吗?答案是没有(大红圈),你可以斩钉截铁地说这是肉芽肿,进行抗炎治疗,3个月后结节消失。
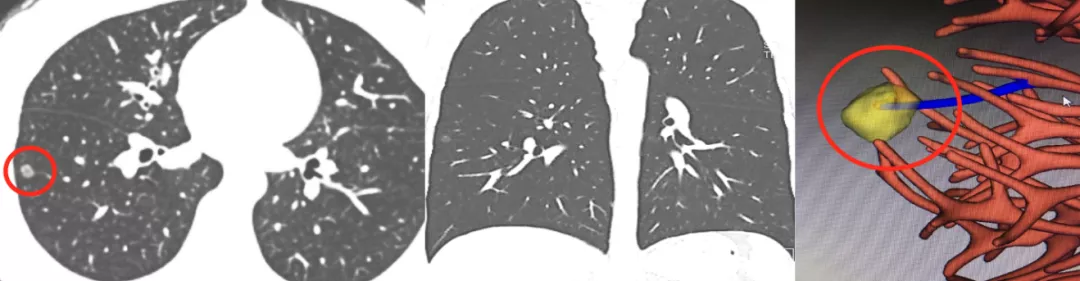
但是如上图所示,这么小的一个结节,在右下叶外侧基底段胸膜下(小红圈),蓝色的血管进入了黄色的结节内(大红圈)。很容易下结论为是早期的微小肺癌。这样的结节如果不作图像后处理可能还是无法解决问题,所以需要花点时间做三维成像。
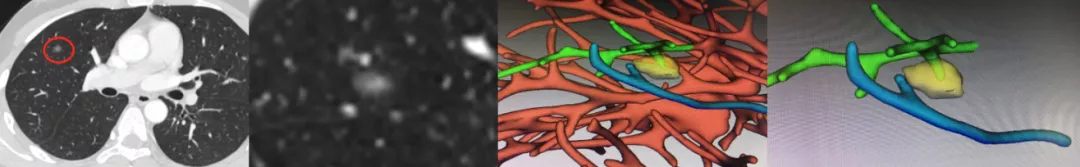
如上图所示,这么小的一个病灶,在右肺上叶前段,部分实性的(小红圈)。有没有血管进入结节?做了三维成像后,浅绿色的血管进入了黄色的结节内,同时结节内还有高密度成分,所以判断为微浸润腺癌,手术病理结果也是微浸润腺癌。
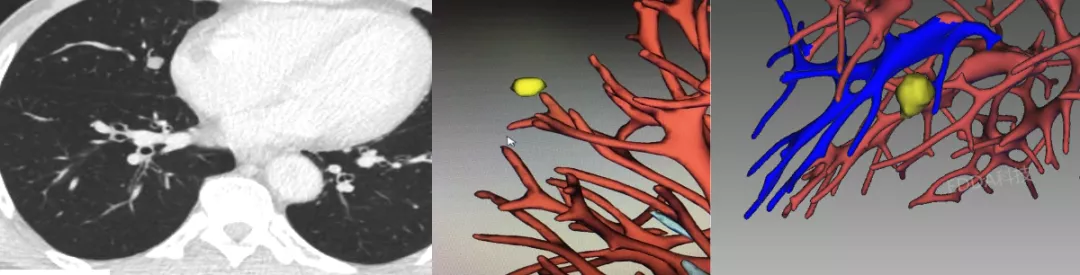
如上图所示,实性的结节,血管有旁行。但是经过三维图像处理后,不管从哪个方向都没有看到血管进入这个结节内,我们诊断为良性结节。病人害怕是恶性结节,还是选择手术,在我们医院手术后结果为错构瘤。
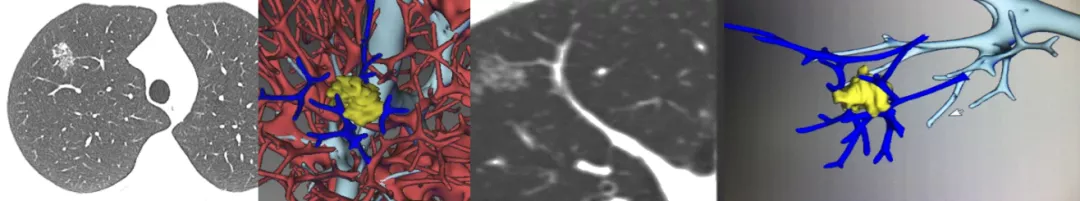
如上图所示,这个结节非常像肺癌,老姜似的生长,有血管旁行。我们诊断为肺癌,手术结果为炎性肉芽肿。回顾性作三维处理,的确没有血管进入结节。
点评:肿瘤微血管CT成像征 + 持续存在的纯磨玻璃结节 = 微小肺癌
而血管在病灶边缘走行,不进入结节内 = 肉芽肿、错构瘤、结核球
只有肿瘤细胞才分泌血管生成因子(angiogenic factors:VEGF等)产生新生的肿瘤血管,非瘤细胞则无此功能。
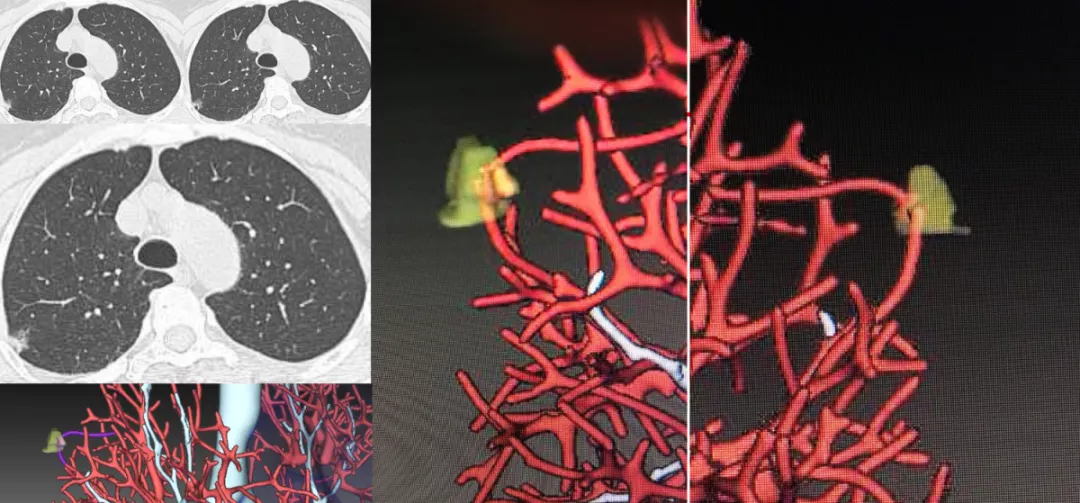
如上图所示,在右肺上叶后段胸膜下的混合密度微结节,看不见血管。作三维图像后处理:上、下两根血管在结节前方与后方都能显示,这两根血管中间还加了一个黄颜色比较高密度的浸润灶,小于5mm,这是一个典型的微浸润病灶。手术证实是微浸润腺癌。
七、随访观察时间
往往病人焦急于随访观察的间隔时间,总觉得3~6个月的复查太短,最后还要随访到猴年马月呢?所以我很清楚地告诉病人,一般在三年之内,结节要是变恶性就变了。所以对于纯磨玻璃结节,CT值在-600~-700的范围内,一年复查一次足已,不需要3个月、6个月的复查,因为结节此时处于休眠期。三年不变,一定要随访到六年,六年再不变,你心里就有底了,80%不一定是肺癌,但还有20%不能排除,所以最好随访到九年。到了九年,如果还是没有变化,完全可以把它剔除在外,可以让这个病灶「无罪释放」,病人不用再来找你进行CT复查了。
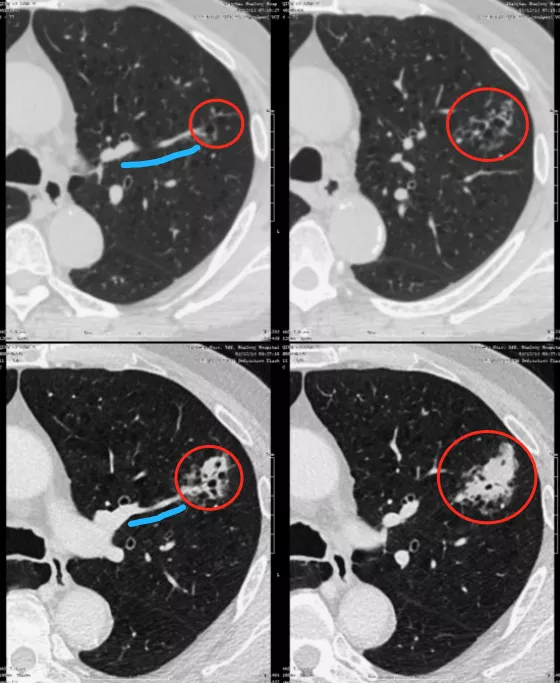
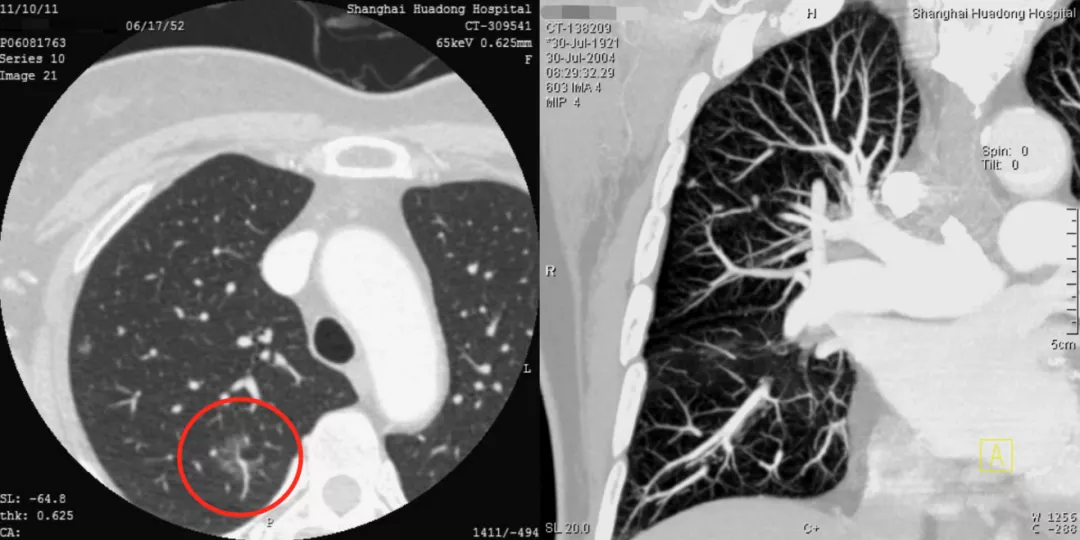
如上图所示,一位71岁的男性患者一年的随访时间,结节就发生了变化,从一个颗粒样的小结节变成很大的腺癌,为什么?因为这根肿瘤血管非常粗(蓝线)。
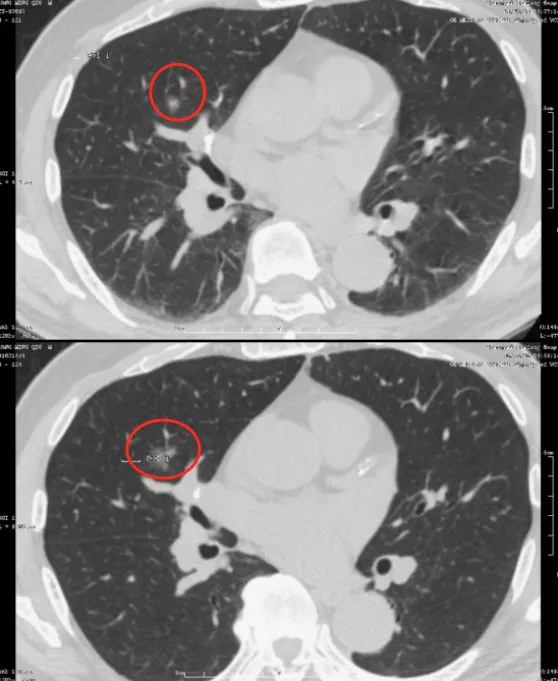
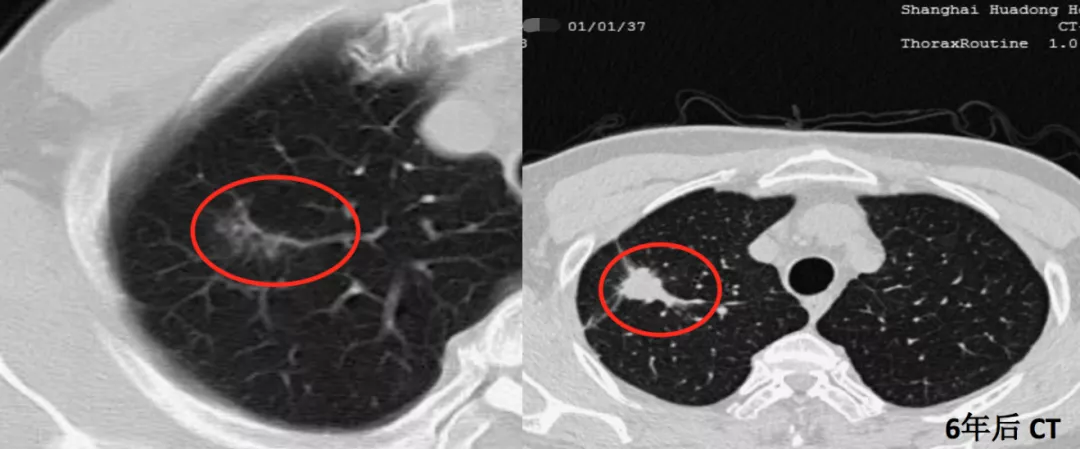
另一位同样是71岁的男性患者,右中叶有一个很小的磨玻璃结节,随访到6年,才变成了微浸润腺癌(红圈)。这又是为什么?因为周围血管不丰富,没有产生肿瘤血管,因此一定要随访到6年。新版指南上提到是随访5年,我个人认为5年的时间不够,极个别病人还要随访到9年,9年才看到这根肿瘤血管长出来。
点评:肿瘤演变、发展时间的长短取决于肿瘤血管的粗细多寡及生物学行为。
八、微小肺癌CT形态分型与病理的相关性
在肺腺癌发生、发展过程中的早期阶段,其发生的部位可以是在肺泡、肺泡管,也可以是在呼吸性细支气管、肺小叶支气管等各种不同的部位,这就可以造成肿瘤有各不相同的影像形态。又由于肿瘤在不同区域的发展往往常是不同步的,在同一肿瘤的某些区域可以表现出停滞不前的状态,在另外区域则表现出退缩状态,又有些区域还可表现出很活跃的状态,这同样也可以造成肿瘤有各不相同的影像形态。这两个病理基础就造成肺腺癌在CT影像上可以呈10种类型的形态改变,从而才能对微小结节肺癌作出精准的CT诊断,这是我的团队总结了多年来的经验,创新的成果。
同时性多原发肺癌(synchronous multiple primary lung cancer,SMPLC)
1、棉球型
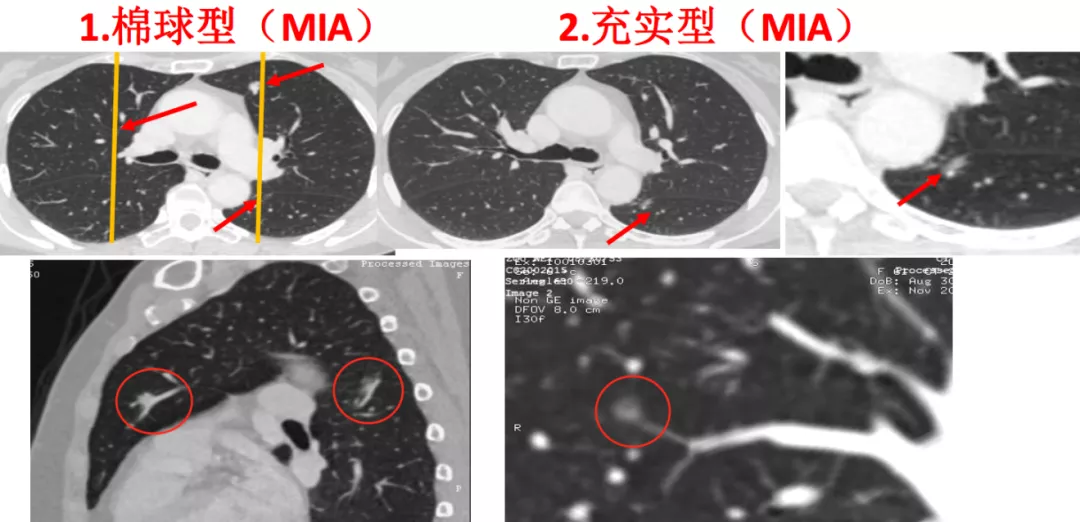
如图所示,有磨玻璃病灶,同时还有实性病灶。对于纯磨玻璃病灶我们称为棉球型,实性病灶称为充实型或者实体型。这个病人肺内一共有三个病灶,左肺两个,右肺。对一个在左上叶前段,另一个在左下叶背段的病灶,作了很简单的MPR,可以看到左上叶前段和左下叶背段的这两个病灶,一个是实性病灶,有血管的(红圈);另一个是磨玻璃病灶,也有血管的,并且血管粗,超过2mm以上(红圈),我们诊断为微浸润腺癌(MIA)。可是还有一个磨玻璃病灶在右肺,进行图像后处理发现,一根很细的血管进入磨玻璃病灶,这是原位癌(红圈)。所以两个病灶是微浸润腺癌,一个病灶是原位癌。由于这个病人年轻,身体比较好,所以只做了一次胸腔镜手术。
异时性多原发肺癌(metachronous multiple primary lung cancer,MMPLC)
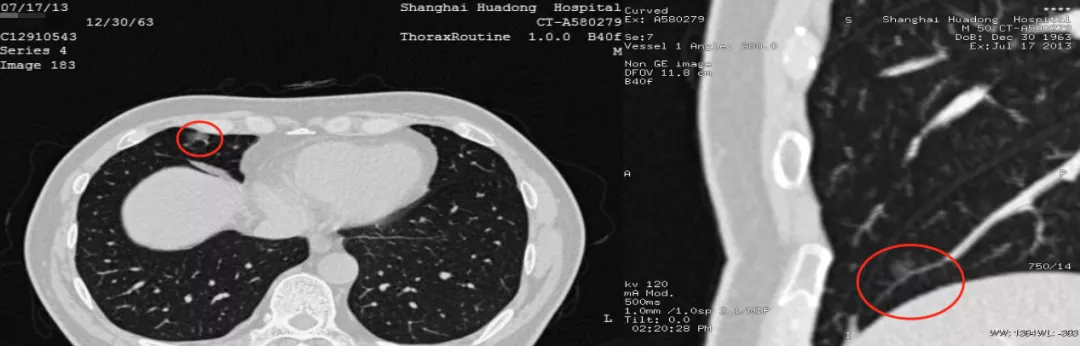
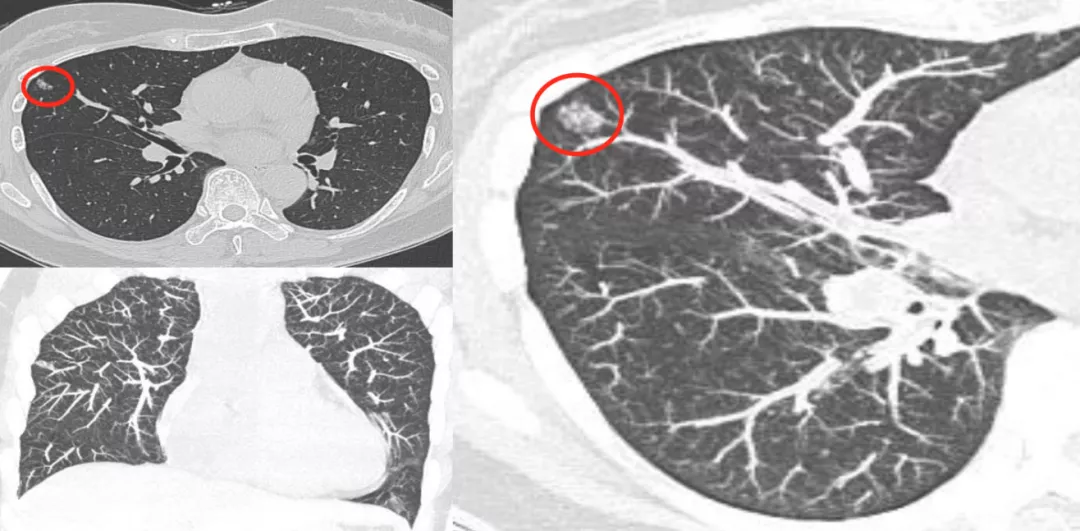
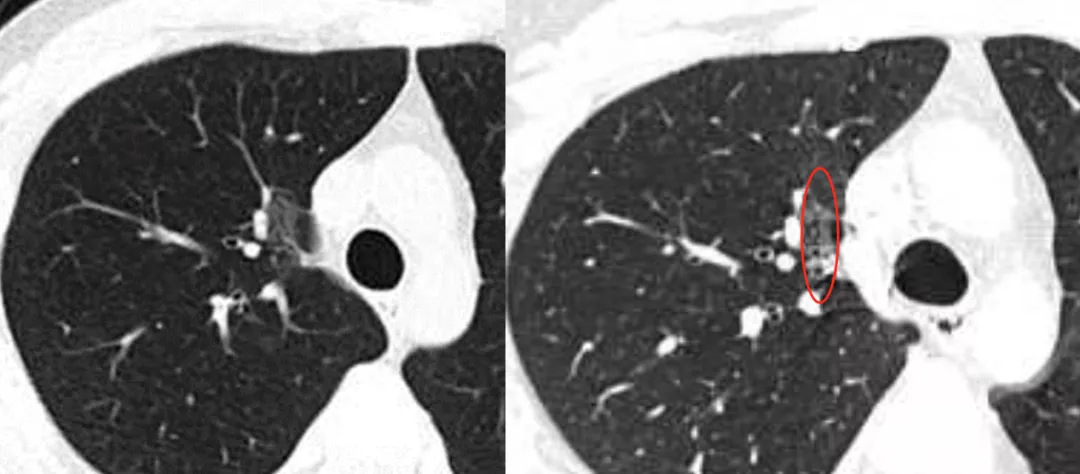
磨玻璃病灶在右中叶(红圈),图像后处理满意吗?还不够满意。
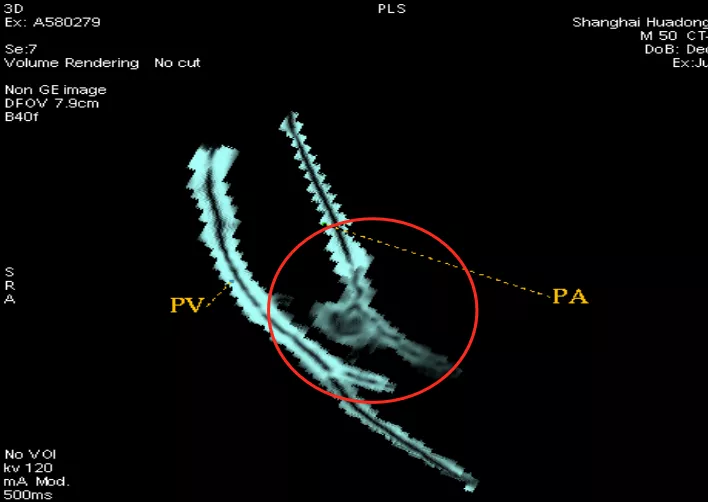
于是我们再做了VR加MIP(大红圈),叠加以后可以看到这根小动脉移动到结节病灶里去了。记住是MIP加上VR联合起来做,这样更能凸显血管和结节的关系。手术病理为原位癌。
三年后左肺下叶胸膜下又长了一个部分实性微结节(红圈),手术病理为MIS,这是一个异时性的。
2、充实型
这种充实型的腺癌不少见,但是比较难明确,比磨玻璃病灶更难诊断。
充实/实体型肺癌的病理基础
有一部分肺腺癌,例如ALK基因易位重排的腺癌,在其发生的早期阶段,由于产生原位癌的基底细胞增生(basal cell hyperplasia,BCH)不经过、不遵循常规逐步转化过程及演变模式,而是绕过/跳过了伏壁生长期并快速与黏膜下的受累腺体直接相连,受累范围可以是腺体的一部或全部,也可以是单个或多个腺体,然后快速增长再发展成为密度稍高的实体结构,一般CT值可在-300 HU以上。在CT影像上就表现为充实/实体型原位癌。
不要认为实体型腺癌都有毛刺、分叶,没有毛刺、分叶、支气管充气征也可以是腺癌,甚至这种实体型的1cm左右的结节,连pet-ct检查代谢都很低。所以随访很重要,我认为随访间隔时间不要太短,3~6个月不起作用,至少9~12个月为宜。
3、颗粒型
如图所示,这是一个右中叶胸膜下的结节(红圈),很容易当成结核。
为什么它这样长呢?这是原位癌累及多个肺泡或肺泡囊(是由相邻的多个肺泡围成的空腔),形成多个细颗粒状的CT表现(红圈),就像葡萄串似的。所以单个的叫颗粒型,多个的叫堆聚型。
这是单个的肺泡囊,颗粒型(左图)。当作肺结核观察了6年,就变成实体型,出现毛刺、分叶、胸膜凹陷(右图)。所以大家对早期征象一定要有所了解。
4、堆聚型
好多肺泡囊堆积起来就是堆聚型。原位癌累及多个颗粒状的肺泡或肺泡囊继续长大,互相堆聚,互相凑合,其范围不超过3cm,不出现间质浸润,CT不出现5mm白色高密度灶。这种堆聚型的都是与血管紧挨着,或者在血管旁生长。有的很小,容易当做肺炎。
堆聚型使用抗炎治疗不吸收,不能再抗炎下去(红圈)。
5、管壁型
管壁型就是肿瘤沿肺泡管/呼吸细支气管黏膜像管子一样伸展生产,呈隆起的结节状增生,CT表现为细小串珠状的磨玻璃病灶(红圈)。肿瘤是怎么生长的?由于肺泡与呼吸细支气管之间有Lambert孔相连,肺泡里的癌组织可以通过Lambert孔进入呼吸细支气管中,或者原发就位于呼吸细支气管里,所以形成这种管壁型形态。
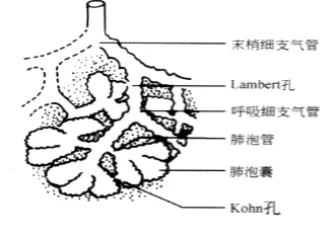
6、树枝型
树枝型就是肿瘤进一步沿多个细支气管范围伸展,或管壁浅层浸润,CT表现呈树枝状外观(红圈)。
多个管壁型就变成了树枝型,有的「树枝」还带着「树叶」,千万不要把它们误诊为肺炎。
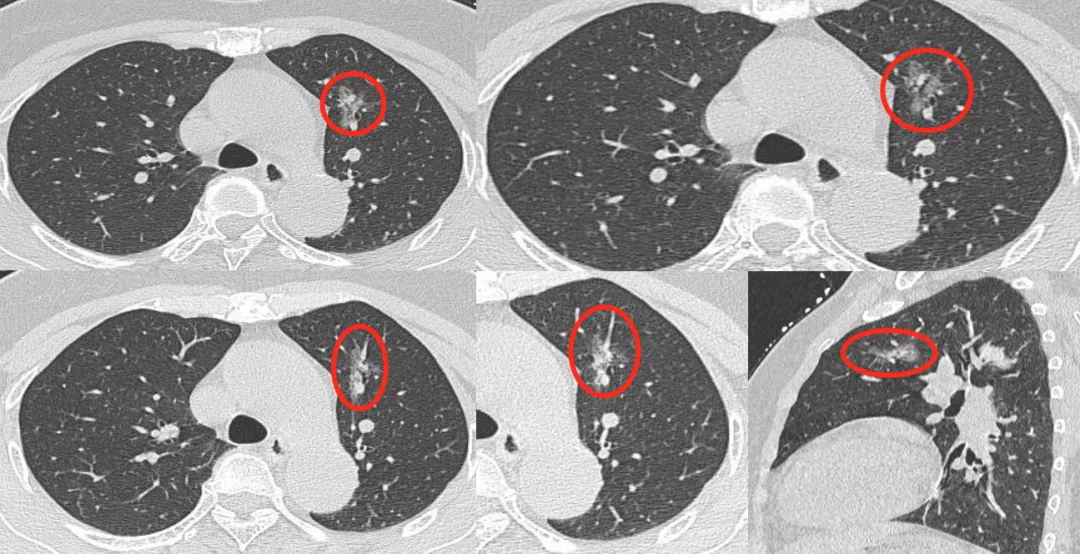
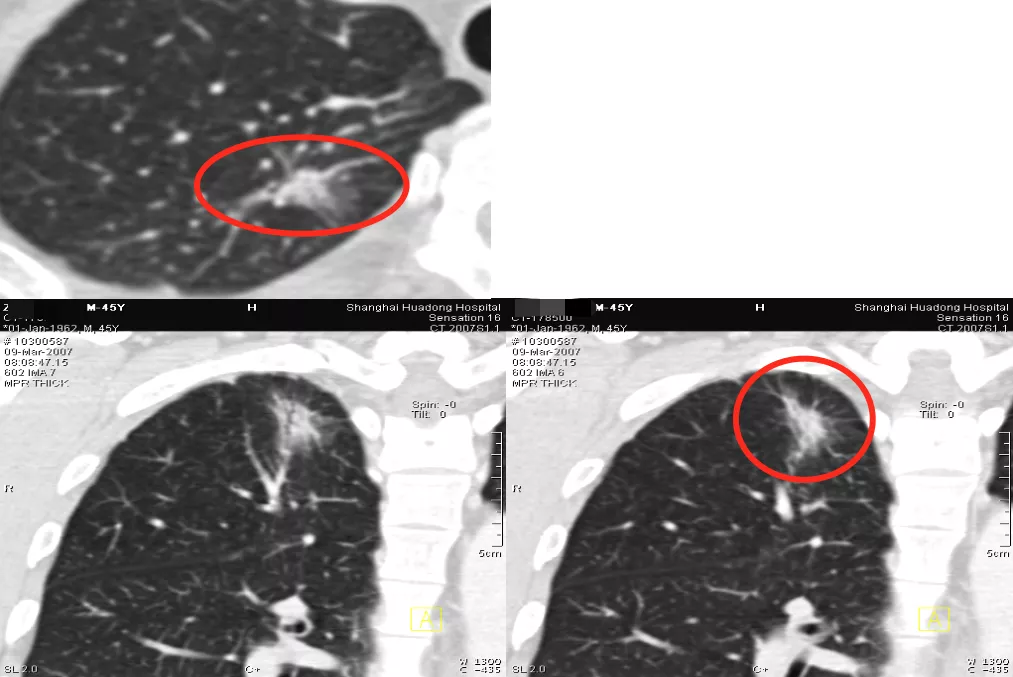
7、空腔型(cystic airspaces)
现在我们把空腔型统一叫做cystic airspaces,即囊性空腔征(如上图所示红圈处),大小在5~8mm之间。早期肺癌可以是空腔型,但不是它独有的。结核、霉菌也可以出现空腔,但是缺少肿瘤血管征,没有移动血管和联通血管,所以一定有血管移动进入结节才能放心地诊断为癌性空洞。霉菌空洞、结核空洞没有这种征象。
点评:肿瘤微血管CT成像征 = 肿瘤血管移动进入瘤结节 + 瘤体内微血管的互相联通成网
肺微小腺癌 = 体检发现、长期存在GGN + 肿瘤微血管CT成像征
如上图所示,这个病人随访到9年才出现肿瘤血管。我们把第1年~第9年的CT变化显示给病人看,我坚决主张做手术,但是大会诊的时候,有很些专家建议不要手术,因为结节太小了,争论很多。最后病人愿意做手术,病理结果为微浸润腺癌。
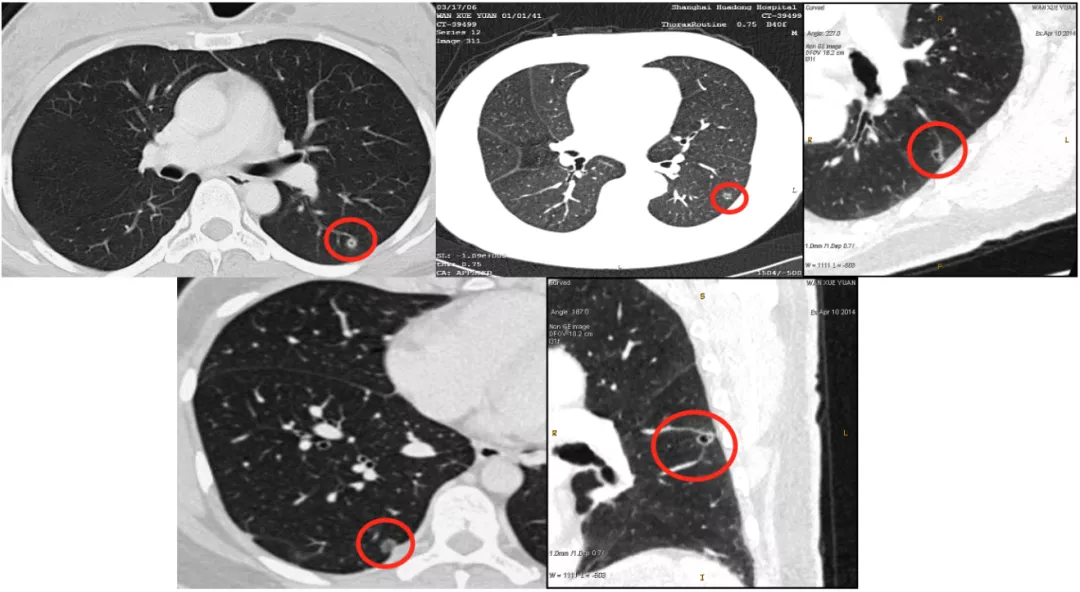
囊性空腔征的4种CT类型

我们总结了囊性空腔征有4种类型。第一种是长在空腔外壁上;第二种是长在空腔内壁上;第三种是沿着空腔壁生长;第四种是多个空腔。这四种类型绝大多数是肺癌,但是还是要和大家讲清楚,这不是肺癌特有的征象,一定要做图像后处理,找到那些肿瘤血管,才能放心作出癌性空腔的诊断。

以前的名称有很多种,比如假性空洞征(pseudocavitation)、「气泡样征」(bubble-like lucencies) ,但现在都归纳称为囊性空腔征(cystic airspaces)。
8、蜂窝型
蜂窝型是由多种空腔联合起来。沿肺泡壁生长的癌细胞未将残存的肺泡气腔封闭与未被肿瘤组织占据的含气肺组织形成假性空洞或「气泡样征」(bubble-like lucencies)。在病灶周围常有薄层肺萎陷圈,形成CT上的晕征(halo sign),这可以是瘤体增大向周围肺组织推压所致,并不一定是肿瘤的浸润或小动脉栓塞引起的。
9、瘢痕型
典型的肺瘢痕癌的CT表现是在炎性纤维瘢痕周围出现磨玻璃病灶包绕,靠近纤维化的边界新出现的小点状、小条片状、实性微小结节灶和/或新出现的胸膜皱缩。此种瘢痕纤维往往位于瘤体中心,病理上常伴多量碳末沉着,绝大多数都是腺癌。肺瘢痕癌的生长速度缓慢,倍增时间长,可达多年之久。因此对肺瘢痕癌诊断意义最大的仍是定期随访。
10、脐凹型
原位癌的瘤体如靠近胸膜,则与胸膜面形成脐样凹陷,这是由于瘤内纤维瘢痕牵行周围的肺间隔及血管所致。并非一定是累及胸膜产生的胸膜凹陷。脐凹型就是像项链一样,沿着胸膜下像个小坠子给它挂下来。这种类型很多,有实体的、有空腔的、有磨玻璃的,千万不要误诊。
九、肺腺癌演变转化规律
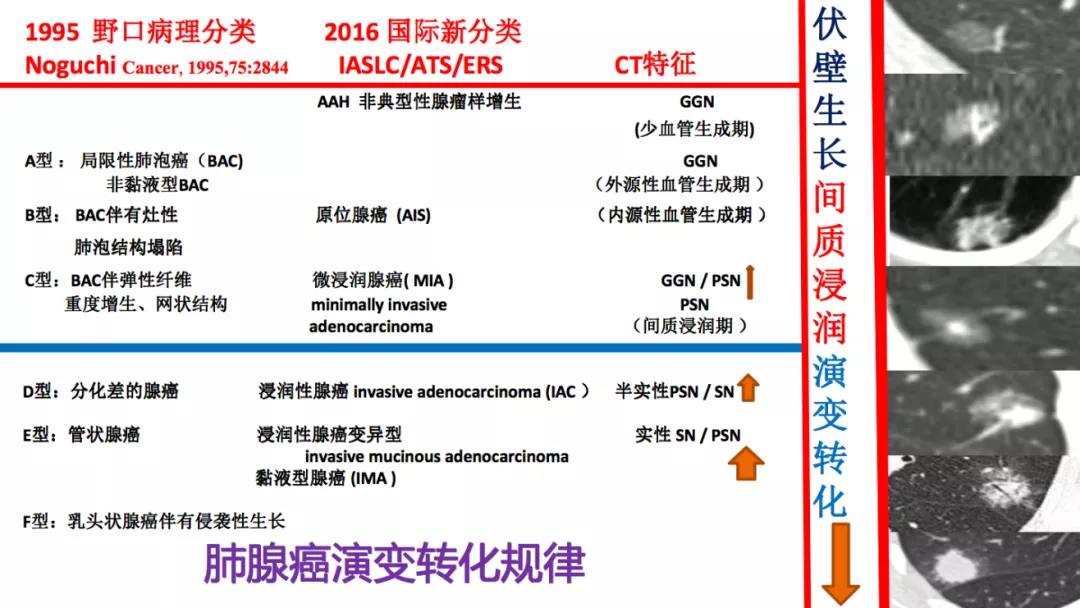
1995年日本教授Noguchi总结肺腺癌六种不同的分型。他分出来的肺泡细胞癌在2016年被国际肺癌协会替换为原位癌,不再叫肺泡细胞癌。我觉得肺泡细胞癌有自身的特点,细支气管肺泡癌就可以长到肺泡里,也可以长在细支气管里,这个定位还有一定的好处。所以AAH、AIS和部分MIA都处于癌前期病变,MIA以后的癌症类型发展就特别快了。
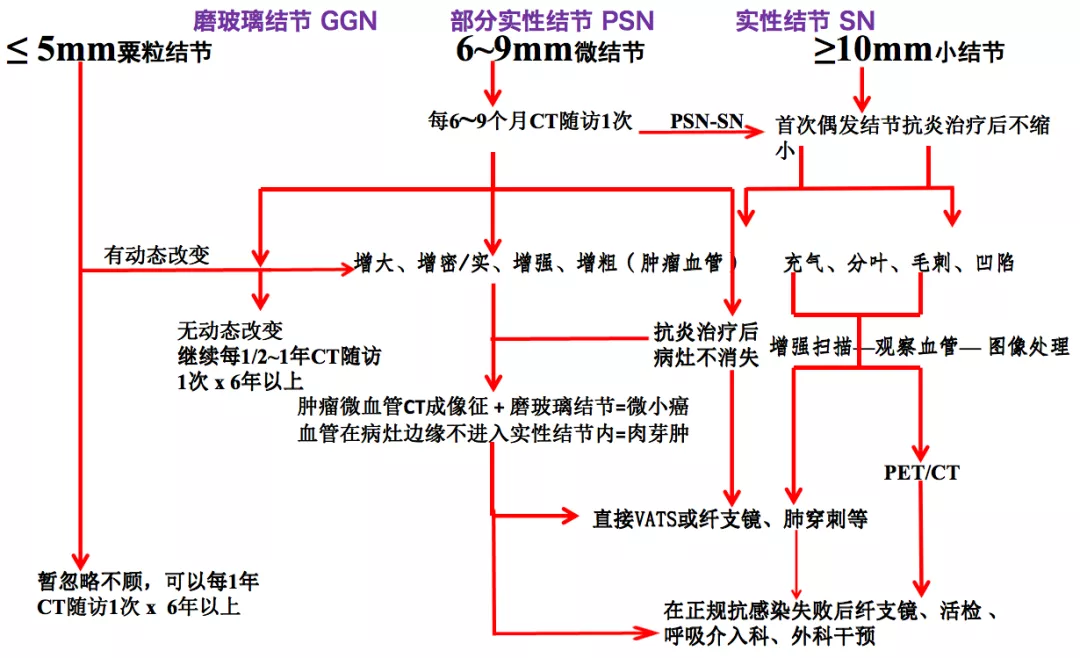
十、肺外周结节影像诊断流程与处置选择
大家只要遵循「四增」原则,在原有的、长期的、不消失的磨玻璃病灶的基础上有「四增」表现,就可以考虑为微小肺癌。
A Highly Skilled Fusion Docter
随着医学影像数字化设备不断的更新,从而使现代医学影像学也不断开拓出新的诊断模式。设备的更新也要求操作者的知识水平同步更新。技术的发展是无止境的,新技术所带来的新挑战也是永恒的,而不断地去迎接新的挑战正是我们社会进步和发展的源泉。
张国桢教授回答线上提问
Q1:对于实性结节,有更好的办法提前术前诊断吗?还是需要多种影像综合诊断?
张国桢教授:这个提问很好。刚才提到磨玻璃病灶已经比较容易进行诊断了,长期存在、不消失、有肿瘤血管征。我认为实性病灶是诊断难度最高的,大概有一半是良性。而且这些实性病灶,看似良性,实际恶性;看似恶性,实际却是良性,也就是蛇可以化妆成美女,王子又可以化妆成魔鬼,这就是我们所谓的「异病同影」和「同病异影」的概念。
我认为实性病灶如果还是按照「四增」的规律去要求,有些就不一定合适了。例如第一,对CT密度值的测量,实性病灶的密度不是增加了,可能是在下降,因为血管生长的速度比较慢,不如病灶自己生长的速度快,血管跟不上它生长的速度,就会缺血,产生坏死,所以密度不是上升反而下降,也可以说是「稳中有降」,这就要诊断恶性了。第二,不管是错构瘤还是结核、肉芽肿,良性的实性病灶不可能有血管进入、也不可能有由于小颗粒癌巢的堆聚而产生的密度不均匀。所以,这些都可以做鉴别诊断的依据。只要谨慎细心,我认为诊断不算很难。
Q2:只有肿瘤细胞会释放多种VEGF,其他的良性疾病很少。那么,肉芽肿没有血管支撑营养吗?
张国桢教授:肿瘤血管是受到VEGF分泌以后,移动进入到结节里面。肉芽肿没有血管,它怎么能够长呢?它可以靠周围血管旁行,绕着走,也可能会有很细小的血管支持它的营养,它会生长,只是长的不快。
Q3:单个肺结节切除后证实是肺癌,很焦虑,后期是否还会再长结节?概率有多高?
张国桢教授:有家族史比较可怕,但不可怕的地方就是基因传递下来以后,如果没有基因突变,不会发病。所以不要担心,只要细心随访就可以。
Q4:我们对于结节影像特征了解比较多,但对于生物学特征了解比较少,生物学特征与影像特征会不会有不一致的地方?该如何解释?
张国桢教授:这是一个热点问题。现在很多的文章都把生物学特征和影像学特征关联在一起,但是没有一个完美的结论,有的是肯定,有的是否定。我认为任何事物都是在发展中壮大的,经过未来多方向的研究,有的可以否定,有的肯定,有的可以发展,所以这些目前还处于观察发展的过程中。
Q5:肺瘢痕癌一般发展需要多少年?
张国桢教授:我们医院的资料很全,在我们医院里面瘢痕癌的生长至少需要5年,所以不要着急。我念书的时候,老师说cut and then see,直接做手术,打开后看看。现在的时代正相反,一定要see and then cut,看清楚了再打开。如果考虑是瘢痕癌,完全可以让它慢慢生长,但是也要看病人的心理状态,如果他心里很着急,整天吃不下饭、睡不着觉,综合分析后可以选择做手术。之后还要和病理科配合好,在这种瘢痕的基础上,你看到的可能还不是癌,但是要仔细观察。我经常去病理科请教病理科医生,让他们再帮忙看看,刚开始看可能是良性的,再仔细观察,也许就能发现恶性细胞了。所以病理和影像要互相结合,扬长避短。
Q6:如果结节同时具有肿瘤微血管CT成像征,而且生物学特征表现为阳性,是否可以直接手术,不需要活检?
张国桢教授:我认为可以,因为两者都存在,只要本人同意即可手术。但是要和病人说清楚,没有看到显微镜下的结果,准确的诊断率在95%以上,还有5%可能不正确,手术病理如果是良性的,不能后悔。
Q7:5mm磨玻璃结节需要做手术吗?如果有肿瘤微血管CT成像征,病理确诊情况是怎么样?
张国桢教授:刚才提到,一定要把肿瘤的早期发现、早期诊断、早期治疗作为一项非常艰巨的任务。早期的就是5mm、6mm的微小肺癌,如果有肿瘤微血管CT成像征,我是动员病人一定要做手术,因为是原位癌0期,5~10年生存率达100%。
Q8:多维度甄别用常规的薄层CT扫描可以吗?还是需要靶扫描CT才可以?对CT设备的排数要求多少排?具体扫描参数是多少?
张国桢教授:现在的CT只要是16层以上的都是高清的,为什么?纵轴、横轴、斜轴都是同一方向,不会再有偏差,专业术语叫作「各向同性」。所以我认为不一定要考虑到36排、128排、256排,只要在16层以上,在县级的医院完全可以作CT薄层重建。另外,不需要做靶扫描,现在的CT都是高清的,分辨率相当高。用靶扫描的剂量比较大,而且不一定能解决问题,还要另加收费。现在做低剂量CT很快就做完了,只有3~8张胸片的受线量,剂量很低的。
Q9:肿瘤血管与正常走行的血管怎样鉴别?
张国桢教授:肺内血管有很多,但是看三维成像会发现很多血管只是包围着结节,并没有进入结节里。只有肿瘤血细胞分泌VEGF才刺激周围的血管长芽,这个芽渐变成细小血管就移动进入结节里面,这就是肿瘤血管。
Q10:过度诊断与延误诊断是个难题,对肺结节多维度甄别的流程能使临床更加精准诊疗吗?
张国桢教授:这个问题很好。有的专家提出来,在门诊的误诊率为50%,在病房可能是30%,好像误诊是不可避免的。我认为现在这个时代是影像引导治疗(image guided procedures,IGP)的时代,现在离不开影像了。所以我希望临床医生把影像学好,影像科医生把临床学好,这样我们就可以有互补、互通的语言,我们就是融合型的医生,能够把发病率、死亡率、存活率完全改变。
Q11:随着临床上已经开始应用肺癌七种自身抗体等检测方法,肺结节患者又出现肿瘤免疫反应,抗体是阳性的,但是CT扫描无论是内部还是外部都没有表现出恶性征象,是否需要警惕?
苏春霞教授:一般来说我们需要了解患者的病史,他过去的生活习惯怎么样,比如是否吸烟、有无高危的职业接触史、有无家族史等情况。然后再看看患者的结节是在什么情况下发现的,如果是体检首次发现肺结节,自身抗体检测阳性,CT又没有体现出恶性征象,需要动态观察影像变化,不急着下定论。实际上由于现在影像技术的提升,再加上人们越来越注重健康体检,发现肺结节的人群越来越多,所以大家要把心态摆正,到一些有经验的医院进行合理的随访,进一步动态观察到底是良性还是恶性。
Q12:对于多发性GGO而言,如果5mm左右有恶性征象的肺结节都切,外科手术可以做多少次?双肺都做过手术,后期若还有剩余的GGO影像特征出现恶化,在治疗的时候该怎么选择?
张国桢教授:手术切下来的病灶是恶性的,是MIA的,可以做基因检测,如果有基因突变的话,再出现的结节可以采取靶向治疗、免疫治疗等等,会都有很多新的办法。不可能像拉链一样切了一个又切一个,永无止境地切下去。对于多发性病灶,处理还是有原则的。
Q13:可否仅仅通过影像CT来确定智能的去诊断肺癌的一些病理亚型?
张国桢教授:我认为不好。我们把影像提高到恶性或良性可能性大就可以了,一级诊断足以,不要弄到二级、三级,去代替金标准的病理,我不主张这样。
专家介绍

张国桢
主任医师、教授、曾任复旦大学附属华东医院影像科主任,现任该院肺部微小结节诊疗中心暨疑难病影像读片中心主任。中国医学影像技术研究会放射分会理事。获国务院政府特殊津贴、中央保健委员会荣誉奖、2016年中央保健先进个人、2017年上海市五一劳动奖章及上海市十佳医生及上海市仁心医者称号。发表中、英文论文90余篇并多次获上海市科学技术成果及医药卫生科研成果奖。2002年及2006年分别在美国芝加哥88届RSNA年会和圣地亚哥SPIE年会上各有一项与中国科学院技术物理研究所合作的课题获infoRAD大奖(Cum Laude)。著作有:《实用胸部CT诊断学》、《胸部CT鉴别诊断学》、《多层螺旋CT冠状动脉成像》、《心脏及冠状动脉CT成像》、《微小肺癌—影像诊断与应对策略》(中文及英文版)等多部。

苏春霞
教授,副主任医师、副教授、博导;同济大学附属上海市肺科医院肿瘤科 副主任;同济大学附属上海市肺科医院内科教研室 副主任;中国肿瘤临床学会CSCO患教专委会 副主委;中国肿瘤临床学会CSCO转化专委会 副秘书长;中国肿瘤临床学会CSCO免疫治疗专委会 常委;北京癌症防治学会呼吸道肿瘤药物不良反应管理专业委员会 副主委;上海市抗癌协会青年理事会 副理事长;上海市女医师协会肺癌专委会 副主委;泛长三角胸部肿瘤联盟专委会 秘书长;世界华人肿瘤医师协会胸部肿瘤专委会 青委;中国肿瘤临床学会CSCO非小细胞肺癌专委会 委员;上海市抗癌协会肺癌分子靶向和免疫治疗专委会 常委兼秘书长;上海医学会肿瘤分会 青委。
* 感谢杭州凯保罗生物科技有限公司大力支持
本文由《呼吸界》编辑 大奔 整理,感谢张国桢教授的审阅修改!
本文完
排版:Jerry


