迷之重症肺炎
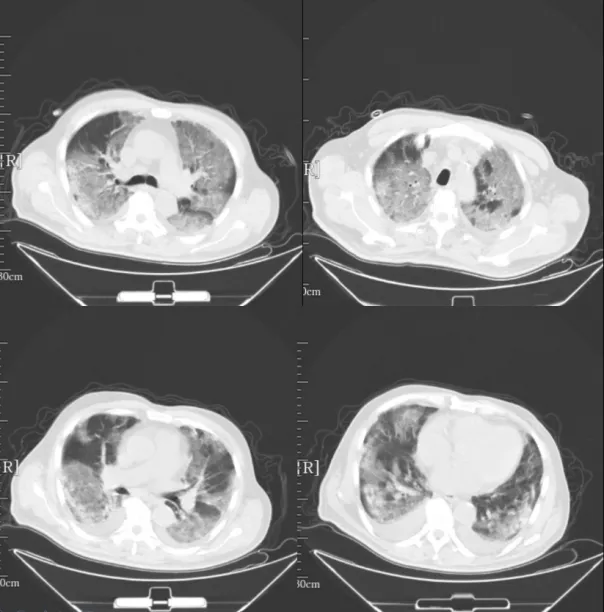

我们呼吸与危重症医学科医生在临床经常遇到的一种现象——「迷」一样的重症肺炎。比如病人的胸部CT是「白肺」,CRP很高,氧合指数非常差,对于这类病人是否使用激素通常就是我们最常争论的问题,如果这个病人同时存在淋巴细胞减低,争论可能就更加激烈。
灵魂好几问
有些医生认为病人出现了炎症风暴,应该使用激素;有些医生认为可能是机体的正常免疫反应,应该帮机体免疫一把。其中需要讨论的问题就是,是否存在炎症风暴的标志?如果存在,标志是什么?这样的病人往往同时存在淋巴细胞减低,淋巴细胞减低和炎症风暴有什么关系?它们之间有没有因果关系?谁是因,谁是果?另外,它们之间到底是不是决然对立的状态?有淋巴细胞减低是不是绝对就不能使用激素?在这种情况下,我们应该如何根据病情判断是应该增强免疫还是抑制免疫?
围绕着这些非常有意思的问题,我对炎症风暴、淋巴细胞减低症以及在疾病中两者之间的关系的相关知识和文献进行了整理。
一、炎症风暴(cytokine storm)
炎症风暴这个名称首次应用于1993年,用来描述GVHD效应。2003年开始用于描述流感病毒感染的表现,之后逐渐用于各种感染。研究最多的是脓毒症(sepsis)。今年COVID-19全球大流行,又使得炎症风暴这个名词被推到了风口浪尖。我们查询这个名称的时候发现炎症风暴也用于风湿免疫疾病,其中包括与「HLH」(噬血淋巴细胞组织增生症)和「MAS」(巨噬细胞活化综合征)紧密联系的使用。另外,肿瘤病人应用CAR-T细胞治疗时出现的细胞因子释放综合征(Cytokine Release Syndrome,CRS),和炎症风暴应该也是一个意思。
炎症风暴并没有明确的定义。出现炎症风暴的时候,同时出现的非常高频的词汇就是自放大效应,也就是不受控制地释放炎症因子,导致过量生产,所以它一定是全身性炎症,往往与ARDS、DIC、多器官功能衰竭相关,经常会导致病人死亡。有关炎症风暴的标志是什么,现在大家约定俗成的认为炎症风暴的标志就是看病人的状态,他有没有出现ARDS、DIC、多器官功能衰竭或障碍,如果出现了这些比较严重的问题,就认为这个炎症状态到达了炎症风暴的程度。
感染相关的炎症风暴
机体正常的抗感染免疫反应
炎症风暴主要是由哪些细胞产生的?炎症风暴就是炎症因子释放过多,炎症因子就是机体免疫系统所产生的一种过强的免疫反应。我们知道机体正常的免疫反应分为固有免疫和适应性免疫,那么炎症风暴的这些炎症因子到底是在天然免疫阶段由固有免疫细胞产生,还是适应性免疫阶段由淋巴细胞产生的?它主要出现在哪个阶段?又包含哪些细胞因子种类,以及所产生的细胞因子的相关功能是什么?
- 主要产生的细胞
炎症风暴的主要产生的免疫细胞在血细胞当中,主要是单核巨噬细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、自然杀伤(NKs)和树突状细胞(DCs),这里面并没有淋巴细胞,所以主要产生(炎症风暴)的是天然免疫细胞。
同时近些年的一些研究也把关注的焦点放在内皮细胞上,认为内皮细胞在感染中的角色,不仅是受到迫害的受害者,也是炎症的传递和放大者。而内皮细胞也是很关键的一个天然免疫细胞。
- 出现的阶段
目前认为炎症风暴主要与天然免疫反应失控关系比较密切,在天然免疫这个阶段就开始失控了,产生炎症因子风暴。
- 包含的细胞因子种类及功能
主要包含的细胞因子有白细胞介素、趋化因子、干扰素、肿瘤坏死因子、集落刺激因子等,当然不局限于这些细胞因子。
我们研究最多的就是白细胞介素,人为的把它分成前炎症因子和抗炎症因子,也就是促炎因子和抑炎因子。促炎因子的主要功能包括激活补体、激活粘附分子、促进趋化因子的合成、促进分泌促凝血因子、导致内皮细胞失功能使血管通透性增加、诱导凋亡。抗炎症因子也是可以诱导凋亡的。实际上这些炎症因子的功能本来是想要帮助机体去清除这些病原体,但如果是过量生产的状态,它就会对机体造成损伤,这就是炎症风暴。
除了白细胞介素之外,趋化因子对炎症的放大起到了关键作用,因为它主要的功能就是招募并活化更多的免疫细胞参与到炎症中来。干扰素分成I型(IFN-α/β),II型(IFN-γ),III型(IFN-λ),具体功能会在后面的内容提到,这也是非常关键的一个细胞因子。从发现肿瘤坏死因子到现在,一直认为它是一个非常重要的促炎因子。对集落刺激因子来讲,与感染相关的主要认为是和造血靶向克隆刺激因子。因此,炎症风暴中包含的炎症因子的异质性很强,炎症风暴的作用也是多因素的,包含病理性和保护性免疫。
二、淋巴细胞减低症(lymphopenia)
淋巴细胞减低症的定义很简单,当成人淋巴细胞总数<1000/μl,儿童(2岁以下)<3000/μl,我们就认为这个人有淋巴细胞减低。大多淋巴细胞减少症患者T细胞绝对数减少,特别是CD4细胞数减少,约65%外周血T细胞为CD4+T细胞。现在很多家医院可以检测淋巴细胞亚群,能进一步了解是CD4细胞数减少的更多,还是CD8细胞数减少的更多。
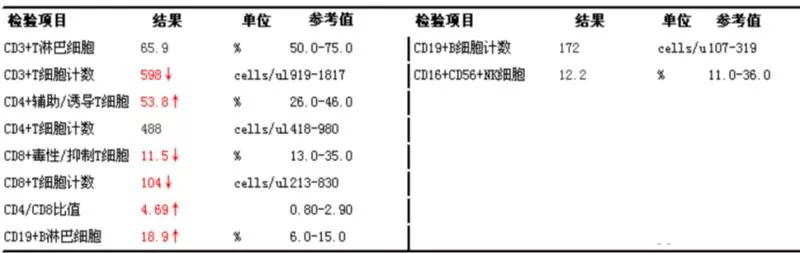
淋巴细胞减低的原因非常多,与先天性因素、医源性因素、感染、炎症、肿瘤等有关。感染只是其中之一,我们今天主要是聚焦在感染上。
机体正常的抗感染免疫
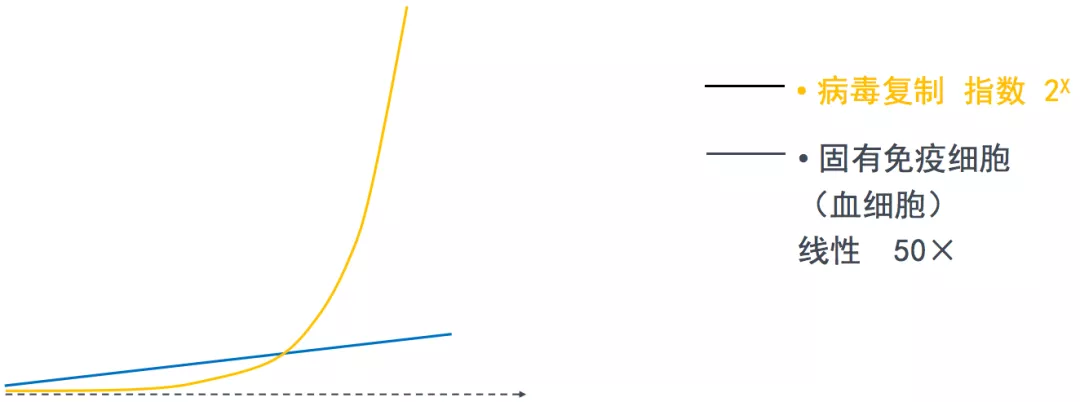
在机体正常的抗感染免疫中,淋巴细胞是如何表现的?淋巴细胞会减低吗?我们以病毒感染为例来看一下。上图所示,这条黄色的曲线是病毒复制的曲线,开始的时候增长比较缓慢,后期迅速增长,这是一个典型的指数增长的曲线。而固有免疫细胞在受到病毒入侵后,首先发生活化,它也会发生增殖,是线性增长的关系,有人研究过它是以50倍扩增的方式。很显然这种扩增方式到后期赶不上病毒复制的速度,如果想要机体彻底清除病毒,单靠固有免疫恐怕不行。
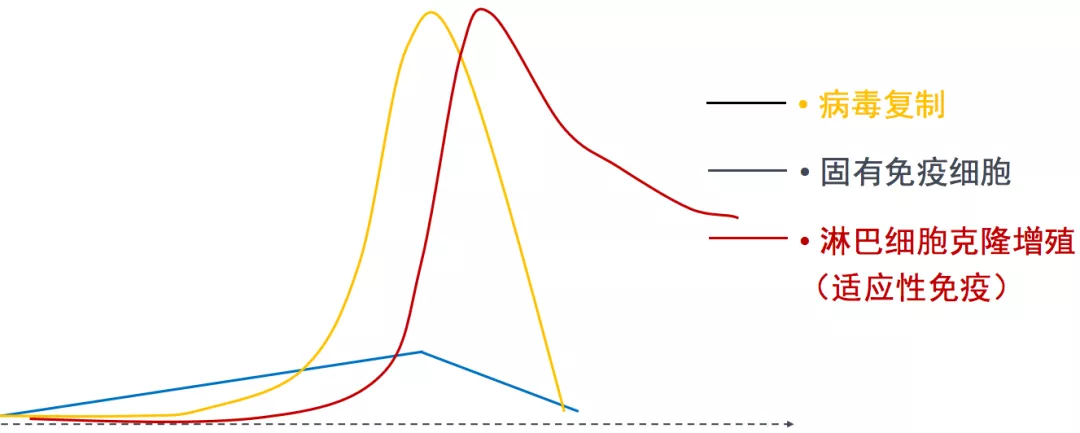
起到关键作用的是适应性免疫,淋巴细胞出现克隆性增殖,它是完全针对入侵的病毒发生的克隆性增殖,也呈指数增长,最终会把病毒清除掉。
感染引起淋巴细胞减低的原因
由此可见,机体正常的抗感染免疫中,淋巴细胞会像病毒复制一样出现指数增长。正常情况下,淋巴细胞应该增多,不应该减少。如果发生了淋巴细胞减低,我们首先猜测的一个原因就是病原体是不是把淋巴细胞杀死了?这种猜测在很多感染中能够得到证实,确实有很多病原体可以直接杀伤淋巴细胞。
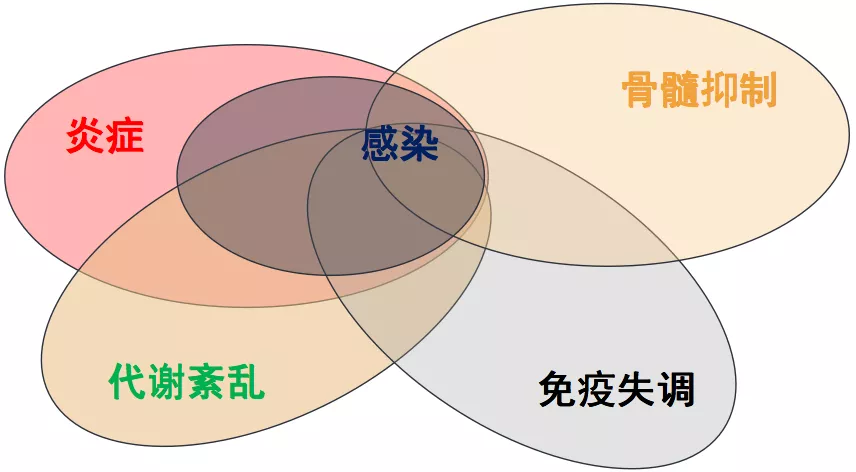
但是,通过查找文献或者大家提到的更多的关键词是凋亡。很多因素可以诱导淋巴细胞的凋亡,抑制淋巴细胞的增殖。多因素都包括哪些因素呢?我们知道感染可以诱发炎症,也可以引起代谢紊乱,淋巴细胞克隆性增殖需要糖代谢、脂肪代谢的这些调节,所以代谢紊乱、免疫失调、骨髓抑制都可以造成淋巴细胞凋亡和抑制淋巴细胞增殖。在这些因素中,炎症仍然是最重要的因素。这就是今天为什么把炎症风暴和淋巴细胞减低放在一起讨论,因为炎症因子可以引起淋巴细胞凋亡、抑制淋巴细胞增殖,引起淋巴细胞数目减少,那么炎症风暴就更可以引起淋巴细胞数目减少。
因此,我们现在知道炎症风暴是天然免疫失控的表现,主要产生的细胞是天然免疫细胞,不是适应性免疫细胞。并且炎症风暴一旦出现,它可以抑制适应性免疫的淋巴细胞增殖,促进淋巴细胞凋亡,也就是说炎症可以导致淋巴细胞减低。
三、在疾病中看两者的关系
出现了淋巴细胞减低症就意味着一定出现了炎症风暴吗?我们就无法控制炎症风暴了吗?下面我们从不同的疾病上来看两者的关系有哪些不同。我选择了两种比较具有代表性的疾病,一个是脓毒症,是细菌性感染的代表。当然脓毒症也可以由病毒感染引起,但是现在大多数有关脓毒症的研究,包括动物模型,都是细菌感染引起的脓毒症。另一个,病毒性感染方面我将讨论现在大家最关注的SARS-Cov-2。
1、脓毒症(Sepsis)
我们看脓毒症的概念:Sepsis is a severe clinical syndrome related to the host response to infection.
脓毒症是一种严重的临床综合征,与宿主对抗感染的反应有关。
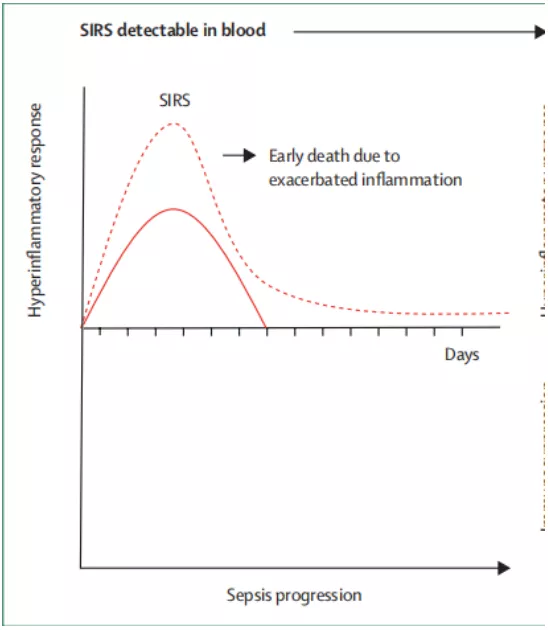
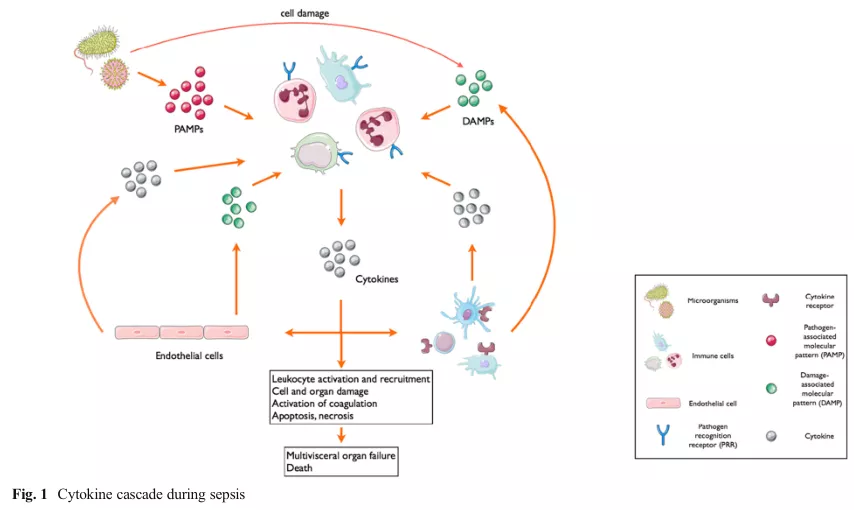
宿主对抗感染的反应,首先是天然免疫活化,就是感染激活天然免疫,引发炎症,细胞因子大量释放,引起炎症风暴。所以在脓毒症的早期阶段就有第一波的死亡高峰,其实这一波病人可能存在炎症风暴。

紧接着机体为了维持免疫平衡,不想让炎症因子持续扩大,会启动CARS限制炎症反应,这个过程表现为免疫抑制,并可诱发二次感染。这是脓毒症病人死亡的第二个高峰,往往死于免疫抑制。
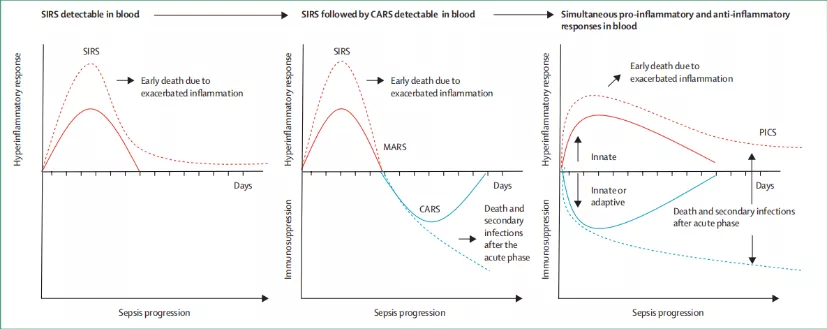
研究证实,多数患者炎症反应和抗炎反应同时出现,可表现为持续放大的炎症反应与持续存在的免疫抑制。那么持续亢进的免疫反应,就是我们所说的炎症风暴,炎症因子持续释放,促炎因子持续增加,相对应的,这种抗炎反应是不是就是抗炎症因子的增多?这只是其中一点,实际上这种免疫抑制更多的是免疫细胞的凋亡以及免疫细胞的失功能。
脓毒症过程中在细胞学上的表现
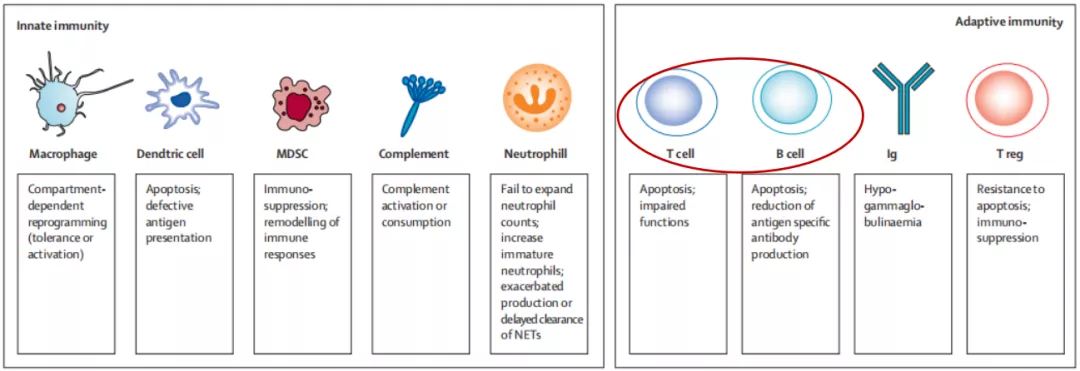
首先看天然免疫细胞,巨噬细胞可能出现异常的活化或者免疫耐受,树突状细胞表现为抗原提呈的缺陷甚至凋亡,骨髓源性的抑制性细胞开始活化,补体被激活,中性粒细胞表现为异常活化并抵抗凋亡,不成熟的中性粒细胞增多。而适应性免疫中的淋巴细胞,除了调节性T细胞之外的所有淋巴细胞都发生凋亡。这也是脓毒症患者出现免疫抑制的重要组成部分,当然,免疫抑制还包括淋巴细胞及其他免疫细胞的功能下降甚至失功能。
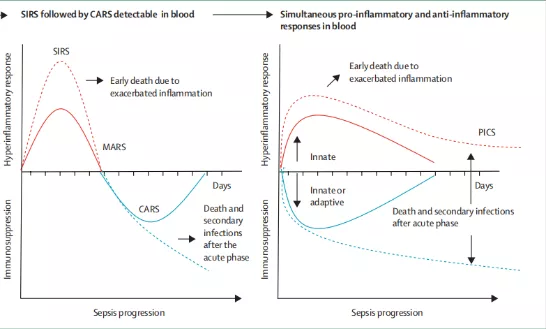
一旦脓毒症患者出现淋巴细胞减低,就是这个患者有免疫抑制的表现,说明患者曾经出现过免疫亢进或者还正在经历免疫亢进,就是说炎症风暴可能已经过去了,也可能现在依旧存在。但是免疫抑制可能是更值得关注的问题,不仅表现为淋巴细胞的凋亡,还会表现为淋巴细胞的失功能。这也许能够解释为什么到目前为止,所有针对Sepsis炎症风暴的免疫抑制治疗,不管是糖皮质激素广泛抑制还是靶向抑制,都没有确切有效的结果。相反,现在对脓毒症免疫抑制治疗的研究的越来越多。
2、病毒性肺炎:SARS-Cov-2

我们再来看看病毒性肺炎SARS-Cov-2和脓毒症有哪些异同点。SARS-Cov-2感染之后,病人可以出现炎症风暴,这种现象最早在曹彬教授发布于2019年12月底的文章中就提到,不管是促炎因子、抗炎因子、肿瘤坏死因子、趋化因子都有,所以COVID-19病人是存在炎症风暴的。

后续的很多研究也佐证了炎症风暴的存在,并且发现随着炎症因子的增加,病人的临床表现越来越严重,淋巴细胞数目越来越少。所以这种现象和部分脓毒症患者相似,它的免疫亢进和免疫抑制是同时存在的。
SARS-Cov-2和脓毒症有哪些不同?
最大的区别就是多数病人早期即出现淋巴细胞减少,此时病人的临床症状很轻,没有出现ARDS、DIC、多器官功能衰竭。最近的研究数据表明,早期淋巴细胞减少的原因可能是SARS-CoV-2能通过受体依赖方式直接感染T细胞,虽然感染后病毒不能在细胞内复制,但可以导致细胞死亡;另外,病毒成分以及炎症因子可诱导淋巴细胞凋亡。
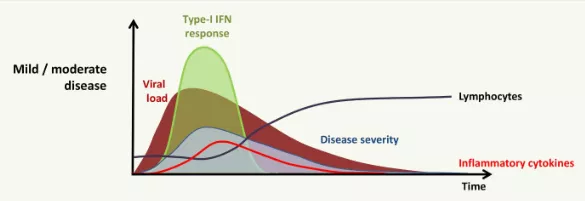
但早期的炎症反应是天然免疫活化后产生的正常免疫反应,往往不是「炎症风暴」。因为这个时候病人的临床症状不严重,不存在我们现在认为的这些炎症风暴的标志,所以这只是机体的正常免疫反应。在这种情况下如果出现淋巴细胞减低,我们不能认为出现了炎症风暴,不建议使用激素。
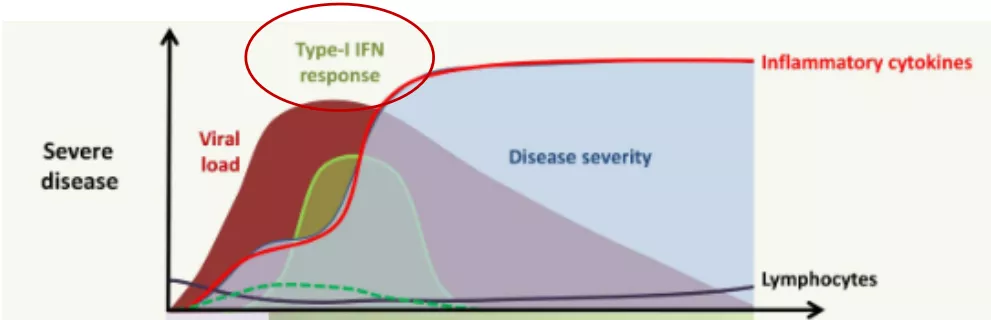
如果淋巴细胞持续减少则提示易转为重症。这个过程中非常关键的一个细胞因子就是干扰素,干扰素是天然免疫中非常重要的成分,它是直接抑制病毒复制的细胞因子。病毒又可以通过很多机制导致干扰素释放延迟,这种现象在流感的时候就已经被发现了,在SARS-Cov-2病人身上也被发现。干扰素释放延迟,导致病毒在早期得不到有效地控制,或者说病毒初始的载量特别大,使得这个病毒得不到有效清除,就会使天然免疫细胞持续释放大量细胞因子,即为「炎症风暴」。这种炎症风暴可以抑制淋巴细胞增殖,促进淋巴细胞凋亡。
重症病毒性肺炎时,「炎症风暴」更值得关注。淋巴细胞持续减少可能与「炎症风暴」持续存在有关。所以这也许能解释为什么部分病例在淋巴细胞很低的情况下使用糖皮质激素或靶向免疫抑制治疗均取得较好效果,尤其是现在有些靶向治疗的研究都得到了比较好的效果。
小结与思索
1、炎症风暴可以导致淋巴细胞减低。
2、出现淋巴细胞减低不一定同时存在炎症风暴。
3、个体化识别免疫状态对把握治疗措施至关重要。
参考文献
[1] CAVAILLON J M. Exotoxins and endotoxins: Inducers of inflammatory cytokines [J]. Toxicon, 2018, 149(45-53.
[2] CHOUSTERMAN B G, SWIRSKI F K, WEBER G F. Cytokine storm and sepsis disease pathogenesis [J]. Semin Immunopathol, 2017, 39(5): 517-28.
[3] 龚非力. 医学免疫学 [M]. 北京: 科学出版社, 2014.
[4] OVIEDO-BOYSO J, BRAVO-PATINO A, BAIZABAL-AGUIRRE V M. Collaborative action of Toll-like and NOD-like receptors as modulators of the inflammatory response to pathogenic bacteria [J]. Mediators Inflamm, 2014, 2014(432785.
[5] MAGRONE T, JIRILLO E. Sepsis: From Historical Aspects to Novel Vistas. Pathogenic and Therapeutic Considerations [J]. Endocrine, metabolic & immune disorders drug targets, 2019, 19(4): 490-502.
[6] VAN DER POLL T, VAN DE VEERDONK F L, SCICLUNA B P, et al. The immunopathology of sepsis and potential therapeutic targets [J]. Nat Rev Immunol, 2017, 17(7): 407-20.
[7] TANAKA T, NARAZAKI M, KISHIMOTO T. Immunotherapeutic implications of IL-6 blockade for cytokine storm [J]. Immunotherapy, 2016, 8(8): 959-70.
[8] JONES S A, SCHELLER J, ROSE-JOHN S. Therapeutic strategies for the clinical blockade of IL-6/gp130 signaling [J]. J Clin Invest, 2011, 121(9): 3375-83.
[9] WEBER A, WASILIEW P, KRACHT M. Interleukin-1 (IL-1) pathway [J]. Science signaling, 2010, 3(105): cm1.
[10] GUO X J, THOMAS P G. New fronts emerge in the influenza cytokine storm [J]. Semin Immunopathol, 2017, 39(5): 541-50.
[11] ONG E Z, CHAN Y F Z, LEONG W Y, et al. A Dynamic Immune Response Shapes COVID-19 Progression [J]. Cell Host Microbe, 2020, 27(6): 879-82.e2.
[12] WU D, YANG X O. TH17 responses in cytokine storm of COVID-19: An emerging target of JAK2 inhibitor Fedratinib [J]. J Microbiol Immunol Infect, 2020, 53(3): 368-70.
[13] CARRIERE V, ROUSSEL L, ORTEGA N, et al. IL-33, the IL-1-like cytokine ligand for ST2 receptor, is a chromatin-associated nuclear factor in vivo [J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(1): 282-7.
[14] COUPER K N, BLOUNT D G, RILEY E M. IL-10: the master regulator of immunity to infection [J]. J Immunol, 2008, 180(9): 5771-7.
[15] HOTCHKISS R S, MONNERET G, PAYEN D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy [J]. Nat Rev Immunol, 2013, 13(12): 862-74.
[16] GUPTA S, BI R, KIM C, et al. Role of NF-kappaB signaling pathway in increased tumor necrosis factor-alpha-induced apoptosis of lymphocytes in aged humans [J]. Cell Death Differ, 2005, 12(2): 177-83.
[17] HUANG C, WANG Y, LI X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China [J]. Lancet, 2020, 395(10223): 497-506.
[18] CHEN G, WU D, GUO W, et al. Clinical and immunological features of severe and moderate coronavirus disease 2019 [J]. J Clin Invest, 2020, 130(5): 2620-9.
[19] LI Y, HU Y, YU J, et al. Retrospective analysis of laboratory testing in 54 patients with severe- or critical-type 2019 novel coronavirus pneumonia [J]. Lab Invest, 2020, 100(6): 794-800.
[20] SZRETTER K J, GANGAPPA S, LU X, et al. Role of host cytokine responses in the pathogenesis of avian H5N1 influenza viruses in mice [J]. J Virol, 2007, 81(6): 2736-44.
[21] ROMERO C R, HERZIG D S, ETOGO A, et al. The role of interferon-γ in the pathogenesis of acute intra-abdominal sepsis [J]. J Leukoc Biol, 2010, 88(4): 725-35.
[22] CROUSE J, KALINKE U, OXENIUS A. Regulation of antiviral T cell responses by type I interferons [J]. Nat Rev Immunol, 2015, 15(4): 231-42.
[23] CHOUSTERMAN B G, BOISSONNAS A, POUPEL L, et al. Ly6Chigh Monocytes Protect against Kidney Damage during Sepsis via a CX3CR1-Dependent Adhesion Mechanism [J]. Journal of the American Society of Nephrology : JASN, 2016, 27(3): 792-803.
[24] ROBBEN P M, LAREGINA M, KUZIEL W A, et al. Recruitment of Gr-1+ monocytes is essential for control of acute toxoplasmosis [J]. J Exp Med, 2005, 201(11): 1761-9.
[25] DOI:10.1038/NRI2356 H J C-S F I I A A N R I.
[26] YANG Y S C, LI J, YUAN J, YANG M, WANG F, ET AL. EXUBERANT ELEVATION OF IP-10, MCP-3 AND IL-1RA DURING SARS-COV-2 INFECTION IS ASSOCIATED WITH DISEASE SEVERITY AND FATAL OUTCOME. MEDRXIV 2020;2020(3). HTTPS://DOI.ORG/10.1101/2020.03.02.20029975. 02.20029975.
[27] HUANG C W Y, LI X, REN L, ZHAO J, HU Y, ET AL. CLINICAL FEATURES OF PATIENTS INFECTED WITH 2019 NOVEL CORONAVIRUS IN WUHAN, CHINA. LANCET LOND ENGL 2020;395:497–506. HTTPS://DOI.ORG/10.1016/S0140-6736(20)30183-5.
[28] ZHOU Z R L, ZHANG L, ET AL. OVERLY EXUBERANT INNATE IMMUNE RESPONSE TO SARS-COV-2 INFECTION. AVAILABLE AT SSRN: HTTPS://SSRN.COM/ABSTRACT=3551623 OR HTTP://DX.DOI.ORG/10.2139/SSRN.3551623.
[29] YAO X H, LI T Y, HE Z C, et al. [A pathological report of three COVID-19 cases by minimal invasive autopsies] [J]. Zhonghua bing li xue za zhi = Chinese journal of pathology, 2020, 49(5): 411-7.
[30] WIERSINGA W J, RHODES A, CHENG A C, et al. Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (COVID-19): A Review [J]. Jama, 2020,
[31] KARAKIKE E, GIAMARELLOS-BOURBOULIS E J. Macrophage Activation-Like Syndrome: A Distinct Entity Leading to Early Death in Sepsis [J]. Front Immunol, 2019, 10(55.
[32] GIAMARELLOS-BOURBOULIS E J, NETEA M G, ROVINA N, et al. Complex Immune Dysregulation in COVID-19 Patients with Severe Respiratory Failure [J]. Cell Host Microbe, 2020, 27(6): 992-1000.e3.
[33] HAHN E O, HOUSER H B, RAMMELKAMP C H, JR., et al. Effect of cortisone on acute streptococcal infections and poststreptococcal complications [J]. J Clin Invest, 1951, 30(3): 274-81.
[34] SPRUNG C L, ANNANE D, KEH D, et al. Hydrocortisone therapy for patients with septic shock [J]. The New England journal of medicine, 2008, 358(2): 111-24.
[35] ABRAHAM E, WUNDERINK R, SILVERMAN H, et al. Efficacy and safety of monoclonal antibody to human tumor necrosis factor alpha in patients with sepsis syndrome. A randomized, controlled, double-blind, multicenter clinical trial. TNF-alpha MAb Sepsis Study Group [J]. Jama, 1995, 273(12): 934-41.
[36] CLARK M A, PLANK L D, CONNOLLY A B, et al. Effect of a chimeric antibody to tumor necrosis factor-alpha on cytokine and physiologic responses in patients with severe sepsis--a randomized, clinical trial [J]. Critical care medicine, 1998, 26(10): 1650-9.
[37] FISHER C J, JR., DHAINAUT J F, OPAL S M, et al. Recombinant human interleukin 1 receptor antagonist in the treatment of patients with sepsis syndrome. Results from a randomized, double-blind, placebo-controlled trial. Phase III rhIL-1ra Sepsis Syndrome Study Group [J]. Jama, 1994, 271(23): 1836-43.
[38] BEHRENS E M, KORETZKY G A. Review: Cytokine Storm Syndrome: Looking Toward the Precision Medicine Era [J]. Arthritis Rheumatol, 2017, 69(6): 1135-43.
[39] ARABI Y M, SHALHOUB S, MANDOURAH Y, et al. Ribavirin and Interferon Therapy for Critically Ill Patients With Middle East Respiratory Syndrome: A Multicenter Observational Study [J]. Clin Infect Dis, 2020, 70(9): 1837-44.
[40] OMRANI A S, SAAD M M, BAIG K, et al. Ribavirin and interferon alfa-2a for severe Middle East respiratory syndrome coronavirus infection: a retrospective cohort study [J]. Lancet Infect Dis, 2014, 14(11): 1090-5.
[41] ZUMLA A, CHAN J F, AZHAR E I, et al. Coronaviruses - drug discovery and therapeutic options [J]. Nat Rev Drug Discov, 2016, 15(5): 327-47.
[42] CHEN N, ZHOU M, DONG X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study [J]. Lancet, 2020, 395(10223): 507-13.
[43] XU X, HAN M, LI T, et al. Effective treatment of severe COVID-19 patients with tocilizumab [J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(20): 10970-5.
[44] GAO J, TIAN Z, YANG X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies [J]. Bioscience trends, 2020, 14(1): 72-3.
[45] 广东省科技厅及广东省卫生健康委磷酸氯喹治疗新冠状病毒肺炎多中心协作组. 磷酸氯喹治疗新型冠状病毒肺炎的专家共识 [J/OL] . 中华结核和呼吸杂志, 43 (2020-02-20).HTTP://RS.YIIGLE.COM/YUFABIAO/1182323.HTM. DOI: 10.3760/CMA.J.ISSN.1001-0939.2020.0019.[网络预发表].
[46] WANG H, LIU B, TANG Y, et al. Improvement of Sepsis Prognosis by Ulinastatin: A Systematic Review and Meta-Analysis of Randomized Controlled Trials [J]. Frontiers in pharmacology, 2019, 10(1370.
[47] JU M, HE H, CHEN S, et al. Ulinastatin ameliorates LPS‑induced pulmonary inflammation and injury by blocking the MAPK/NF‑κB signaling pathways in rats [J]. Molecular medicine reports, 2019, 20(4): 3347-54.
[48] UCCELLI A, DE ROSBO N K. The immunomodulatory function of mesenchymal stem cells: mode of action and pathways [J]. Ann N Y Acad Sci, 2015, 1351(114-26.
[49] BEN-MORDECHAI T, PALEVSKI D, GLUCKSAM-GALNOY Y, et al. Targeting macrophage subsets for infarct repair [J]. Journal of cardiovascular pharmacology and therapeutics, 2015, 20(1): 36-51.
[50] LEE J W, FANG X, KRASNODEMBSKAYA A, et al. Concise review: Mesenchymal stem cells for acute lung injury: role of paracrine soluble factors [J]. Stem Cells, 2011, 29(6): 913-9.
[51] 徐凯进 蔡, 沈毅弘, 等. 2019冠状病毒病(COVID-19)诊疗浙江经验[J]. 浙江大学学报(医学版), 2020.
[52] ZUCCARI S, DAMIANI E, DOMIZI R, et al. Changes in Cytokines, Haemodynamics and Microcirculation in Patients with Sepsis/Septic Shock Undergoing Continuous Renal Replacement Therapy and Blood Purification with CytoSorb [J]. Blood purification, 2020, 49(1-2): 107-13.
[53] SHIMABUKURO-VORNHAGEN A, G DEL P, SUBKLEWE M, et al. Cytokine release syndrome [J]. Journal for immunotherapy of cancer, 2018, 6(1): 56.
[54] SHAKOORY B, CARCILLO J A, CHATHAM W W, et al. Interleukin-1 Receptor Blockade Is Associated With Reduced Mortality in Sepsis Patients With Features of Macrophage Activation Syndrome: Reanalysis of a Prior Phase III Trial [J]. Critical care medicine, 2016, 44(2): 275-81.
[55] LAGUNAS-RANGEL F A, CH VEZ-VALENCIA V. High IL-6/IFN-γ ratio could be associated with severe disease in COVID-19 patients [J]. J Med Virol, 2020,
[56] CHANNAPPANAVAR R, FEHR A R, VIJAY R, et al. Dysregulated Type I Interferon and Inflammatory Monocyte-Macrophage Responses Cause Lethal Pneumonia in SARS-CoV-Infected Mice [J]. Cell Host Microbe, 2016, 19(2): 181-93.
[57] MCDERMOTT J E, MITCHELL H D, GRALINSKI L E, et al. The effect of inhibition of PP1 and TNFα signaling on pathogenesis of SARS coronavirus [J]. BMC systems biology, 2016, 10(1): 93.
专家介绍

李丹
吉林大学第一医院呼吸与危重症医学科,医学博士,主任医师,教授;中国医师协会呼吸医师分会危重症医学工作委员会委员;中国医师协会康复分会呼吸康复委员会委员。
本文由《呼吸界》编辑 大奔 整理,感谢李丹教授的审阅修改!
本文完
排版:Jerry


