引言
肺纤维化合并肺气肿(CPFE)并不少见,既往研究发现,在肺纤维化患者中,合并肺气肿的患病率为19-51%。男患李某是一位62岁的退休职工。常规胸部CT检查发现双下肺阴影,影像学未报恶性肿瘤,未予重视。后在没有明显诱因的前提下,他出现「阵发性咳嗽(无痰)、夜间明显、伴活动后气短」的现象于当地医院就诊并行经皮肺穿刺后虽被诊断为恶性肿瘤,但患者拒绝进一步治疗。因咳嗽、气短症状进行性加重,接下来的半年内,患者又反复7次于我院住院治疗,诊断双原发肺癌,进展迅速,最终不治……通过本案例的分享,我们应在临床中重视 CPFE合并肺癌的患者,应考虑多原发可能,后期出现进行性加重的咳嗽、气短症状,预示着局部病灶的进展迅速,预后不佳。
追溯去年病人的情况其实早已现出端倪……鉴于部分肿瘤影像学上存在过度强化的现象,我们建议行经皮肺穿刺活检以明确病变性质
患者最早因「咳嗽、气短」于西安市中心医院就诊,胸部CT显示其「右肺下叶厚壁空洞,左肺下叶高密度影,双肺间质纤维化;双肺肺气肿、左肺下叶肺大疱;纵隔及肺门淋巴结大;双侧肾上腺结节」。行CT引导下右下肺穿,病理提示小细胞癌。诊断肺恶性肿瘤(SCLC),予以对症治疗,但患者拒绝针对肿瘤进一步治疗。出院后,患者「咳嗽、气短」症状又较前有明显加重,后以「确诊肺恶性肿瘤1月余,拟进一步治疗」之主诉于今年2月19日来到我院门诊就诊,5天后被收住院治疗。
然而,早在去年8月27日,患者就曾因「2型糖尿病」在我院内分泌科住院,当时胸部CT就已发现有肺部阴影,但未进一步诊治。值得注意的是,该患者有吸烟史40余年,平均2包/日,发现肺部阴影后戒烟。其他无特殊。入院查体情况为: 右下肺呼吸音减低,左下肺可闻及散在细小湿啰音,余查体未见明显异常。
以下为患者去年8月27日在我院辅助检查情况:
胸部CT:双肺下叶高密度影;双肺肺气肿合并肺大疱;双肺间质性改变。
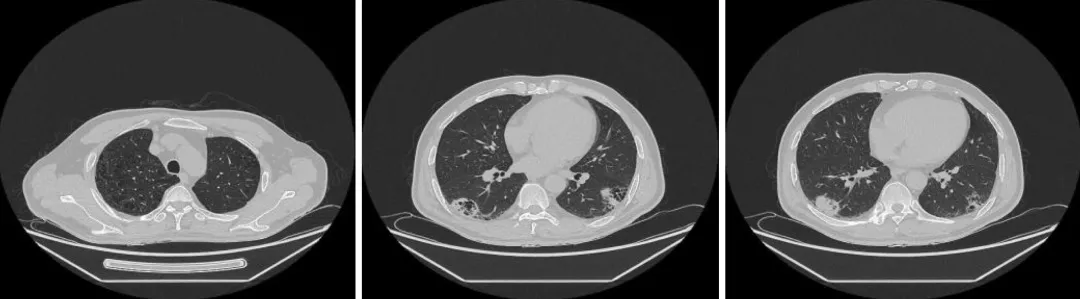
去年9月4日,胸部增强CT显示:双肺下叶高密度,部分实变病灶呈中度、持续性强化,结合临床除外特殊类型感染;双肺肺气肿合并肺大疱;双肺间质性改变。
我科当时对患者进行了会诊,考虑肿瘤不能完全除外。鉴于部分肿瘤影像学上存在过度强化的现象,建议行经皮肺穿刺活检以明确病变性质,但患者拒绝并出院。
今年1月14日,患者又因出现「咳嗽、气短」症状就诊于西安市中心医院,查胸部CT示:右下叶肺炎伴空洞形成,双肺间质性炎症;双肺肺气肿、左下肺大泡,右侧胸膜增厚;心包膜局部稍厚,动脉粥样硬化;纵隔及肺门淋巴结大,部分合并钙化;双侧肾上腺结节,建议CT增强扫描。1月16日,患者行右下肺CT引导下经皮肺穿刺,活检提示小细胞肺癌。诊断明确后,未进一步治疗,患者再次出院。
患者再次因咳嗽、气短症状加重就诊,发现病灶较前又有明显进展,终于入院治疗……全面检查和评估
最终,患者于2月19日因咳嗽、气短症状加重就诊于我科门诊。
查胸部CT显示:右肺下叶厚壁空洞,肿瘤性病变待排;左肺下叶高密度,考虑炎性病变可能;双肺肺气肿并肺大泡;双肺间质性改变;肺门及纵隔淋巴结肿大;右侧胸腔积液。病灶较前明显进展,安排入院。
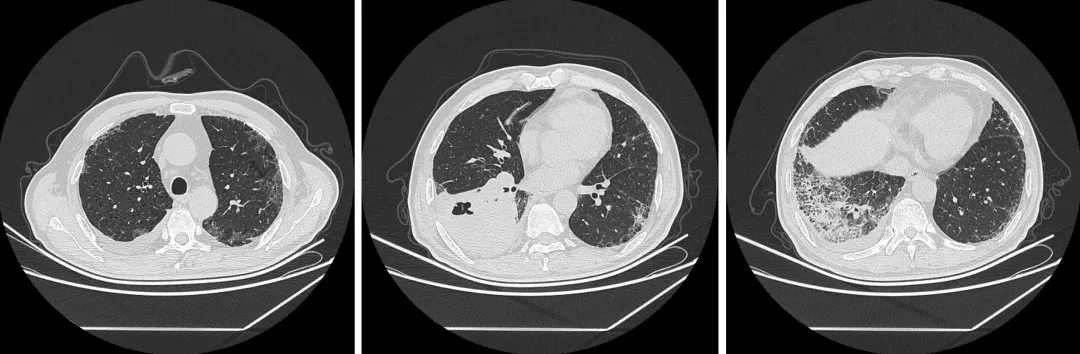
自发病以来,患者的神志清晰,精神尚可,饮食及休息均正常,二便也未见明显异常,但体重减轻了约10公斤。我们分析患者的既往病史,罹患2型糖尿病9年,有2型糖尿病性周围血管病变和2型糖尿病性周围神经病,一直在口服「二甲双胍缓释片、格列美脲片」,并皮下注射「甘精胰岛素」等治疗,血糖控制一般。
入院诊断
1、肺恶性肿瘤(右下肺小细胞癌);2、右侧胸腔积液;3、左下肺阴影;4、肺纤维化合并肺气肿(CPFE);5、2型糖尿病
入院后积极完善各项相关检查:
一般化验: 心电图、尿粪常规和肝肾功、BNP、肌钙蛋白等未见明显异常,凝血系列示纤维蛋白原 533mg/dL,D-二聚体 1300ug/L,纤维蛋白(原)降解产物4.14mg/L,糖化7.4%。
感染性指标: 血常规、PCT、内毒素、G试验、GM试验、呼吸道病原学相关检查均正常,血沉47mm/h。
结核相关检查: 结核杆菌抗体、结核杆菌DNA、T-spot、PPD试验等均阴性。
肿瘤标记物: CEA 8.94ng/ml、NSE 9.92ng/ml、非小细胞肺癌相关抗原 3.78ng/ml、CA125 141.7 U/ml、胃泌素释放肽前体 32pg/ml。
活检及病理: 西安市中心医院CT引导下右下肺占位穿刺活检: 病理(2020-01-16,西安市中心医院&交大一附院):小细胞癌。
我院支气管镜检查并左下叶外基底支TBLB: 病理(2020-03-04,西安交大二附院):肺组织慢性炎。
右侧胸腔穿刺置管: 胸水(右侧)细胞蜡块(2020-03-10,西安交大二附院):查见肿瘤细胞,结合免疫组化,提示神经内分泌肿瘤。
我院B超引导下左下肺占位穿刺活检: 病理(2020-03-10,西安交大二附院):浸润性腺癌。
免疫染色: CT引导下肺穿刺活检病理(西安市中心医院 2020-01-16):小细胞癌。免疫组化:Syn(-),CgA点灶(+),P63(-),P40(-),TTF-1(-),LCA(-),CK7(-),NapsinA(-),Ki67阳性率约80%。
右侧胸水细胞蜡块(西交大二附院 2020-03-10):查见肿瘤细胞,结合免疫染色,提示神经内分泌肿瘤。免疫组化:CK(-)、Vim(-)、Syn(+)、CD56(+)、CgA(-)、TTF-1(-)、NapsinA(-)、LCA(-)、CR(-)、CD68(-)、P16(-)、P53(+)70%、Ki-67(+)40%。
B超引导下「左肺」穿刺组织病理(西交大二附院 2020-03-10):浸润性腺癌。免疫组化:TTF-1(+)、NapsinA(+)、P53(+)、P63(-)、Ki67(+)5%、PD-L1(SP263)检测:TPS<1%。
基因检测结果提示驱动基因阴性。
我们对其进行了全身评估:肾上腺增强CT(西安交大二附院 2020.03.02):双侧肾上腺结节,考虑为转移,右肾囊肿。上腹部CT(西安交大二附院 2020.02.26)平扫:未见明显异常。颈部、锁骨上淋巴结超声(西安交大二附院 2020.02.26):未见明显肿大淋巴结。心脏超声(西安交大二附院 2020.02.26):EF61%,升主动脉增宽,左心收缩功能正常范围,舒张松弛功能减低。头颅MRI、全身骨显像:未见明显异常。
免疫相关指标: 自身抗体全套: ANA 阳性(+),Ro-52 阳性(+) ; 抗核抗体滴度: ANA 1:1000(+); 风湿系列: 类风湿因子72.00 IU/mL,C-反应蛋白19.7mg/L; 体液免疫全套: 补体C3 1.48 g/L。 风湿免疫科会诊后考虑ANA高滴度,存在结缔组织疾病(CTD),建议口服硫酸羟氯喹200mg、qd,暂不加用其余免疫抑制剂。
至此,应修正诊断为
1、肺恶性肿瘤(右下肺小细胞癌,广泛期);双侧肾上腺继发恶性肿瘤;右侧胸膜继发恶性肿瘤;纵隔淋巴结继发恶性肿瘤;右肺门淋巴结继发恶性肿瘤;
2、肺恶性肿瘤(左下肺周围型腺癌,驱动基因阴性,PD-L1<1%);
3、肺纤维化合并肺气肿(CPFE);
4、结缔组织疾病;
5、2型糖尿病
从诊疗经过到疾病转归,以及患者病程中的d-dimer变化趋势能看到什么?该病例具有哪几个特点?
该患者起病以来,右下肺病灶持续进展,左下肺病灶处于稳定状态,针对右下肺肺小细胞肺癌(右下肺小细胞癌),我们给予了4周期依托泊苷+顺铂(EP)方案全身化疗,同时胸腔内局部灌注血管生成抑制剂贝伐珠单抗 200mg,化疗期间监测肿瘤标记物及胸部CT如下:
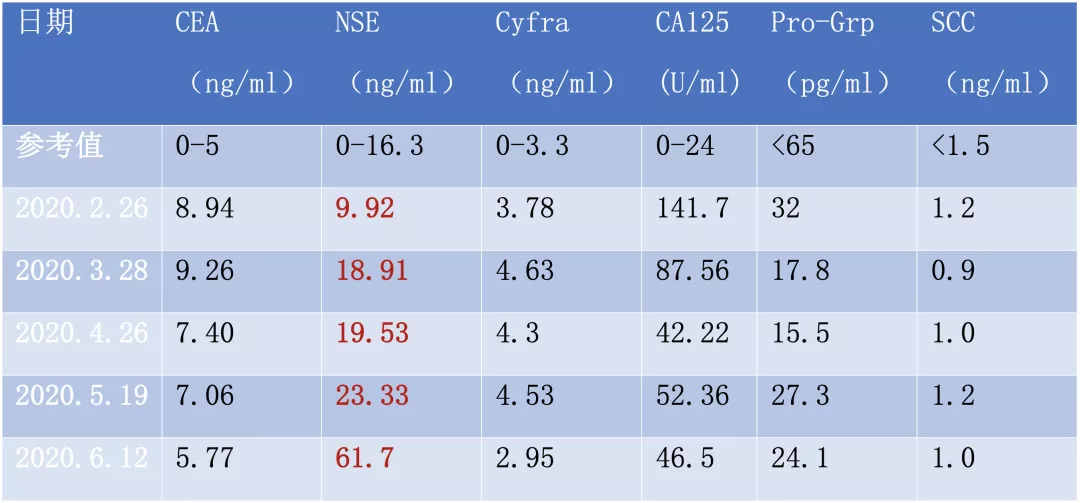
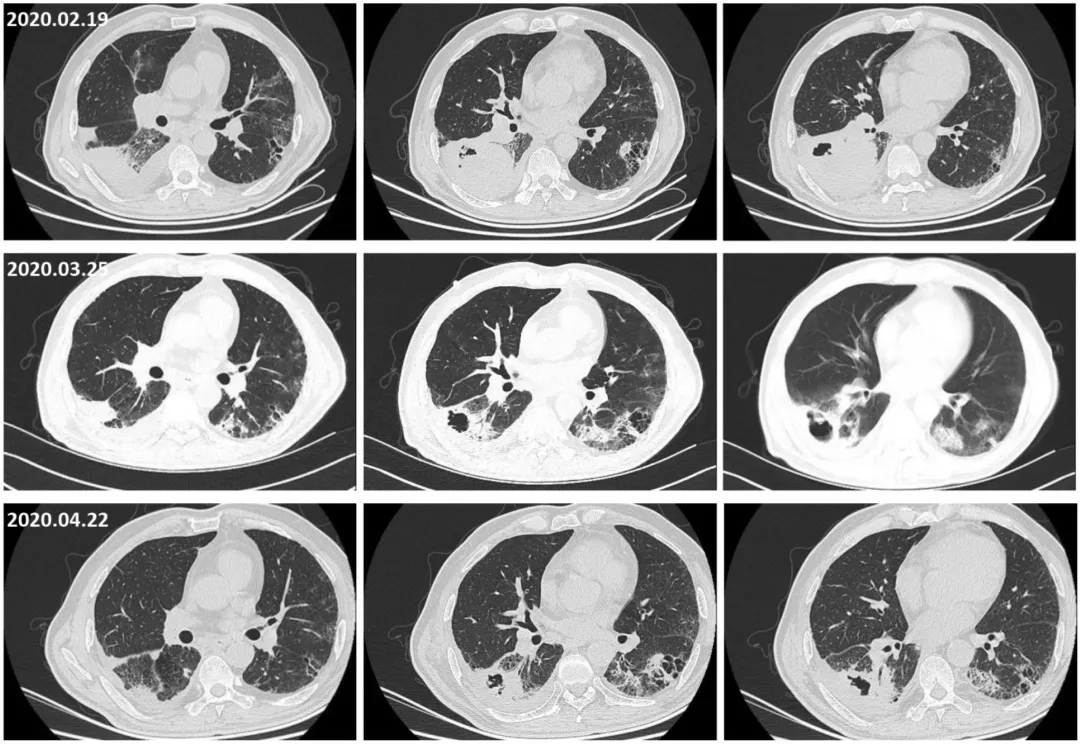
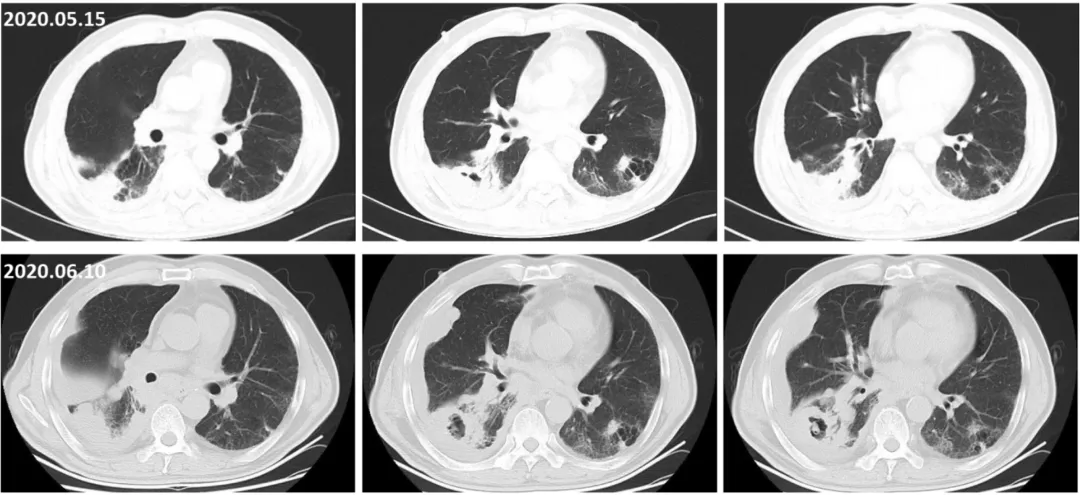
经过4周期EP方案化疗后,再进行评估疗效,患者咳嗽、气短的症状持续,治疗期间还出现间断咯血。右下肺小细胞肺癌在第1周期化疗后部分缓解(PR),后又进行性进展,NSE逐渐升高,化疗期间行全身评估未发现新发转移病灶,左下肺腺癌病灶相对稳定。
针对右下肺小细胞肺癌,我们调整了化疗方案,因拓扑替康全国断货,鉴于患者肺间质纤维化,放疗科不建议行放疗,患者家属拒绝免疫治疗,遂调整化疗方案为多西他赛 120mg d1 +顺铂 30mg(DP)d1-3方案,联合全身用血管生成抑制剂恩度(210mg 持续72小时静脉泵入),胸腔局部灌注顺铂 30mg。以上方案治疗2周期,患者右下肺小细胞肺癌仍持续进展,如下图:
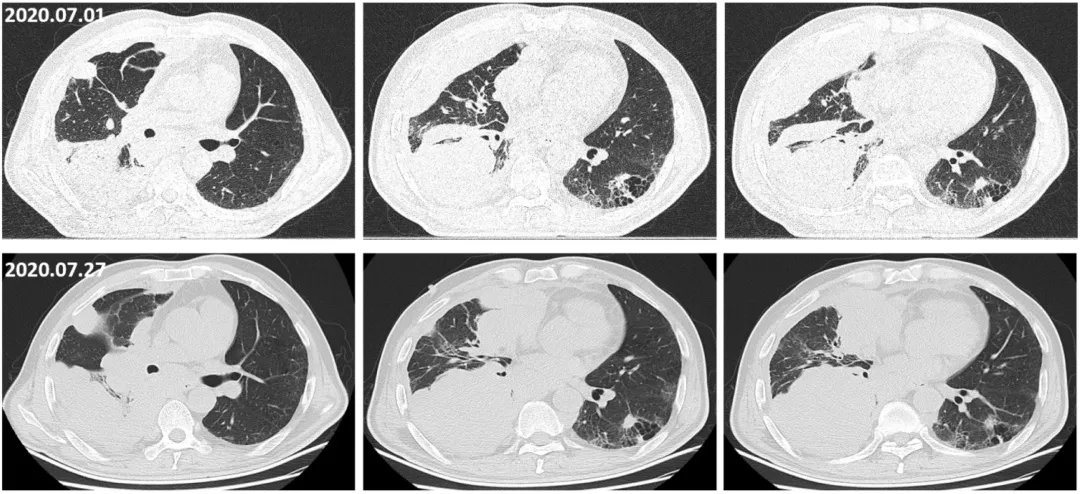
疾病转归:
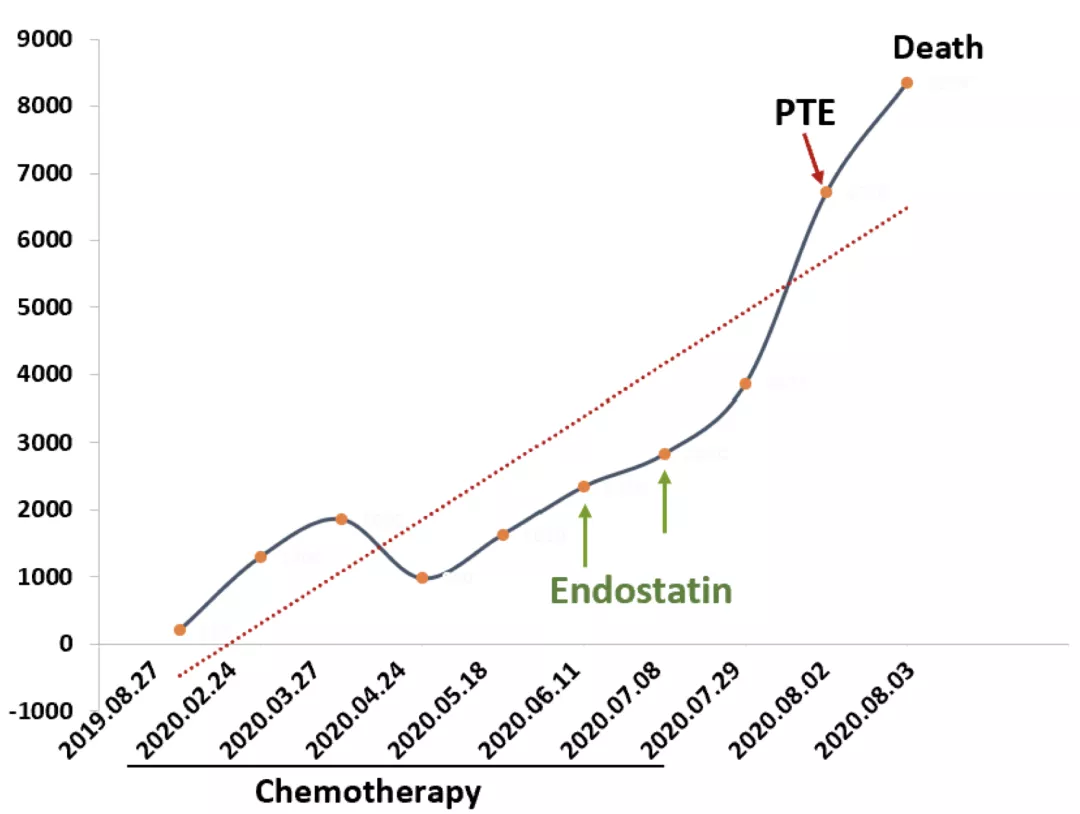
患者于今年7月29日第7次入院后,一般状况差,右下肺小细胞癌继续进展,PS评分3分,未继续化疗,以支持治疗为主。入院时d-dimer 3870 ng/ml,VTE风险评分6分,但患者仍咯血,双下肢静脉超声未见血栓形成,权衡利弊后未予以预防性抗凝治疗。
8月2日夜间,患者突发胸闷、气短,血氧饱和度将至64%,心率130次/分左右,血压105/72mmHg,急查d-dimer 6710 ng/ml,肌钙蛋白I 0.09ng/ml,BNP 430.2pg/ml,床旁心脏超声提示室间隔平直,右心增大,轻度肺动脉高压,考虑急性肺栓塞(PTE),PTE危险分层中高危,PTE严重指数(PESI)Ⅴ级,患者家属拒绝CTPA检查及溶栓治疗,予以抗凝治疗,后抢救无效死亡。
患者病程中的d-dimer变化趋势如下:
据此,我们对该病例的特点进行了总结:
1、同时性、不同类型、不同转归、双原发性肺癌:
(1)、右下肺小细胞癌,广泛期,PD
(2)、左下肺周围型腺癌,驱动基因阴性,PD-L1<1%,SD
2、肺纤维化合并肺气肿CPFE并发肺癌
3、化疗反应差,快速进展
关键因素:患者男性、重度吸烟、CPFE、PS≥2、多发转移、VTE高风险
常规胸部CT检查发现为CPFE合并肺癌的患者,后期出现进行性加重的咳嗽、气短症状,预示局部病灶的进展迅速……如何考虑肺癌的预防性抗凝治疗?血管生成抑制剂(AIs)对血栓形成有哪些影响?
讨论一:关于本例患者后期症状与病灶进展的关系
随着研究深入,学者们认为肺纤维化合并肺气肿(combined pulmonary fibrosis and emphysema, CPFE)为一种独特的表型(独立的疾病),在2005年被首次定义,常与吸烟相关(特发性,98%的患者有吸烟史) [1] ,2011 年首次提出 CTD 相关 CPFE,二者具有类似特征 [2] 。CTD 相关 CPFE在类风湿性关节炎、系统性硬化症中多见,而华西医院对2011-2015 年收治的 20 例 CTD 合并 CPFE 患者的CTD类型分布情况进行了分析,发现45%的患者为皮肌炎/多肌炎,后依次为系统性硬化症(20%)、类风湿性关节炎(10%)、重叠综合征(10%)、混合性CTD (5%)、系统性红斑狼疮(5%)、干燥综合征(5%) [3] 。
CPFE患者死亡率高,中位生存期为2.1-8.5年,结缔组织疾病中的CPFE患者,1年生存率100%,2年生存率94%,5年生存率73%,常见死因包括肺动脉高压、难治性低氧血症、肺部感染、肺癌 [4] 。且CPFE更易发展为肺癌,死亡风险更高,最常见的病理类型为鳞状细胞癌,其次为腺癌、小细胞癌,肺癌发生与肺实质纤维化相关,而非肺气肿改变,CPFE合并肺癌患者病程进展快,预后差,CPFE是肺癌手术患者的独立预后因素 [5] 。有文章对47例西方CPFE合并肺癌患者进行了分析,发现43%的患者在诊断肺癌前已诊断为CPFE,中位间隔时间为2.1 年 (0.6–11.2 年),57%的患者同时诊断CPFE及肺癌,47%的患者为常规胸部CT检查时发现肺癌,53%的患者因进行性加重的咳嗽、气短症状就诊时发现肺癌 [6] 。
因此,常规胸部CT检查发现为CPFE合并肺癌的患者,后期出现进行性加重的咳嗽、气短症状,预示着局部病灶的进展迅速。
讨论二:肺癌患者的预防性抗凝治疗
肺癌与血栓关系明确,肿瘤本身及肿瘤治疗均会增加血栓风险,肿瘤细胞可分泌凝血酶,并可刺激内皮细胞及单核细胞中促凝因子的表达,化疗通过促进组织因子的表达增加血栓风险。血栓本身对肿瘤也有影响,其可拦截循环肿瘤细胞,形成癌栓,有利于肿瘤细胞的存活,促进肿瘤转移。但肺癌患者是否进行预防性抗凝治疗一直存在争议,主要原因是潜在出血风险。最新荟萃分析纳入10项RCT及24项cohort肺癌预防性抗凝研究,结果显示预防性抗凝可减少肺癌患者VTE发生风险,但其治疗获益被出血风险所抵消,预防性抗凝治疗并未改善患者预后 [7],不建议对肺癌患者进行常规预防性抗凝治疗。关于肿瘤(不限于肺癌)患者预防性抗凝治疗的关键性RCT研究包括CASSINI [8]、PROTECHT [9]、SAVE-ONCO [10],结果显示预防性抗凝治疗可明显减少肿瘤患者的血栓事件,并没有显著增加出血风险,但未改善患者总生存期。
ASCO对于非卧床肿瘤患者全身化疗期间的VTE抗凝预防建议包括 [11] :不建议对肿瘤患者进行常规抗凝治疗;对于VTE高风险(Khorana ≥2)、全身化疗、出血风险低的患者,建议进行预防性抗凝治疗;进行全身化疗的多发性骨髓瘤患者应进行预防性抗凝治疗;疗程一般推荐6个月,根据VTE复发风险、出血风险、治疗费用、生活质量、预期寿命、患者接受度等,决定是否延长抗凝。预防性抗凝方案包括:达肝素 5000U qd;依诺肝素 40mg qd;磺达肝癸钠 2.5mg qd;阿哌沙班 2.5mg bid;利伐沙班 10mg qd。
本例患者最终发生肺栓塞,因出血风险大,在全身治疗期间未进行预防性抗凝。在临床肺癌患者管理过程中应时刻警惕VTE的发生,充分进行血栓/出血风险评估,严格筛选,进行个体化、精准预防性抗凝治疗。
讨论三:血管生成抑制剂(AIs)对血栓形成的影响
AIs单用、联合用药均可增加动、静脉血栓形成风险,AIs促进高凝状态肿瘤患者血栓形成的机制包括:抵抗活化蛋白C;CRP、Ⅷ因子、VWF 因子水平升高;损害内皮完整性(血管内皮细胞死亡);NO、PGI2 水平降低;肝源性促红细胞生成素增多,导致血液粘稠度增加等 [12] 。贝伐珠单抗的使用增加肺癌患者的VTE风险 [13] ,而恩度的使用是否增加肺癌患者VTE风险仍需进一步临床观察和研究。目前尚无血管生成抑制剂相关血栓形成预防策略的相关指南。临床上,对于使用AIs的患者,应警惕血栓风险。
参考文献
[1] Cottin, V., et al., Combined pulmonary fibrosis and emphysema: a distinct underrecognised entity. Eur Respir J, 2005. 26(4): p. 586-93.
[2] Cottin, V. and J.F. Cordier, Combined pulmonary fibrosis and emphysema in connective tissue disease. Curr Opin Pulm Med, 2012. 18(5): p. 418-27.
[3] 王岚, 柴桦, 梁斌苗, 张睿, 卢春燕, 吕霞飞, 易群, 欧雪梅. 结缔组织疾病合并肺纤维化-肺气肿综合征 20 例临床分析并文献复习. 中国呼吸与危重监护杂志, 2017, 16(5): 484-489.
[4] Cottin, V., et al., Combined pulmonary fibrosis and emphysema syndrome in connective tissue disease. Arthritis Rheum, 2011. 63(1): p. 295-304.
[5] Hata, A., et al., Impact of combined pulmonary fibrosis and emphysema on surgical complications and long-term survival in patients undergoing surgery for non-small-cell lung cancer. Int J Chron Obstruct Pulmon Dis, 2016. 11: p. 1261-8.
[6] Girard, N., et al., Lung cancer in combined pulmonary fibrosis and emphysema: a series of 47 Western patients. J Thorac Oncol, 2014. 9(8): p. 1162-70.
[7] Zhang, M., S. Wu, and C. Hu, Do lung cancer patients require routine anticoagulation treatment? A meta-analysis. J Int Med Res, 2020. 48(1): p. 300060519896919.
[8] Khorana, A.A., et al., Rivaroxaban for Thromboprophylaxis in High-Risk Ambulatory Patients with Cancer. N Engl J Med, 2019. 380(8): p. 720-728.
[9] Agnelli, G., et al., Nadroparin for the prevention of thromboembolic events in ambulatory patients with metastatic or locally advanced solid cancer receiving chemotherapy: a randomised, placebo-controlled, double-blind study. Lancet Oncol, 2009. 10(10): p. 943-9.
[10] Agnelli, G., et al., Semuloparin for thromboprophylaxis in patients receiving chemotherapy for cancer. N Engl J Med, 2012. 366(7): p. 601-9.
[11] Key, N.S., et al., Venous Thromboembolism Prophylaxis and Treatment in Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol, 2020. 38(5): p. 496-520.
[12] Zarbin, M.A., Anti-VEGF Agents and the Risk of Arteriothrombotic Events. Asia Pac J Ophthalmol (Phila), 2018. 7(1): p. 63-67.
[13] Nalluri, S.R., et al., Risk of venous thromboembolism with the angiogenesis inhibitor bevacizumab in cancer patients: a meta-analysis. JAMA, 2008. 300(19): p. 2277-85.
专家介绍

王蕾
博士,院级副研究员,入选“西安交通大学青年优秀人才A类支持计划”。长期从事肺血管疾病的基础与临床工作,获优秀博士学位论文,曾至日本顺天堂大学附属顺天堂医院交流学习,以第一作者身份发表SCI论文数篇,累计影响因子逾20分,主持国家自然科学基金青年项目1项及中央高校基本科研业务项目1项,参译专著1项。美国胸科学会流行病、临床与操作研究方法(MECOR)培训结业,国际基层呼吸联盟(IPCRG)研究者学院中国临床科研训练营培训结业。

明宗娟
西安交通大学第二附属医院呼吸与危重症医学科副主任医师,在职博士。陕西省保健学会过敏性疾病防治专业委员会常委,陕西省肿瘤个体化诊疗专业委员会委员兼秘书,陕西省抗癌协会抗癌药物专业委员会委员,主持陕西省自然基金1项,参与国科金多项。以第一作者发表SCI论著2篇、统计源期刊文章6篇,参与发表SCI文章10余篇,参编专著1部,以主要完成人参与陕西省科技进步奖二等奖1项。

杨拴盈
一级主任医师,教授,博士生及博士后导师。西安交通大学第二附属医院呼吸与危重症医学科主任。教育部新世纪优秀人才。中华医学会呼吸分会委员;中华医学会呼吸分会肺癌学组委员;中国呼吸医师协会肺癌工作委员会委员;国际肺癌研究会会员;《中华结核和呼吸杂志》、《中华肺部疾病杂志》、《中国肺癌杂志》、《国际呼吸杂志》《现代肿瘤医学》、《中国呼吸与危重症杂志》、《西安交通大学学报(医学版)》常务编委或编委。主持国家自然科学基金4项,发表论文182篇,SCI 53篇,获省科技进步二等奖2项,主编专著1部,参与制定肺癌诊疗相关指南、共识13部。
本文完
采写编辑:冬雪凝;排版:Jerry


