摘要
孕妇在妊娠期间出现肺血栓栓塞的风险较一般人群高,其临床症状隐匿,且诊断及治疗方法有异于非妊娠期,临床医生充分了解妊娠期肺血栓栓塞的特点可为优化妊娠结局提供帮助。本文就国内外关于妊娠期肺血栓栓塞的研究进行综述。
妊娠期肺血栓栓塞(pulmonary embolism,PE)因其临床症状隐匿,且限于对胎儿承受的放射线剂量的顾忌,诊断相对困难,一直是临床工作中的棘手问题,有报道致死率为2.4%~2.8%[1, 2]。中华医学会呼吸病学分会和欧洲呼吸病学协会(ERS)分别在2018和2019年发表了急性PE临床指南[3],我国也在2018年发表了肺血栓栓塞症诊治指南[4],其中均涉及妊娠期PE的内容。本文参考上述指南及新近3年的临床研究新结果,综述如下。
一、发生率及危险因素
妊娠期孕妇发生静脉血栓栓塞症(venous thromboembolism,VTE)的风险较同龄非妊娠女性高,发病率为0.76~1.72/1 000,约为非妊娠人群的4倍[1, 5],43%~60%的妊娠相关PE可发生在产褥期[1, 6]。与妊娠相关的发生VTE的危险因素包括体外受精等辅助生殖技术、死产、先兆子痫、产后出血、剖腹产尤其是紧急剖腹产等[7],其中双胎的调整后OR值为6.6(95%CI:2.1~21),单胎的调整后OR值为4.3(95%CI:2.0~9.4)[8]。其他危险因素包括既往的VTE病史、肥胖、高龄、合并其他疾病如心脏病、高血压、糖尿病、镰状细胞贫血以及吸烟[9, 10]。有文献报道亚洲或拉丁美洲孕妇VTE的发病率分别为1.07/1 000及1.25/1 000,低于白人(1.75/1 000)和黑人(2.64/1 000)[1]。如孕妇本身即有遗传性易栓症,如蛋白S、蛋白C缺陷、Leiden Ⅴ因子、凝血酶原G20210A突变或抗磷脂综合征、系统性红斑狼疮,则其孕期或产后出现血栓事件风险则较高[1, 11]。其中尤以无论各种原因引起的易栓症病史或血栓事件病史的患者出现孕期VTE风险最高,OR值分别为51.8(95%CI:38.7~69.2)和24.8(95%CI:17.1~36.0)[1]。美国妇产科医师协会推荐对所有遗传性血栓形成倾向的孕妇进行个体化风险评估,其抗凝决策需考虑VTE病史、遗传性血栓形成倾向的严重度、家族史及其他危险因素如剖腹产、肥胖和长期不活动等[12]。不推荐对出现血栓事件孕妇的急性期进行筛查易栓症指标,应在分娩后且停用抗凝药物后再筛查。
二、临床诊断
妊娠期发生PE的临床表现不特异,与正常妊娠时的不适难以区分。PIOPED Ⅱ期研究结果提示,非妊娠患者肺栓塞的症状和体征包括静息时呼吸困难或劳力性呼吸困难(73%)、胸膜炎性胸痛(66%)、咳嗽(37%)、端坐呼吸(28%)、下肢疼痛和(或)肿胀(44%)、哮鸣(21%)和咯血(13%)等[13]。而一些较小型的研究提示妊娠患者的肺栓塞起病特征与上述相似:呼吸困难(62%)、胸膜炎性胸痛(55%)、咳嗽(24%)和出汗(18%)是4种最常见的起病特征[14, 15]。主要的鉴别诊断则包括肺炎、心肌缺血或梗死、心力衰竭、心包炎、气胸和肌肉骨骼疼痛、慢性肺疾病急性加重等。诊断流程见图1。
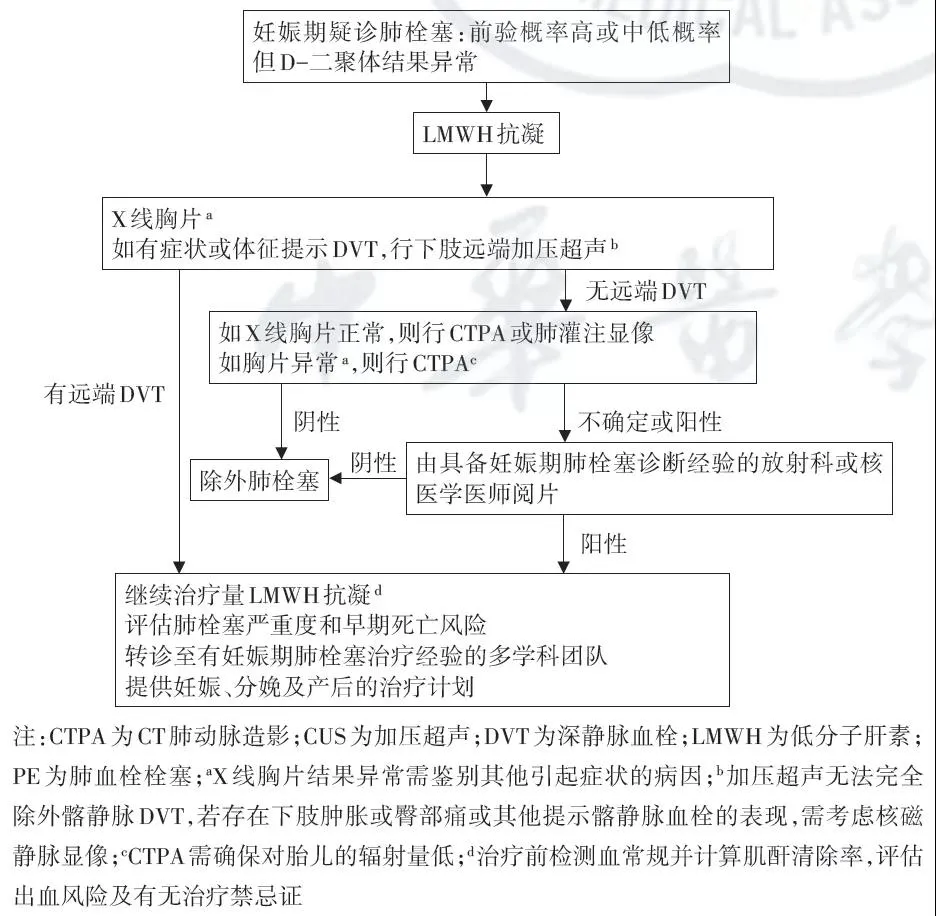
图1:妊娠期疑诊肺血栓栓塞的诊断流程图[3]
1、D-二聚体
正常妊娠期可伴随血清D-二聚体水平升高[16]。Chan等[17]发现随着孕周增加,D-二聚体水平诊断PE的特异度有降低趋势,孕期前6个月D-二聚体检测阴性结果的阴性预测值为100%,而阳性结果的敏感度和特异度分别为100%和60%。有学者建议将孕中期D-二聚体正常值的上限提高至原本的1.5倍,孕晚期提高至2倍,但调整后的敏感度和特异度也仅为69.8%和32.8%[18]。我国的指南则提出D-二聚体正常值可调整为非孕期<0.5 mg/L,孕13周前≤0.64 mg/L,孕14~27周≤2.3 mg/L,孕28周后≤3.14 mg/L[19]。
D-二聚体检测值需综合临床表现、加压超声甚至CT肺动脉造影(CTPA)检查结果综合判断其意义,文献报道392例修正后Geneva评分为非高危的孕妇中,11.7%的受试者D-二聚体阴性,即使无影像学检查也可除外PE[20, 21]。另一项对498例可疑PE的孕妇的结果显示,通过综合妊娠调整后的YEARS评分和D-二聚体结果可除外低风险孕妇的PE诊断[22]。
2、下肢加压超声
推荐所有疑诊PE的孕妇行下肢加压超声检查,一旦确诊下肢深静脉血栓即可启动抗凝治疗。该检查对于一般人群中诊断有症状的近端深静脉血栓的敏感度和特异度分别为97%和94%[23],而对腓静脉和髂静脉血栓的诊断准确性稍低[24]。
3、肺通气/灌注显像(V/Q)或CTPA
如下肢加压超声结果阴性,则需考虑V/Q或CTPA检查。估测CTPA对胎儿的辐射量为0.05~0.5 mGy,对孕妇乳腺组织的辐射量为3~10 mGy,随孕周不同稍有差异[25];而使用99锝标记的白蛋白的V/Q检查辐射量较高,但单纯的肺灌注显像依放射量大小不同,对胎儿及孕妇乳腺组织的辐射量分别为0.02~0.60 mGy,0.16~1.20 mGy,肺通气显像对胎儿及孕妇乳腺组织的辐射量分别为0.05~0.50 mGy、3~100 mGy[26, 27]。上述胎儿接受的辐射剂量均低于可引发胎儿放射性损伤的剂量阈值,其中肺灌注显像的辐射量较CTPA更低,且对于孕妇乳腺的辐射量也更低,所以国内的指南更倾向于首选肺灌注显像[28]。正在进行的利用低剂量CTPA诊断PE的研究未来可能会提供新的临床诊断方法[29]。
对比肺灌注显像和CTPA,任一方法结果阴性则对于除外孕妇PE的效力是相同的,但两种方法同样存在对PE诊断存在不确定的概率,不同研究报道范围为4%~33%,两种方法差异不明显[16, 27, 30]。PIOPED研究提示肺灌注显像的诊断效力很大程度上决定于PE的前验概率[13]。而CTPA的另一优势是较肺灌注显像可提供除PE外其他诊断可能,有不同报道称19.0%~30.1%的CTPA结果可诊断其他病[31, 32]。
4、其他
利用增强核磁技术的血管重建显像,造影剂对于胎儿的作用尚未确定,有个别报道该技术对髂静脉血栓敏感度和特异度较高,但现阶段并不推荐用于孕妇PE的诊断[33]。传统的肺血管造影技术因对胎儿辐射量大,不推荐使用[34]。
三、治疗
血流动力学不稳定、血凝块大或有母体合并症的孕妇应住院进行抗凝治疗。普通肝素可用于PE 患者的初始治疗、分娩、手术或溶栓治疗,待患者血流动力学稳定后,可改用低分子肝素(LMWH)进行替代治疗。治疗时间至少至产后6 周,最短治疗时间为3~6 个月[35]。
1、溶栓
因溶栓治疗存在包括出血、流产、早产、胎盘早剥、胎死宫内等风险,故溶栓前应充分权衡利弊,特别谨慎。ERS的溶栓指征为危及生命的急性PE,不推荐在分娩前溶栓。纳入32例孕妇(其中含13例PE)的小规模研究结果显示溶栓后发生非胎儿的大出血为2例[36];另有报道溶栓后产妇发生妊娠期及产后大出血的几率分别达18%和58%,胎儿病死率达12%[37]。放置下腔静脉滤器的指征与非妊娠期PE相同。
2、抗凝
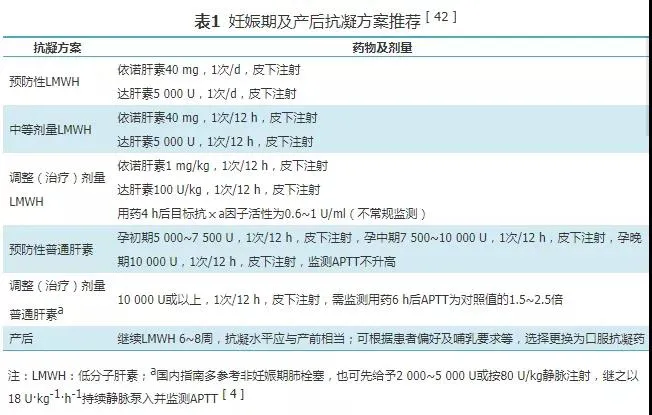
因不透过胎盘且不增加胎儿出血及致畸风险,且药代动力学更可控,妊娠期PE抗凝首先推荐使用LMWH[9],文献报道94.7%的孕妇PE经LMWH抗凝后可出生活产婴儿[38]。其初始治疗剂量可参考非妊娠PE患者,但有学者推测LMWH药代动力学可能需根据孕周调整并增大剂量[39]。关于是否需监测抗凝血因子Ⅹ水平尚有争议[35],ERS指南建议抗凝血因子Ⅹ的监测仅在反复VTE、肾功能不全或极端体重情况下使用[3]。妊娠期使用普通肝素也相对安全,小规模的研究提示普通肝素和LMWH的效力和安全性类似[40],但普通肝素出现肝素诱导的血小板减低或罕见的骨质流失的风险稍有增加[41]。ACOG建议初始治疗按调整(治疗)剂量3~6个月后抗凝治疗强度可以降低到中等或预防剂量,持续至分娩和产后6 周,抗凝方案具体见表1[42]。因临床数据偏少且可少量通过胎盘,磺达肝癸钠仅作为无法使用LMWH时的替代用药[43]。维生素K拮抗剂如华法林可通过胎盘并致畸,孕晚期引起胎儿出血或胎盘早剥。新型口服抗凝药(NOAC)在妊娠患者中使用的安全性尚不肯定,应避免妊娠期使用该类药物,或一旦确认妊娠需将正在使用的该类药物更换为低分子肝素,但不必因此必须选择性终止妊娠[42, 44]。早期的动物实验提示该类药可透过胎盘,可引发幼崽生长受限、流产、肝胆系统发育畸形等[45]。近期的人类研究提示妊娠期服用利伐沙班和阿哌沙班的自发流产的OR值分别为2.70(95%CI:1.79~4.07)和6.76(95%CI:2.99~15.25),其中后者较其他抗凝方法有显著性提高[46]。刨除选择性终止妊娠者,另一项纳入101例妊娠期使用NOAC的研究提示流产率高达31%,出生活产胎儿的比例仅为68%,胎儿或新生儿出现面部或肢体等畸形的有8例,其中一半的病例推测与孕早期使用利伐沙班相关[47, 48]。另有个例报告孕妇服用利伐沙班,胎儿出现了心脏畸形[49]。
3、围产期的治疗调整
指南中提到在充分抗凝下的孕妇应避免自发的分娩。若孕妇拟采用局部麻醉下的计划性分娩,则应在脊髓或硬膜外麻醉前至少停用LMWH至少24 h,以避免可能的麻醉后脊髓血肿。对于新近诊断的PE,可在计划性分娩前至少36 h将LMWH过渡至普通肝素,分娩前4~6 h停用普通肝素并确保局麻前活化部分凝血酶原时间(APTT)恢复正常[50];另有文献对于超过孕37周诊断的急性PE,推荐放置下腔静脉滤器以避免分娩前临时中断抗凝造成的新发血栓风险[51]。
分娩后一般在24 h内恢复抗凝,具体时间需多学科协作评估血栓及出血风险后决定[52]。而我国的指南建议在自然分娩后6~12 h或剖宫产术后12~24 h恢复抗凝[19]。
哺乳期使用LMWH或华法林相对安全[53]。因NOAC可在乳汁中被少量检测到,其安全性不确定,故不推荐应用于有哺乳要求的患者[44, 54]。
妊娠期存在PE发生的危险因素,临床医生需要提高诊断的警觉性。诊断需要结合临床表现及辅助检查综合判断,下肢加压超声对了解有无下肢深静脉血栓非常有帮助,PE的检查首选肺灌注显像,也可考虑低剂量CTPA。LMWH是诊断妊娠期PE后的首选用药。
参考文献(略)
作者:汪劭婷 徐凯峰 - 中国医学科学院 北京协和医学院 北京协和医院呼吸与危重症医学科
引用本文: 汪劭婷, 徐凯峰. 妊娠期肺血栓栓塞诊治进展 [J] . 中华结核和呼吸杂志,2021,44 (01): 49-53. DOI: 10.3760/cma.j.cn112147-20200303-00231
本文来源自公众号:中华结核和呼吸杂志
原链接戳:【综述】妊娠期肺血栓栓塞诊治进展
本文完
排版:Jerry


