2021年1月, AJRCCM杂志在线刊登德国海德堡大学Michael Kreuter教授的一项回顾性研究:基于吡非尼酮和干扰素gamma-1b试验的汇总数据探讨IPF患者单核细胞计数与预后之间的关系。文章题为「Monocyte Count as a Prognostic Biomarker in Patients with Idiopathic Pulmonary Fibrosis」。

关键字:预后,肺纤维化,生物标志物
原文链接
https://www.atsjournals.org/doi/10.1164/rccm.202003-0669OC
一、研究背景
特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)在不同患者中病程变化较大、预后难以预测,因此迫切需要简单、经济高效的预后生物标志物,以识别存在疾病快速进展高风险的病人并制定个体化治疗方案。目前,虽然已经鉴定了几种潜在的预后生物标志物(prognostic biomarkers),如血液循环生物标志物(circulating biomarkers)[1]、基因表达特征[2]和端粒长度[3],但是这些生物标志物的检测相对复杂、耗费人力且成本高。全血及外周血细胞已成为很多其他呼吸道疾病诊断和预测生物标志物的潜在来源。最近对来自三个大型健康记录数据库和一组系统性硬化症患者的数据进行的回顾性汇总分析发现,单核细胞计数升高是IPF和其他纤维化疾病(包括系统性硬化症,肥厚型心肌病和骨髓纤维化)死亡的潜在预测生物标志物[4];对澳大利亚IPF注册中心数据的分析还发现:单核细胞水平与死亡之间存在关联[5]。鉴于单核细胞计数是标准血液检测的一部分,因此这可能成为IPF疾病预后的一种简单且便宜的生物标志物,目前有待进一步研究。
二、研究方法
人群:来自四项III期、随机、安慰剂对照试验的患者数据的回顾性汇总分析(retrospective pooled analysis),包括吡非尼酮试验[ASCEND(NCT01366209),CAPACITY(NCT00287729和NCT00287716)]和干扰素gamma-1b试验[ INSPIRE(NCT00075998)]。
采样及测量:在基线和试验预定的时间记录单核细胞计数,在本文被分析中定义为时间依赖变量。该研究共纳入2067名患者,按患者的基线单核细胞计数分层(<0.60 GI/L [n = 1609],0.60至<0.95 GI/L [n = 408],≥0.95GI/L [n = 50],GI=109 细胞数)。
结局指标:1年内发生IPF进展(用力肺活量[FVC]预计值降低≥10%, 6分钟步行距离[6MWD]下降≥50 m,或死亡)、全因住院和全因死亡。
数据分析:使用双变量和多变量模型评估单核细胞计数(定义为时间依赖性)与预后之间的关系。
三、研究结果
1)单核细胞计数研究结果的一年风险。
在双变量分析中,单核细胞计数≥0.95 GI/L和0.60至<0.95 GI/L的患者与<0.60 GI/L的患者相比首次出现IPF进展、全因住院和全因死亡率的时间较短(图1)。
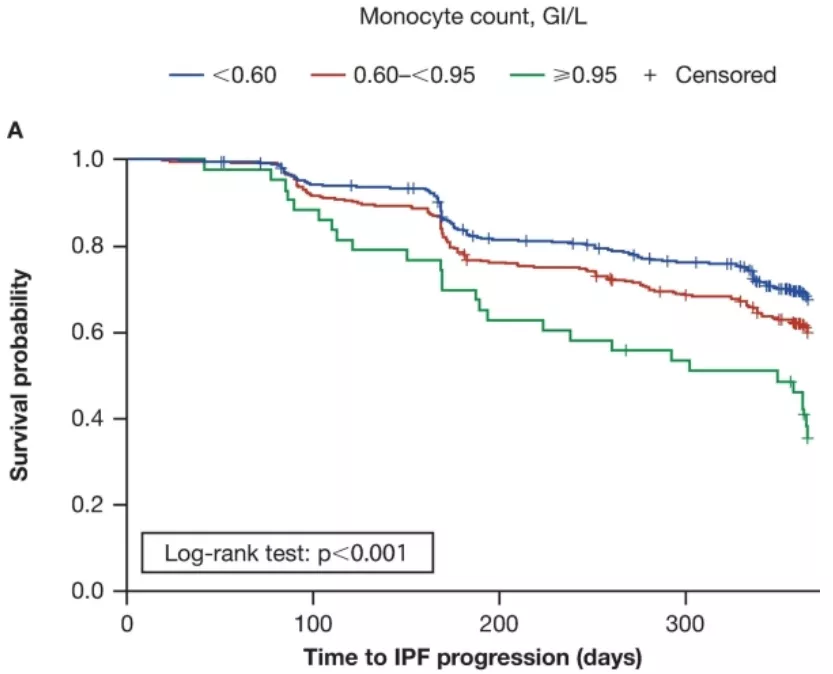
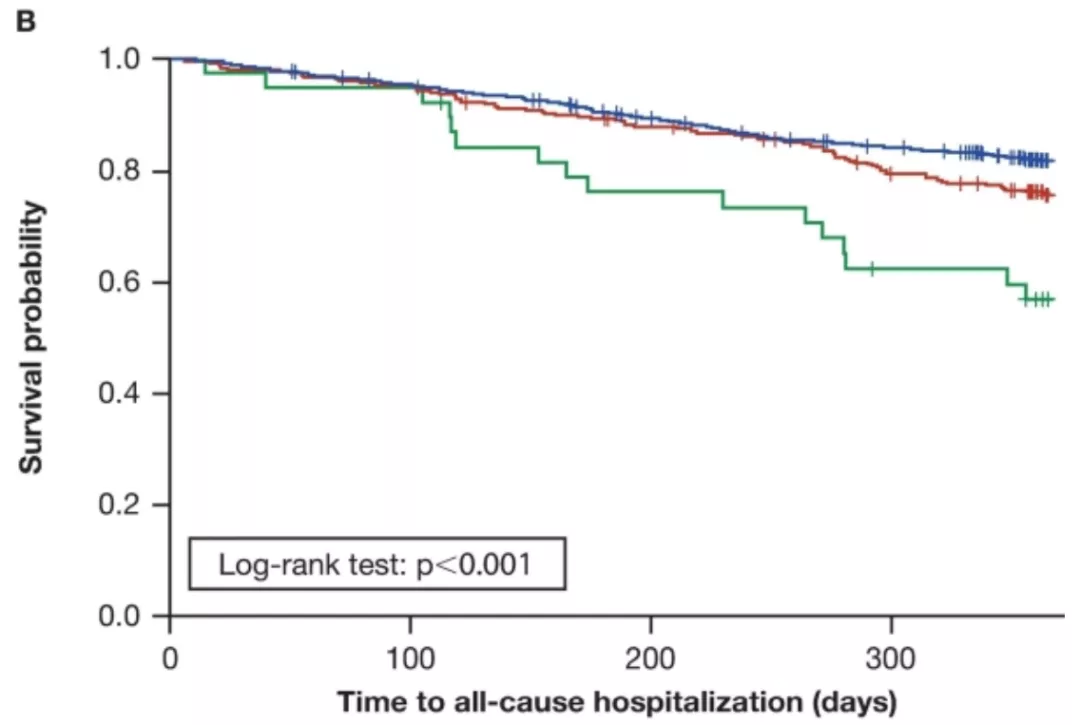
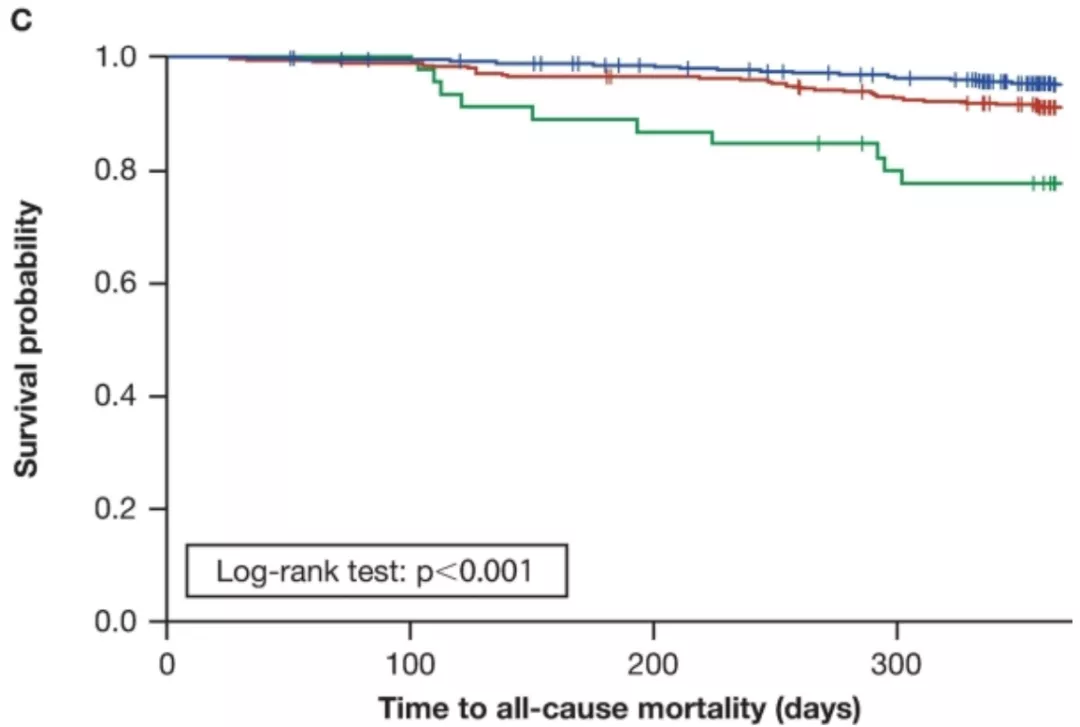
图1:Kaplan–Meier曲线,以单核细胞计数分层,开始出现(A)IPF进展;(B)全因住院和(C)一年以上全因死亡率的时间。其中单核细胞计数定义为时间依赖性变量。
按基线单核细胞计数分层(<0.60 GI/L [n = 1609],0.60至<0.95 GI/L [n = 408]和≥0.95 GI/L [n = 50])。在调整后的分析,单核细胞计数为0.60至<0.95 GI/L或≥0.95 GI/L的患者较<0.60 GI/L的患者都有较高比例的IPF进展( HR [95% CI]分别为1.25 [1.04, 1.50];p=0.016和1.80 [1.23,2.63];p=0.002)、全因住院(HR [95% CI]分别为1.29 [1.03, 1.63];p=0.030和2.14 [1.30, 3.51];p=0.003)以及全因死亡(HR [95% CI]分别为1.78 [1.19, 2.66];p=0.005和4.05 [2.00, 8.19];p<0.001)。(图2)
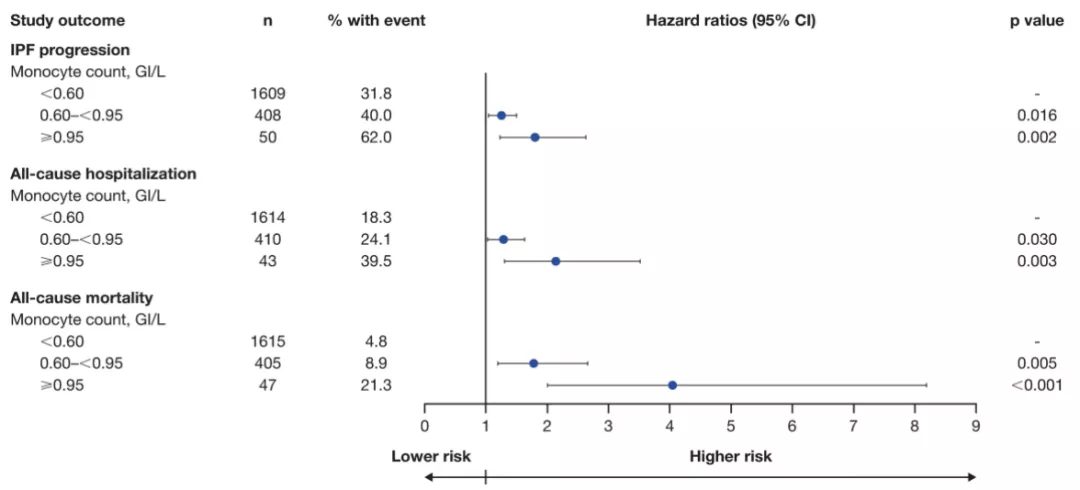
图2:单核细胞计数与IPF进展,全因住院和全因死亡率调整后的风险比
2)单核细胞计数的变化(和基线相比)与1年内的任何结局指标均无关联,并且似乎不受研究中治疗方案的影响。
四、论文贡献
对IPF患者的ASCEND,CAMPUCITY和INSPIRE试验进行的回顾性汇总分析发现:单核细胞计数升高与IPF一年后疾病进展、住院和死亡的风险显著增加有关,除了单核细胞数目≥0.95 GI/L外,单核细胞计数0.60至0.95 GI/L与较差的一年预后相关(相比于<0.60 GI/L组)。该研究将单核细胞计数确定为IPF的潜在预后生物标志物,为进行单核细胞计数作为IPF的简单且廉价的预后生物标志物的前瞻性临床研究提供理论依据。
五、讨论
此项研究与之前评估IPF患者单核细胞计数与预后之间的关系的研究相一致[4-5]。在先前的回顾性汇总分析中,经过FVC(HR 2.47;p=0.0063)和性别、年龄和生理指标(HR 2.06;p=0.0068)调整后,IPF确诊患者的单核细胞计数≥0.95 GI/L与全因死亡率显着相关(相比于单核细胞计数≤0.95 GI/L)[4]。在同一项研究中,较高的单核细胞计数还与患有其他纤维化疾病(包括全身性硬化症,骨髓纤维化和肥厚型心肌病)的患者缩短生存期有关。进一步支持这些发现的数据来自澳大利亚IPF注册中心中的231名患者。对这些注册数据的分析发现,≥0.95 GI/L的单核细胞计数与校正了年龄,性别和基线预测的FVC百分比后死亡率增加相关(HR 2.36,p=0.02)[5]。
该研究提示了单核细胞(或其他白细胞)水平与IPF进程之间的相关关系。尽管IPF的病理生理学尚未完全阐明,但各种免疫细胞如单核细胞、嗜中性粒细胞和淋巴细胞与IPF发病机理相关联[6] 。目前较为认可的IPF发病机理模型是基于在遗传易感人群中反复上皮损伤,导致异常修复和纤维化组织形成[7-8] 。在此模型中,免疫细胞(包括单核细胞)迁移到损伤部位,以帮助修复及其分化。单核细胞的募集和分化是由周围的微环境驱动的;循环单核细胞有可能变成间质或气道巨噬细胞或树突状细胞[9] 。IPF中的疾病进展与肺泡巨噬细胞的表型和功能改变有关,肺泡巨噬细胞表型的改变可能是由分化的单核细胞亚群的变化所驱动。有研究在健康的衰老人群中观察到气道巨噬细胞由单核细胞驱动的变化现象 [10-11] 。从IPF患者收集的肺单细胞RNA测序已证实存在明显的肺泡巨噬细胞异质性;某些细胞在小鼠模型中被证实与纤维化的发展有关[12-13] 。并且IPF患者中肺泡巨噬细胞不同种群的积累与疾病进展和生存期缩短有关[14] 。这也提示我们值得思考:IPF病人外周血单核细胞数目升高与肺内单核巨噬细胞的表型变化是否存在相关关系?
参考文献
[1] Richards T J, Kaminski N, Baribaud F, et al. Peripheral Blood Proteins Predict Mortality in Idiopathic Pulmonary Fibrosis[J]. American Journal of Respiratory & Critical Care Medicine, 2012, 185(1):67-76.
[2] Herazo-Maya JD, Sun J, Molyneaux PL, Li Q, Villalba JA, Tzouvelekis A, Lynn H, JuanGuardela BM, Risquez C, Osorio JC,et al.Validation of a 52-gene risk profile for outcome prediction in patients with idiopathic pulmonary fibrosis: an international, multicentre, cohort study. Lancet Respir Med,2017, 5: 857-868.
[3] Bridget, D, Stuart, et al. Effect of telomere length on survival in patients with idiopathic pulmonary fibrosis: an observational cohort study with independent validation[J]. Lancet Respiratory Medicine, 2014.
[4] Scott M K D, Quinn K, Li Q, et al. Increased monocyte count as a cellular biomarker for poor outcomes in fibrotic diseases: a retrospective, multicentre cohort study[J]. The Lancet Respiratory Medicine, 2019.
[5] Teoh A K Y, Jo H E, Chambers D C, et al. Blood monocyte counts as a potential prognostic marker for idiopathic pulmonary fibrosis: analysis from the Australian IPF registry[J]. European Respiratory Journal, 2020, 55(4):1901855.
[6] Misharin AV, Morales-Nebreda L, Reyfman PA et al. Monocyte-derivedalveolar macrophages drive lung fibrosis and persist in the lung over the life span. J Exp Med 2017; 214: 2387-2404.
[7] Lederer DJ, Martinez FJ. Idiopathic Pulmonary Fibrosis. N Engl J Med 2018; 378: 1811- 1823
[8] Betensley A, Sharif R, Karamichos D. A systematic review of the role of dysfunctional wound healing in the pathogenesis and treatment of idiopathic pulmonary fibrosis. J Clin Med 2016; 6: E2.
[9] Duffield JS, Lupher M, Thannickal VJ et al.. Host responses in tissue repair and fibrosis. Annu Rev Pathol 2013; 8: 241-276.
[10] Greiffo F R , Viteri-Alvarez V , Frankenberger M , et al. CX3CR1-fractalkine axis drives kinetic changes of monocytes in fibrotic interstitial lung diseases[J]. European Respiratory Journal, 2019, 55(2):1900460.
[11] Byrne A J , Powell J E , O'Sullivan B J , et al. Dynamics of human monocytes and airway macrophages during healthy aging and after transplant[J]. Journal of Experimental Medicine, 2020, 217(3)
[12] Adams TS, Schupp JC, Poli S et al. Single Cell RNA-seq reveals ectopic and aberrant lung resident cell populations in Idiopathic Pulmonary Fibrosis. bioRxiv 2019: 759902.
[13] Aran D, Looney AP, Liu L et al. Reference-based analysis of lung single-cell sequencing reveals a transitional profibrotic macrophage. [J]. Nature Immunology, 2019.
[14] Nouno T, Okamoto M, Ohnishi KEl et al. Elevation of pulmonary CD163(+) and CD204(+) macrophages is associated with the clinical course of idiopathic pulmonary fibrosis patients. J ThoracDis 2019; 11: 4005-4017
译者介绍

尚晓
清华大学医学院基础医学博士在读,师从中日友好医院曹彬教授。主要从事流感等呼吸系统感染性疾病相关研究工作。
本文完
排版:Jerry


