关于呼吸道标本真菌培养阳性结果的解读,我们已经专门针对如何规范临床医生采集标本和如何规范临床实验室检查两个层面作了具体讲述。下一步还需要做什么?今天主要讲临床与实验室之间应该进行怎样的交流?如何正确沟通?需要沟通哪些细节?
想对培养结果进行正确判定,关键依然要回到临床,结合临床进行鉴别。过去临床和实验室并非没有进行过沟通,问题在于沟通得「远远不够」。如何结合临床进行鉴别?总结了五种区分方法。
区分方法一:结合患者罹患真菌感染的危险因素判定……关注不同真菌感染则宿主危险因素不同,体内念珠菌存在可呈多种现状,肺部最难
定植与感染区分方法之一是看患者有无真菌感染的危险因素。当实验室一旦培养出阳性结果,临床医生就应该考虑患者是否存在感染的危险因素,而现在对危险因素的判断已经完全不同于原来了。过去我们对真菌感染的危险因素判断往往就是一句话总结,侵袭性真菌感染的危险因素。但以现在的危险因素举例,曲霉是曲霉的危险因素,念珠菌是念珠菌的危险因素……隐球菌,肺孢子菌等等,都有各自相对不同的危险因素。随着我们对真菌感染认识的提高,现在决不能完全用一句笼统地概括,而是必须区分它们,即需要更细地判断不同的危险因素,就有可能提示不同的真菌感染。因此,对于宿主而言,出现不同真菌感染则提示宿主的危险因素不同。看看指南是如何评价的:
侵袭性肺曲霉病(IPA)宿主因素:
·近期发生中性粒细胞缺乏(中性粒细胞计数<0.5×109/L)并持续超过10天
·接受异基因造血干细胞移植
·既往60天内,长时间使用皮质类固醇(除外变应性支气管肺曲霉病):超过3周的平均最低剂量为0.3mg/kg/d的强的松当量
·既往90天内接受T细胞免疫抑制剂治疗,如:如环孢素、TNF-α阻滞剂、特定的单克隆抗体(如阿仑单抗),或核苷类似物
·遗传性严重免疫缺陷(如慢性肉芽肿、STAT 3缺陷或严重联合免疫缺陷)
·血液恶性肿瘤患者
·实体器官移植受者
·接受B细胞免疫抑制剂治疗,如布鲁顿酪氨酸激酶抑制剂(如:依鲁替尼)
·累及肠、肺或肝的III级或IV级GVHD,且对一线皮质类固醇治疗无效
侵袭性念珠菌感染(IC)宿主因素:
·近期发生中性粒细胞缺乏(中性粒细胞计数<0.5×109/L)并持续超过10天
·血液恶性肿瘤患者
·接受异基因造血干细胞移植
·实体器官移植受者
·既往60天内,长时间使用皮质类固醇(除外变应性支气管肺曲霉病):超过3周的平均最低剂量为0.3mg/kg/d的强的松当量
·既往90天内接受T细胞免疫抑制剂治疗,如:如环孢素、TNF-α阻滞剂、特定的单克隆抗体(如阿仑单抗),或核苷类似物
·遗传性严重免疫缺陷(如慢性肉芽肿、STAT 3缺陷、CARD9缺陷,STAT-1功能亢进或严重联合免疫缺陷)
·累及肠、肺或肝的III级或IV级GVHD,且对一线皮质类固醇治疗无效

可以看到,即使在ICU里,如果怀疑曲霉感染,同样它的宿主因素与之前不完全一样。例如曲霉感染危险因素虽然有一部分类似,但在免疫抑制方面可以表现为重危患者往往存在严重的基础疾病,比如有慢性气道疾病(慢阻肺、支气管扩张),有肝硬化,有重症的病毒感染等,这些情况在临床实际中可能更常见,需要引起临床医生的重视。对于肺移植患者而言,它的危险因素也不一样。

一些器官移植专业的指南告诉我们侵袭性曲霉病的危险因素,上面列出的这些都是它感染的危险因素。AST指南列出的侵袭性霉菌病的危险因素稍微有些不一样的地方。因此可见,大家都在积极地探索,在不同情况下它的危险因素一定是不一样的。
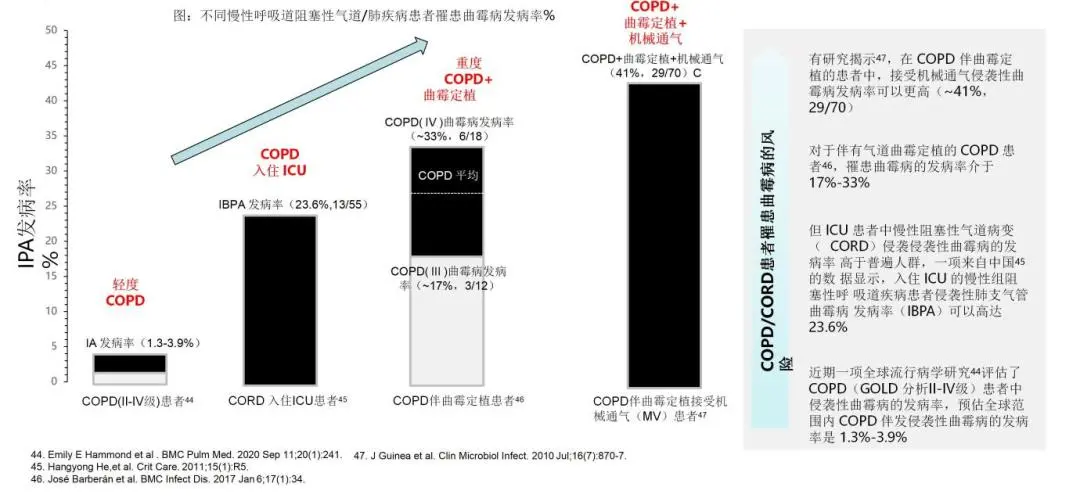
上图提示,慢性阻塞性呼吸道病变患者入住ICU和曲霉定植伴随高IPA风险。大家注意观察,它也是不完全一样的。如果是一个轻度的慢阻肺,侵袭性曲霉感染的几率不超过4%;但是如果这个慢阻肺患者住到了ICU里,侵袭性曲霉感染的风险就增加到23.6%;如果这个患者原来有曲霉定植,他患侵袭性曲霉病的机会就升高到33%左右;如果这个慢阻肺患者原来既有定植,又加上在ICU里进行了机械通气,那他的侵袭性曲霉感染的风险就增加到41%。注意看这几个百分比数字的变化,我们就知道,同样是慢阻肺,在不同情况下它出现侵袭性曲霉感染的风险是不一样的。

上图可见支气管扩张患者具有高曲霉气道定植率,其中以慢性感染和过敏最为常见。关于支气管扩张伴发曲霉病的流行病学数据我们所知相对有限。Zhuang-Gui Chen 等人的研究中记录了支气管扩张患者伴有纤毛结构损伤患者的曲霉感染率,为 15.38%(曲霉感染诊断来自于支气管活检标本组织病理结果发现菌丝结构);印度学者 Inderpaul Singh Sehgal 等人在他们的研究中纳入了 258 个由非囊性纤维化(NCF)原因导致(结核,特异性病变,等)的支气管扩张患者中对曲霉的感染率。这是通过曲霉特异性 IgE(> 0.35 kUA/L)和 IgG(>27 mgA/L)抗体检测来定义患者为过敏性病变和慢性肺曲霉病。尽管由于诊断方法的特异性问题,疾病的总体发病率可能被高估,但作者仍在研究中看到了高曲霉过敏(29.5%)和高慢性肺曲霉病(76% )发病率。这些数据告诉我们,支气管扩张患者因为伴有纤毛结构损伤,因此患者出现曲霉感染的机会也会高,至少也有15%左右。图中同样可以看到,基因测序方法在非囊性纤维化患者气道标本中,曲霉的检出率高达90%。如果患者曲霉感染的几率为15%左右,对曲霉过敏的几率只有3%,是完全不一样的。
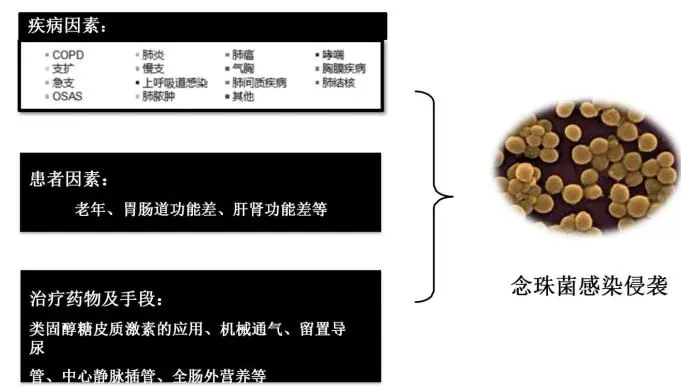
肺念珠菌感染与多方面因素相关,而非单纯的免疫因素。这说明肺念珠菌比曲霉更复杂。念珠菌的因素不仅牵涉到疾病的因素,尤其要看有哪些基础疾病,特别是肺病,还牵涉到患者因素,比如老年人、胃肠道功能差、肝肾功能差等等,还牵涉到治疗药物及手段因素,比如用激素、上呼吸机、各种导管和胃肠外营养。因此可以看到,体内念珠菌存在可以是很多种现状:
·无念珠菌定植或感染
• 念珠菌定植
– 轻度定植:住院患者比例>>>健康宿主
– 重度定植:
• ≥ 3 各部位定植,或者同一部位 2 次以上连续检出
• 几乎仅见于危重患者
• 念珠菌感染
– 念珠菌血症
• 原发性念珠菌血症
• 导管相关念珠菌血症
– 深部侵袭性感染
• 腹腔念珠菌病
• 其他部位:胸膜念珠菌病、眼内念珠菌病、念珠菌脑膜炎、念珠菌心内膜炎
从这些现状就可以知道 念珠菌感染的诊断更难,最好是既没有定植,也没有感染。这张表要注意看什么呢?念珠菌可以轻度定植,也可以重度定植。轻度的一定是住院病人、门诊病人比健康宿主远远高得多;重度定植里要注意,我们的临床医生往往只留痰培养,对于念珠菌而言一定要求「多部位取标本送检」,如果定植的部位越多,定植的程度就越重。念珠菌通常都见于危重症患者。感染主要是两大类,一大类是念珠菌血症,同样要关注的是原发的或者是导管相关的;另外一大类是深部感染,即指深部脏器感染,主要是腹腔感染,当然也可以是位于胸膜的、眼内的、脑膜的、心内膜的感染。大家看, 很少提到肺部,肺部念珠菌感染的诊断就更加困难。
区分方法二:结合患者的临床表现、影像学资料、实验室报告判定……痰、支气管肺泡灌洗、支气管毛刷、或抽吸液培养出曲霉很有意义
定植与感染区分方法之二,首先要结合患者的临床表现。这里面包括患者的症状,影像学资料,包括常规的实验室检查,来帮助我们判断培养的结果到底是定植、感染,还是污染。
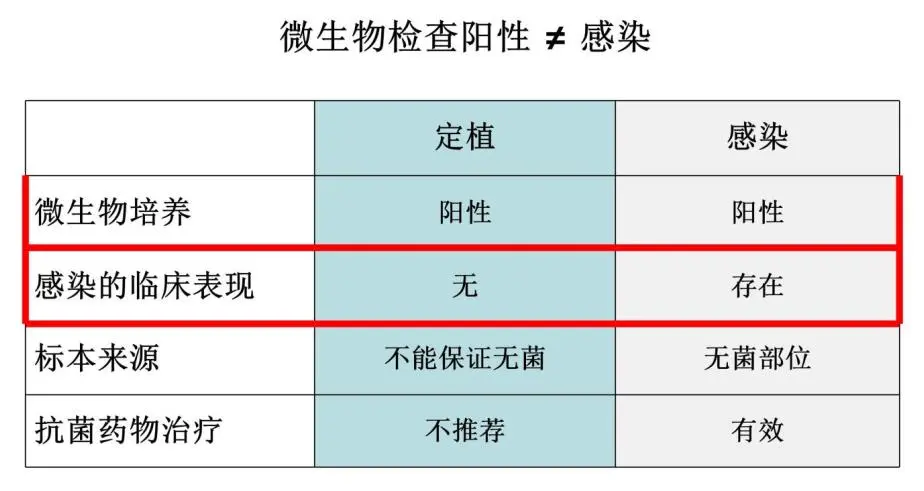
如果是定植,往往是没有临床表现的,而感染一定有临床表现。所以阳性不能把它判定为一定是感染,没症状就不是感染。
其次,从病原体分离的部位去判定:正常无菌的体腔(血液,脑脊液,胸腹水等)中一旦分离到病原体,考虑责任病原体,它是真菌的几率和准确性就要高得多。但是非无菌部位就要注意,尤其是呼吸道,它本身就是非无菌部位,一定要结合临床去判断,如果没有临床表现,没有影像学改变,没有常规实验室检查,就必须考虑它定植的几率要高得多;非无菌部位(皮肤,黏膜或创面)分离的病原体,同时结合有无临床、影像、生化以及组织病理依据,多倾向于定植。当然,如果脓液培养反复培养出同一个结果,或保护性标本,或菌落计数达到一定量,还是要倾向于考虑为感染。比如对于曲霉病的诊断,就提出了曲霉病应如何鉴别,感染如何管理?看看指南如何推荐的:
推荐: 曲霉病应如何鉴别,感染如何管理?在分子诊断工具尚未在临床实验室广泛应用之前,我们建议充分数量的组织和体液标本进行组织/细胞学和培养的同步监测。在分离得到非典型菌株或考虑耐药的案例中,需要对标本进行分子方法的鉴定(强推荐;低证据等级)。注:曲霉在多数培养集中37°C 的条件下2–5 天可以形成菌落,应选择特殊真菌培养基。然而培养的阳性率较低,且培养阴性并不能排除侵袭性曲霉病。尽管检出率低,在分子生物学方法被常规应用于实验室检查前,培养仍然是菌株复合鉴定和药敏检测中的重要手段。
支气管镜在侵袭性肺曲霉病诊断中扮演着什么角色?同样看看指南如何推荐的:
推荐:我们推荐对疑似侵袭性肺曲霉病患者给予经气管镜的支气管肺泡灌洗(BAL)(强推荐;中等证据等级)。支气管肺泡灌洗对于外周结节病灶的穿透率较低,因此,对于此类病灶应考虑给予经皮或经支气管肺活检。我们推荐标准化的BAL 采集过程,并对支气管肺泡灌洗液(BALF) 标本行非培养方法检测的同时进行常规的培养和细胞学检测(强推荐;中等证据等级)。
这就说明,即使有了分子生物学,也别忘了培养必须同步去做,特别是气管镜。除了现有的新方法比如分子生物学、宏基因组测序(mNGS)之外,如果有条件,同样强调应该同时进行气管镜标本常规的培养。
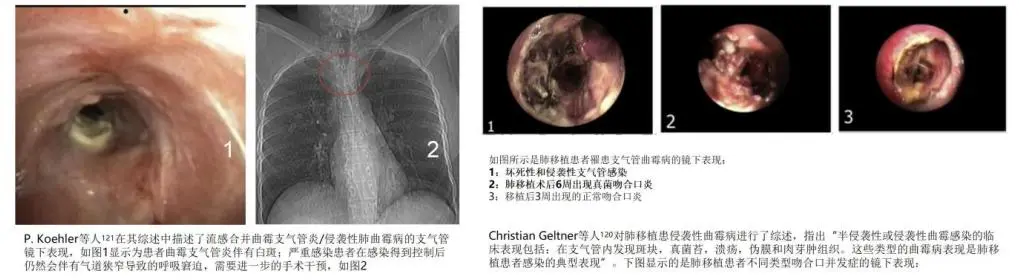
上图是支气管曲霉病纤支镜下表现。左图是Joost Wauters 等人在2012 年的一项回顾性研究报道了9 例因重症H1N1流感合并IPA 入住ICU 的患者,其中5 名患者(55%)伴有纤支镜下发现。右图是美国移植学会(AST)在2018 年发布的实体器官移植侵袭性肺曲霉病指南中指出:单肺移植,气道曲霉定植,吻合口缺血等因素是肺移植患者罹患IA 的高危因素,曲霉细支气管炎发病率约为4%-6%,镜下表现为气道阻塞,支气管溃疡和伪膜形成,吻合口感染导致缝合部位破裂。常规支气管镜子检查排除相关感染因素。
因此可以看到,支气管镜确实可以帮助我们,从这些重症患者,支气管镜一下去就可以看到一些征象来提示我们气道的局部病变是倾向于真菌定植还是感染,再去结合培养结果,就容易判断出培养阳性到底是污染、定植还是感染。

这是欧美国家两个组织分别于2019年和2021年做的研究,一个是针对普通患者,一个是针对ICU患者。这里都提到了在临床诊断当中如果痰液、支气管肺泡灌洗液、支气管毛刷或抽吸液中,培养出任何霉菌,都可以作为微生物学诊断依据。当然,如果在镜检的时候看到了真菌的成分,也可以作为微生物学诊断依据。对于曲霉而言,尤其是痰、支气管肺泡灌洗(BAL)、支气管毛刷、或抽吸液培养出曲霉很有意义。ICU里面同样,下呼吸道标本在细胞学诊断,直接镜检和/或培养发现曲霉菌属,都可以作为临床诊断的微生物学依据。
区分方法三:结合患者罹患真菌感染的临床评分判定……念珠菌评分是简单有效的方法,将每例患者所有危险系数相加即得到该患者分值
定植与感染区分方法之三,结合患者罹患真菌感染的临床评分判定。看看临床是如何评价的:
我们给出了念珠菌定植指数(colonization Index,CI)。每周两次同时送6个部位的标本进行培养,计算念珠菌定植指数(CI)和校正值(CCI)。这6个部位分别是气道分泌物或咽拭子,还有胃液、尿液、大便或肛门拭子、伤口拭子或腹部引流液。用导管插入这些部位取拭子。CI = 检出菌落部位数/ 采集标本部位(血液除外)总数;CCI = CI ×(菌落重度生长部位数/ 检出菌落生长部位数)。得出的结论可以看到,根据这些定植指数,如果CI≥0.5或者是CCI≥0.4,我们就认为你培养出来的念珠菌提示是感染而不是定植,存在有侵袭性念珠菌感染的高风险。CI到达阈值比念珠菌感染发生平均提早6天,具有较高临床预测价值,根据CI在临床进行念珠菌抢先治疗使侵袭性念珠菌感染发生率由原来的2.2%降到0%,且不增加耐药率。

同样,用念珠菌评分(CS)辅助判断念珠菌定植与感染。 我们说念珠菌评分是一种简单有效的方法,将每例患者所有危险系数相加,即得到该患者的分值。这是一项大型、前瞻性、多中心研究,纳入1699 例非中性粒细胞减少患者,其中97 例确诊侵袭性念珠菌病,每周分析念珠菌定植与潜在的危险因素。logistic 回归分析确定了4 项独立的危险因素:多病灶的念珠菌定植、外科手术、胃肠外静脉营养、严重脓毒血症。 积分以2.5 为界值,当患者个体评分>2.5 分时发生念珠菌感染的可能性是≤2.5 评分患者的7.75 倍。该方法的敏感度和特异性可达81% 和74%。危险因素分层有助于更加精确地选择出真正能在预防或经验(抢先)治疗中获益的病人。当然后来有人说,这2.5分到底怎么算?最后的研究认定,只要>2分,那么它是感染的几率就大得多,而不是定植。
那说来说去,定植到底还有意义吗?这就引出了第四个区分方法。
区分方法四:定植并非没有意义,真菌的定植具有极大的临床风险……呼吸道念珠菌大量定植是检出MDR、增加病死率的独立危险因素
定植与感染区分方法四,看定植。真菌的定植具有极大的临床风险。这句话说明就算我们认定了培养阳性判定为定植也有很大的临床意义。看看研究是如何评价的:
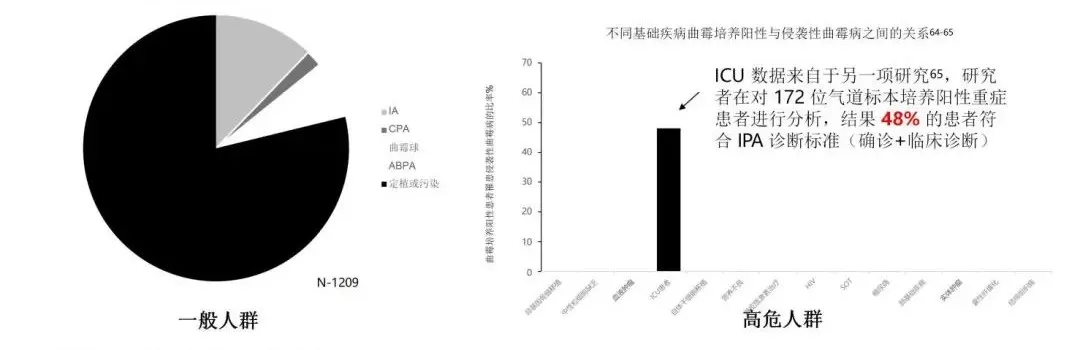
下呼吸道标本的曲霉阳性具有临床价值吗?定植vs 感染:J. R. Perfect 在2001 年发表的一项调研结果显示仅12.2%的曲霉培养阳性患者(81% 为气道标本)最终诊断为侵袭性曲霉病。但是,高危人群具有更高的诊断价值, 重症患者中曲霉分离是患者不良预后的潜在标志。
这里需要着重看什么?如果是下呼吸道曲霉培养阳性,如果在一般人群里最后观察,只有12.2%最后诊断为侵袭性曲霉感染,但如果是来自ICU的病人则完全不一样,接近一半患者后来可以确定诊断为侵袭性曲霉感染。因此,同样为曲霉阳性结果,病情的轻重、高危人群和一般人群,结论完全不一样。
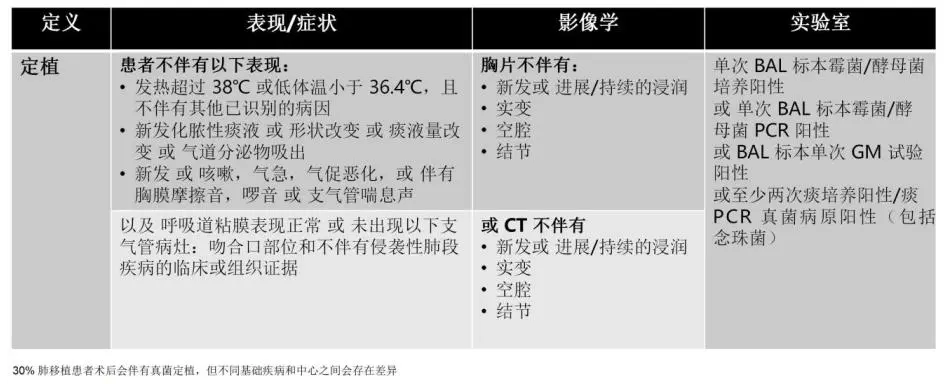
关于肺移植患者真菌定植也有其定义。我们同样可以看到,如果肺移植患者培养出来了阳性结果,他没有症状,没有影像学的改变,没有CT的变化,那么它很可能就是定植。而这时候定植同样是有意义的。
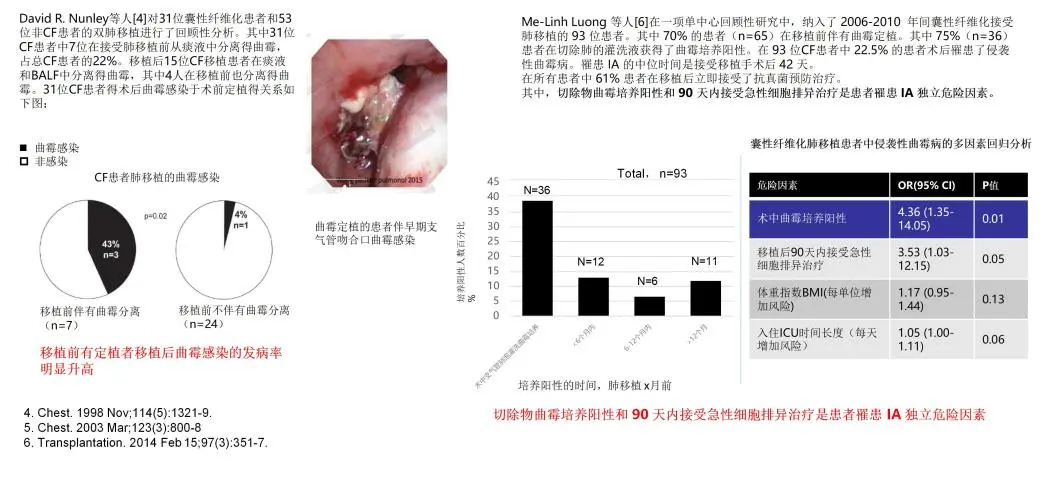
关于移植的真菌定植:移植前下气道曲霉定植的影响。如果移植前有定植,移植后可能百分之四十几会出现曲霉感染;但是移植前没有定植的,术后只有4%的患者出现曲霉感染。这是左边的第一个研究。右边第二个研究同样证实,如果切除物曲霉培养为阳性,就是相当于原来有定植,或者是3个月(90天)内接受急性细胞排异治疗,就是出现免疫抑制的话,可成为移植术后出现侵袭性曲霉感染的独立危险因素。因此,对那些重症的患者、移植的患者,即使判定为曲霉的定植,也是非常有意义的。

所以现在提出来,我们有没有必要对真菌定植进行下呼吸道的筛查?这个研究对243位良性纤维化患者进行了筛查,反复去做筛查,每个星期做2次筛查,结果发现81%的患者找到了一种真菌。其中最常见的是念珠菌,占比接近60%,其次是曲霉,也占比接近40%,还有如尖端赛多孢霉和外瓶霉等等。这说明筛查还是能帮助我们提高警惕,这些患者今后有可能出现感染。
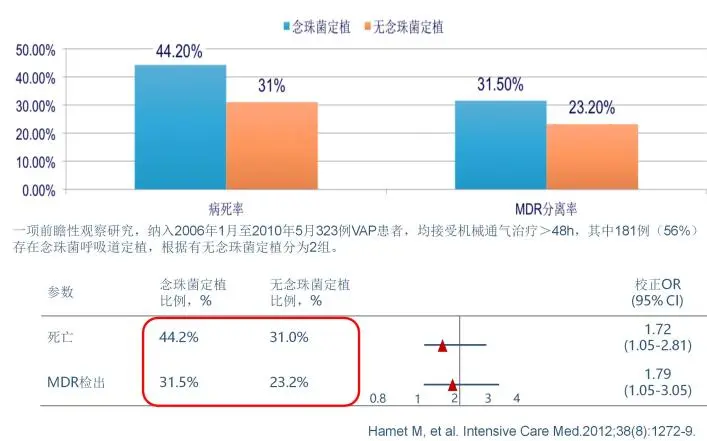
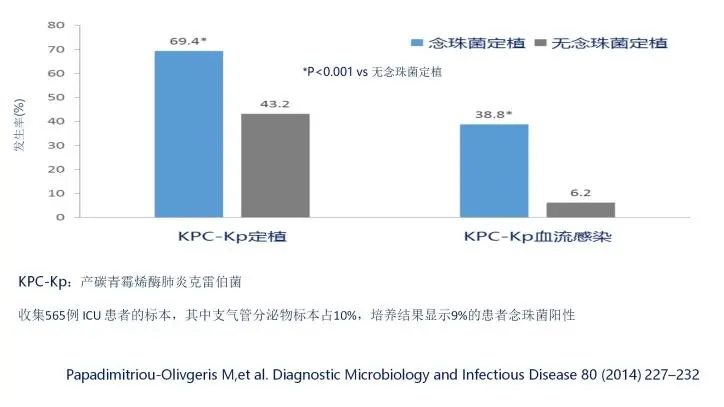
念珠菌定植的几率更高,那么它没有意义吗?也是有意义的。这项研究证实,呼吸道念珠菌大量定植是检出MDR、增加病死率的独立危险因素。即使它是定植,这个病人今后出现耐药菌感染的几率就会高,病死率就会高。
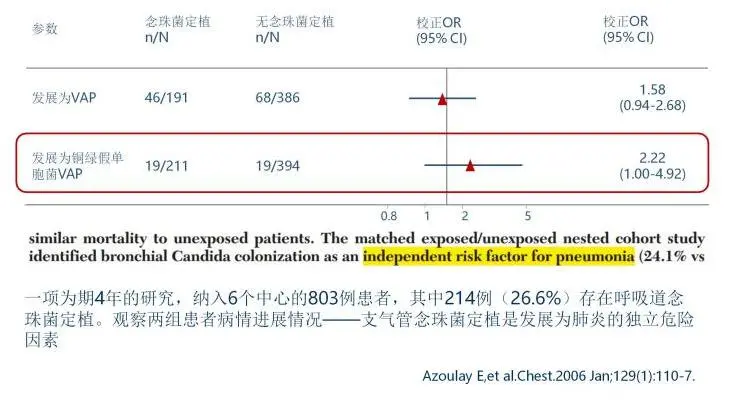
点击图片可放大查看
同样,呼吸道念珠菌大量的定植会显著增加铜绿假单胞菌呼吸机相关性肺炎(VAP) 风险。就是说会增加铜绿导致VAP的高风险,它会使耐药的肺炎克雷伯菌(特别是CRKP)的定植和血流感染的发生率高,这是因为真菌的定植可以影响细菌的理化特性和免疫反应。
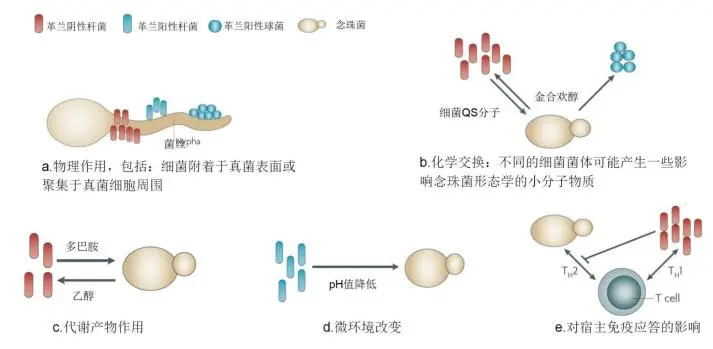
这就是其发病机制的图示。可以看到,真菌可对细菌直接或间接地在菌体生长、生理过程、菌株致病力等方面相互影响。
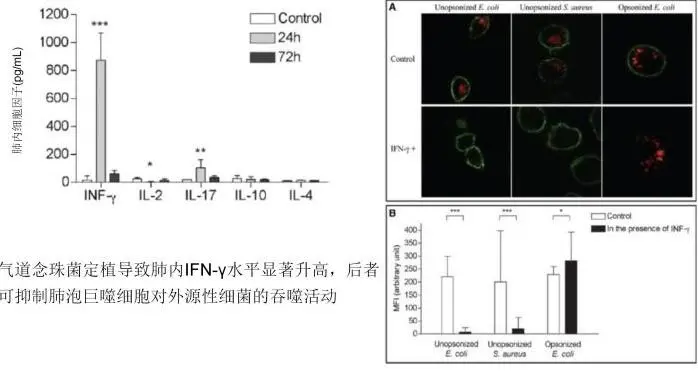
点击图片可放大查看
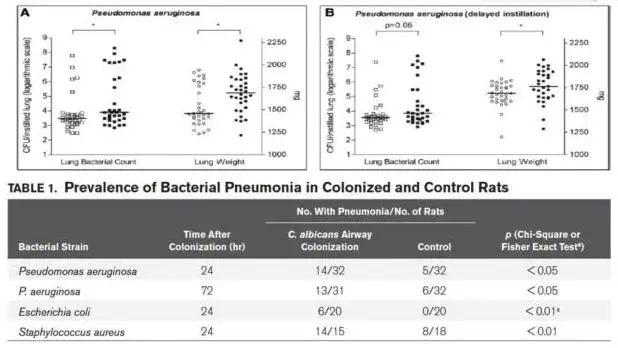
同样我们还可以看到,气道念珠菌定植抑制肺泡巨噬细胞的吞噬作用(左图),一项动物实验结果显示,气道念珠菌定植抑制免疫功能、增加细菌性肺炎风险(右图)。被抑制了免疫所以细菌性肺炎的风险就会增加。已有的案例显示:即使经过有效的抗感染治疗,曲霉仍可在VAP发生后8天在肺部分离到;铜绿假单胞菌性呼吸机相关性肺炎(VAP)的再发通常由前一次感染的PA持续存在引起。某研究显示,ICU中铜绿假单胞菌平均定植率达到34%,其中呼吸道定植率为22%,消化道定植率为12%。因此,定植和致病菌之间有非常密切的关系,即使我们认定它是定植也应该提高警惕。
区分方法五:结合患者抗真菌治疗的反应判定……免疫功能低下者如果原来有定植,出现感染,治疗反应好,也可反推是感染而非定植
定植与感染区分方法五,结合患者抗真菌治疗的反应判定。看看指南是如何评价的:
因此,在免疫功能低下的情况下,如果原来有定植,出现了感染,经过治疗反应好,也反过来推测这个时候它是感染而不是定植的。所以什么时候启动治疗,就要去看它的风险高低。
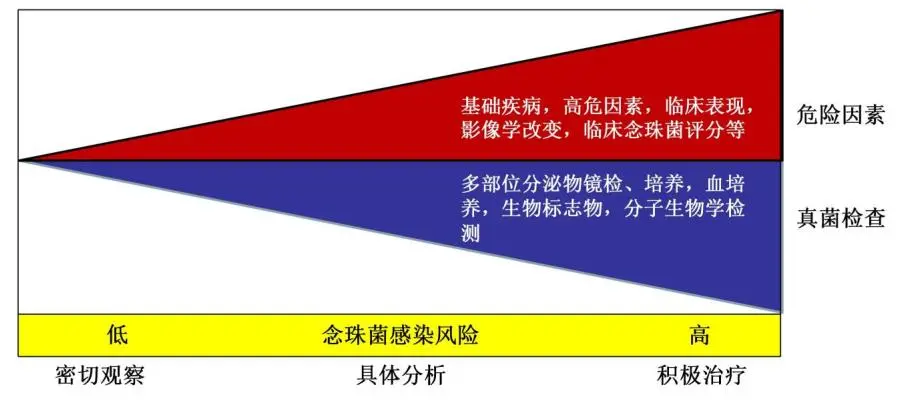
是否启动针对念珠菌经验性治疗的因素。如果基础疾病越多,高危因素越多,有临床表现,有影像学改变,评分越高,这个病人风险越高,就应该尽早地治疗;但是如果这些非常少,真菌的检查,既没有镜检阳性,又没有血培养阳性,生物标志物都不升高,就不要去治疗。所以把这两点结合起来再去评估镜检的结果,就容易对临床得出结论,到底治还是不治。
小结
污染、定植与感染区分——
> 临床医生应重视临床资料收集,正确规范采集标本、保管和运送并及时送检
> 微生物实验室医生应及时接受标本,判断是否为合格标本,及时、规范检测
> 临床与实验室加强沟通,互通有无,正确解释结果
> 综合评估,结合临床,及时、准确、正确指导临床治疗
因此,当呼吸道标本真菌培养为阳性结果时,正确的判断路径应该如下:
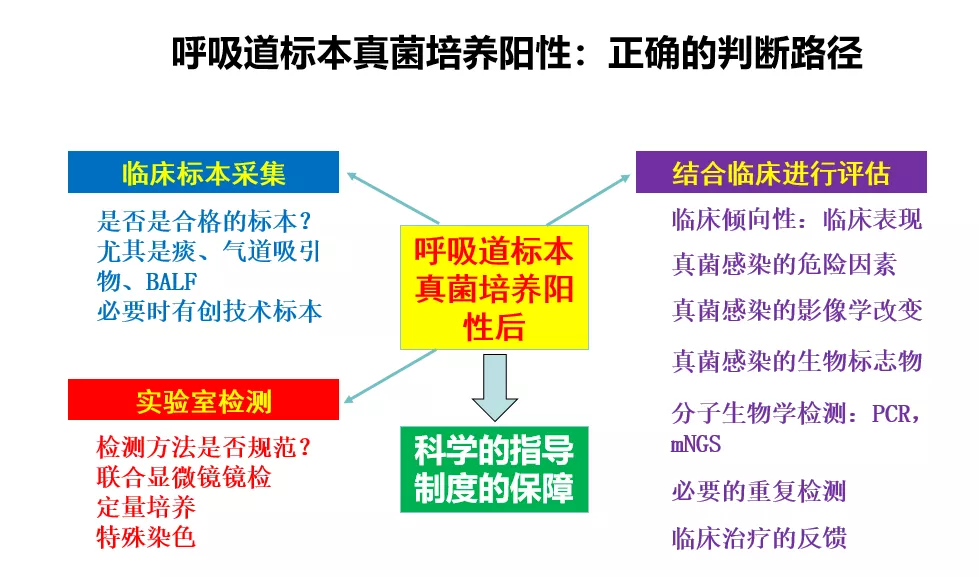
当然,即使这样做,有时我们仍会难以判断。因为角度不同,得出的结论很可能不一样。因此,一要结合临床危险因素和感染相关的临床表现;二要正确分析临床标本可靠性;三要正确解读实验室阳性结果。区分定植或感染的关键,还在于临床医生一定要加强和微生物实验室的合作和沟通,才可能得出正确结果。
参考文献
1. Matteo Bassetti et al.Mycoses. 2019 Apr;62(4):310-319.
2. Matteo Bassetti. Et al. Clin Infect Dis. 2021 Mar 12;72(Supplement_2):S121-S127.
3. J. Peter Donnelly et al.Clin Infect Dis. 2020 Sep 12;71(6):1367-1376
4. J Heart Lung Transplant. 2016 Mar;35(3):261-282
5. Infection. 2019 Oct 1. doi: 10.1007/s15010-019-01360-z
6. Emily E Hammond et al . BMC Pulm Med. 2020 Sep 11;20(1):241.
7. Hangyong He,et al. Crit Care. 2011;15(1):R5.
8. José Barberán et al. BMC Infect Dis. 2017 Jan 6;17(1):34.
9. J Guinea et al. Clin Microbiol Infect. 2010 Jul;16(7):870-7.
10. Zhuang-Gui Chen et al. J Thorac Dis. 2018 Mar;10(3):1753-1764
11. Inderpaul Singh Sehgal et al.Mycoses. 2021 Apr;64(4):412-419
12. 蔡柏蔷李龙芸主编.协和呼吸病学.中国协和医科大学出版社.2005版.
13. GowNA et al. Nat Rev Microbiol.2011 Dec 12;10(2):112-22. Garnacho-Montero J,etal. Rev EspQuimioter.2013 Jun;26(2):173-88
14. Clinical Infectious Diseases Advance Access published June 29, 2016
15. Copyright belong to Oxford journals ,Forbidden for any business purpose
16. Joost Wauters. Intensive Care Med. 2012 Nov;38(11):1761-8.
17. Shahid Husain. Clin Transplant. 2019 Sep;33(9):e13544.
18. Christian Geltner,et al. Respir Investig. 2016 Mar;54(2):76-84
19. P. Koehler et al.Clin Microbiol Infect. 2019 Dec;25(12):1501-1509.
20. Intensive Care Med. 2014 Oct;40(10):1429-48.
21. León C et al. Crit Care Med.2006 Mar;34(3):730-737.
22. J R Perfect et al.Clin Infect Dis. 2001 Dec 1;33(11):1824-33
23. Faisal Khasawneh et al.J Crit Care. 2006 Dec;21(4):322-7.
24. J Heart Lung Transplant. 2011 Apr;30(4):361-74
25. Chest. 1998 Nov;114(5):1321-9.
26. Chest. 2003 Mar;123(3):800-8
27. Transplantation. 2014 Feb 15;97(3):351-7.
28. Mycopathologia. 2018 Feb;183(1):101-117
29. Hamet M, et al. Intensive Care Med.2012;38(8):1272-9.
30. AzoulayE,etal.Chest.2006Jan;129(1):110-7.
31. Papadimitriou-Olivgeris M,et al. Diagnostic Microbiology and Infectious Disease 80 (2014) 227–232
32. Peleg AY,et al.Nat Rev Microbiol.2010 May;8(5):340-9.
33. Roux D et al.Crit Care Med 2013;41:e191–e199
34. Chest 2011;139;909-919
专家介绍

施毅
南京大学医学院附属金陵医院呼吸与危重症医学科 教授、主任医师、博士生导师、博士后导师;美国胸科医师学会资深会员;江苏省医学会呼吸病学分会第七、八届主任委员;中国医药教育学会感染疾病专业委员会常委;中国医药教育学会真菌病专业委员会常委;中国老年医学会呼吸病学分会常委兼感染学术委员会主任委员。
本文由《呼吸界》编辑 冬雪凝 整理,感谢施毅教授的审阅修改!
本文完
排版:Jerry


