53岁男性患者,无诱因呼吸困难,活动后加重,急诊收入院。经纠酸、CRRT、抗休克、抗感染等治疗后病情无缓解,最终因ARDS恶化、多器官功能衰竭而死亡。导致患者发病的原因究竟为何?此病例给我们带来哪些临床启示?
人体内的乳酸(lactic acid,Lac)源于葡萄糖和糖元的酵解过程。正常生理状态下,乳酸的基础生成和代谢处于平衡状态,血乳酸浓度<1.7 mmol/L。但是乳酸大量存在时,会导致人体内环境稳态的丧失,尤其是固有的酸碱平衡将被打破,轻则代谢紊乱,重则危及生命。高乳酸血症是指由于乳酸生成过多或利用/清除障碍导致血乳酸浓度>2 mmol/L。乳酸酸中毒(lactic acidosis,LA)则是指血乳酸浓度持续增高(一般>5 mmol/L),伴有明显酸中毒证据:pH<7.35,HCO3-<20 mmol/L,AG>18 mmol/L,排除酮症酸中毒、肾衰竭等即可诊断。LA的原因较多,危害严重,如何快速识别其发生原因并及时治疗是影响其预后的重要因素。本文就1例苯乙双胍过量所致LA进行报道,并结合文献对LA的诊治思路进行分析。
临床资料
患者,男,52岁。因「进食减少伴呕吐、腹部隐痛4个月,呼吸困难1天」于2015年4月24日入院。患者2015年1月始无明显诱因出现进食减少,伴乏力、厌油腻、恶心等,偶有腹部脐周隐痛,无发热、咳痰、腹泻等,未诊治。2015年4月5日左右出现进食后反复呕吐,4月12日入住北京某医院。入院当天查血常规正常;凝血功能正常,血清K+ 5.4 mmol/L;ECO2 14.1 mmol/L,Cr 67 μmol/L。4月17日查K+ 4.34 mmol/L;ECO2 12.7 mmol/L;胃镜检查提示贲门炎。经抑酸、补液等治疗未愈出院。4月21日于服用中药治疗。4月23日无诱因出现呼吸困难,活动后加重,伴全身肌肉酸痛,无发热、咳痰等,至中日友好医院急诊科就诊。
既往史:2型糖尿病16年,近10年服用个体诊所自制降糖胶囊(成分不详),监测空腹血糖约7 mmol/L,餐后2小时血糖约10 mmol/L,曾发生一次低血糖。发现丙肝抗体阳性10天,未诊治。14年前因外伤行左股骨骨折内固定术,术中有输血史。否认高血压、冠心病、脑梗死等疾病。
急诊查体
神志清,呼吸深大,口中无明显烂苹果味。体温36℃,脉搏103次/分,呼吸27次/分,血压97/56 mmHg,SpO2 89%。双肺呼吸音粗,可闻及散在湿啰音。心律齐。腹软,全腹轻度压痛,无反跳痛。双下肢无水肿。
急诊辅助检查:先后5次ABG(4月23日16时至4月24日6时,面罩吸氧5 L/min):pH<6.8~7.0,PCO2 12~22 mmHg,PO2 67~167 mmHg,BE<28.3 mmol/L甚至测不出,HCO3-<3 mmol/L甚至测不出,Lac>15 mmol/L。尿常规:酮体4 mmol/L(正常<1),尿糖17 mmol/L(正常<2.8 mmol/L)。查血:白细胞18.4×10^9/L,中性粒细胞90.4%,血红蛋白120 g/L,血小板143×10^9/L;AST 333 IU/L,AST 595 IU/L;Cr 72.5 μmol/L;CK 36 900 IU/L,TnI 0.29 ng/ml;AMY 253 IU/L;GLU 14.2 mmol/L(最高值)。PT 18 秒,APTT 135秒,TT 23.7秒。胸部CT提示双下肺纹理增粗伴少许条片状渗出实变影,双侧少量胸腔积液(图1)。
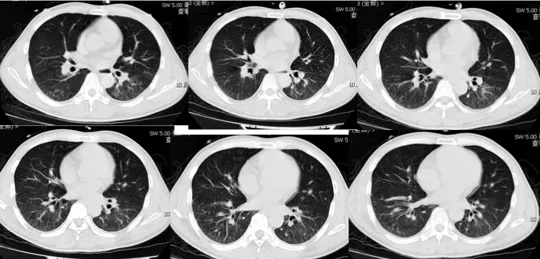
图1:2015年4月23日胸部CT
急诊给予中心静脉置管,补液(CVP 16 cmH2O,16小时总量3800 ml);多巴胺升压[入ICU前1小时血压82/38 mmHg,多巴胺8.3 μg/(kg·min)泵入] ;纠酸(共给予碳酸氢钠750 ml);抗感染(应用亚胺培南西司他汀钠);补充凝血因子(血浆400 ml)。留置尿管12小时无尿。
4月22日转入ICU查体
体温36.0℃,脉搏86次/分,呼吸28次/分,血压84/48 mmHg [多巴胺以12.5 μg/(kg·min)泵入情况下]。神志清楚,表情淡漠,被动体位。左眼失明,右瞳孔直径4 mm,对光反射迟钝。双下肺少量湿啰音。心脏检查未见异常。腹软,肠鸣音低弱,3次/分。四肢肌力Ⅱ级,双侧对称,双巴氏征阴性。
4月24日上午给予
①纠酸:碳酸氢钠500 ml;
②CRRT置管(模式为CVVH);
③纠正休克:补液(复方氯化钠2000 ml+白蛋白30 g+血浆400 ml);
④升压 [去甲肾上腺素升压0.5 μg/(kg·min)];
⑤抗感染:亚胺培南西司他汀钠+万古霉素;气管插管机械通气(11:30时SpO2下降至85%,呼吸13次/分),呼吸机管道内大量血性分泌物;
⑥其他对症治疗:补充凝血因子、红细胞,抑酸、保肝、营养心肌等。
14:00复查ABG(表1),患者pH及Lac无显著改善,持续休克状态。测中心静脉压为30 cmH2O,考虑肺水肿,减慢补液速度(由约1000 ml/h降至150 ml/h)。14:50将CRRT模式由CVVH改为CVVHD。18:00复查ABG,血乳酸水平明显降低,pH、HCO3-、BE明显回升(表1)。18:00行PICCO,数值如表2。22:00复查胸片提示双肺弥漫性渗出影较前有所吸收(图2)。4月24日持续CVVHD(20小时总入量6325 ml,尿量30 ml,除水1300 ml)。
表1:患者入住ICU期间ABG监测数值
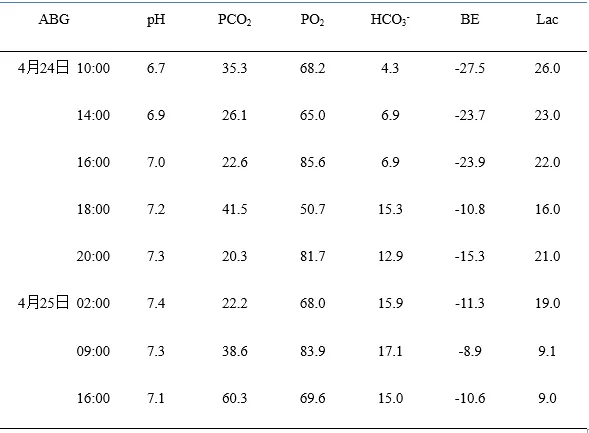
表2:患者入住ICU期间PICCO监测数值
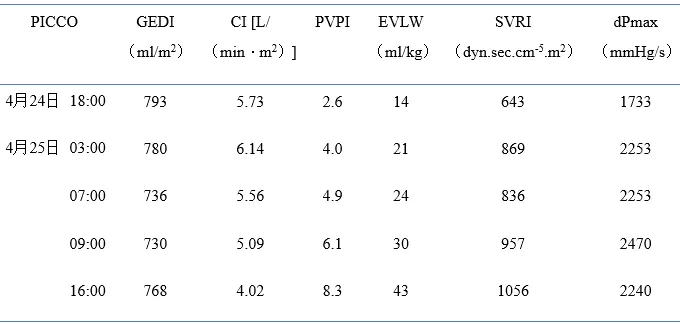
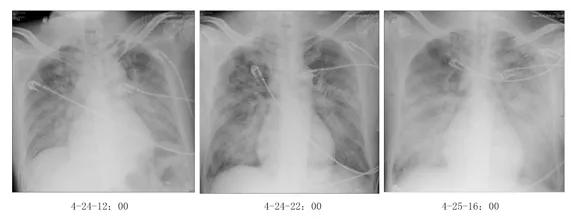
图2:2015年4月24日和25日患者入ICU后胸片
4月25日仍持续CVVHD,患者血乳酸水平进一步降低,pH、HCO3-、BE进一步回升(表2),但氧合指数进行性下降,PCO2上升,行肺复张无效。血管活性药物支持下血压难以维持。行血浆置换一次。复查床边胸片提示双肺弥漫性渗出液范围较前明显扩大(图2)。床旁肺超声提示肺实变明显(图3)。患者于16:47死亡。
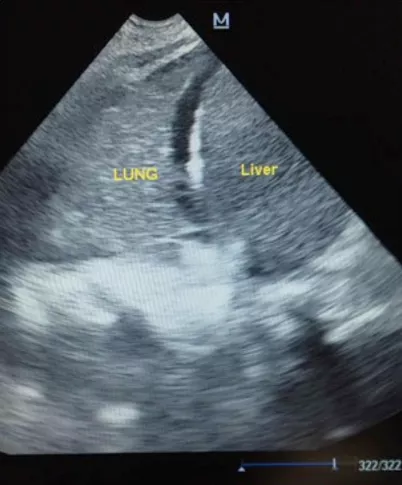
图3:2015年4月25日患者床旁超声
4月30日在送检血液中检测到苯乙双胍(浓度为0.1 μg/ml)、格列本脲(浓度为0.2 μg/ml)、甲氧氯普胺、西司他汀。
乳酸酸中毒是一种代谢性酸中毒,其特征是血液中乳酸浓度>5 mmol/L,pH<7.3或HCO3-浓度<20 mmol/L。一般为糖尿病等代谢性疾病的并发症,也可以为药物(如抗病毒药物)的不良反应。病死率极高,一旦发生需及时处理。对于重度乳酸酸中毒的病因识别和治疗尤为重要,有助于改善患者预后。
乳酸是糖酵解过程中肌细胞能量释放和ATP合成的伴随产物。在糖酵解过程中,葡萄糖通过还原型辅酶I(reduced form of nicotinamide-adenine dinucleotid,NADH)分解产生丙酮酸,丙酮酸在乳酸脱氢酶(lactate dehydrogenase,LDH)的催化下转化为乳酸。简单来说,乳酸产生和代谢的途径为丙酮酸+NADH+H+←→乳酸+NAD++2H。
乳酸的代谢主要有4个途径:①在氧气充足时,骨骼肌、心肌等组织细胞摄取血液中的乳酸,通过LDH将乳酸转变成丙酮酸,在线粒体被彻底氧化分解,生成CO2和H2O;②运动时,肌乳酸大量产生并进入血液,经糖异生途径生成葡萄糖和糖元;③在肝细胞中,乳酸经由丙酮酸、乙酰辅酶A途径转变为脂肪酸、胆固醇、酮体和乙酸等物质;④随尿液和汗液直接排出。其代谢场所肝脏占60%,肾脏30%,肌肉10%。
正常生理状态下,细胞内的糖分解速度较慢,生成少量乳酸,其生成和代谢处于平衡状态,血乳酸水平维持在<1.7 mmmol/L的水平。在此过程中,任何使丙酮酸生成过多、乳酸利用/清除障碍、线粒体功能障碍、丙酮酸脱氢酶缺乏、氧供应不足的病理状态均可导致LA(图4)。在LA时,细胞处于极度酸性的环境中,会导致心脏收缩功能下降,心排血量、血压降低,组织灌注不足,心律失常风险增加,并减弱心血管系统对儿茶酚胺的反应性。
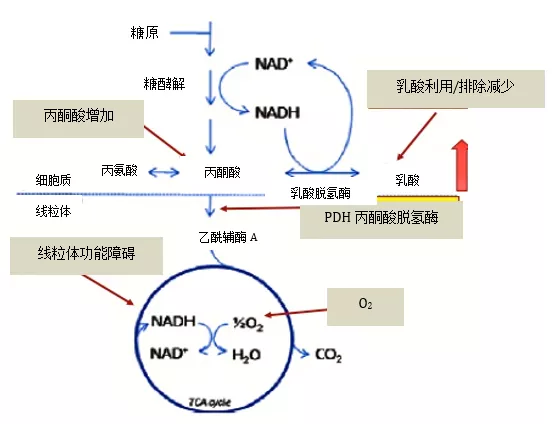
图4:乳酸增高主要因素示意图
LA的原因较多,主要分为两类(表3)[1]:与组织缺氧相关和无关。在目前所报道的病例中,以心源性和低血容量性休克、严重的心功能不全、创伤和脓毒症所致的最为多见[2]。
表3:乳酸酸中毒病因

需要注意的是在LA的定义中,pH<7.35、HCO3-<20 mmol/L、AG>18,这三个要点可能并不同时符合。如LA合并呼吸性碱中毒会增加血pH,而合并代谢性碱中毒可能造成HCO3-升高和碱血症。与此相反,合并呼吸性酸中毒时可能导致更严重的酸血症。AG正常也不能排除LA,有研究发现在乳酸水平为5~10 mmol/L的患者中,约50%的患者AG并没有升高[3]。
LA治疗原则包括:①存在组织灌注不足时,充分液体复苏;②纠正酸中毒;③维持呼吸及循环功能稳定。给予充分氧疗,必要时机械通气支持,维持血压;④肾脏替代治疗(continuous renal replacement therapy,CRRT);⑤器官功能维护及支持治疗,控制感染,降低氧耗;⑥积极寻找病因,阻断致病源头,如及时清除LA相关的过量药物毒物等。治疗流程见图5。
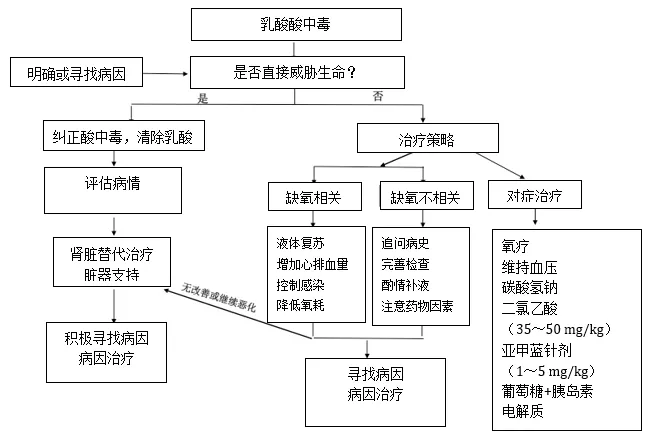
图5:乳酸酸中毒诊治思路
在液体复苏方面,胶体及晶体均可依需要选择。胶体以白蛋白为首选,因羟乙基淀粉可能增加急性肾损伤(acute kidney injury,AKI)风险。选择晶体时,推荐含有碳酸氢盐或其前体的溶液,如乳酸林格氏液、含醋酸盐和葡萄糖酸盐的血浆电解质液作为首选,因其不会造成非AG型酸中毒,并可降低AKI风险,但需警惕其可能造成代谢性碱中毒[4]。过多地给予生理盐水可能造成或加剧非AG型酸中毒[5],降低血钙浓度从而抑制心脏功能。含氯液可能增加AKI风险[4]。
在纠正酸中毒的药物选择方面,碳酸氢盐的应用在降低病死率及改善血流动力学方面仍是有争议的[1]。目前关于碳酸氢钠使用的共识是除非它可能逆转酸中毒带来的危害,否则碳酸氢钠的使用也许并不能获益[6],而可能获益的前提是充分的通气以保证O2的足够供应及CO2被及时清除[7]。针对LA来说,脓毒症生存指南[8]推荐对于灌注不足的患者pH<7.15时,可给予碳酸氢钠;也有其他学者推荐以pH≤7.0为使用碳酸氢钠的分界[9]。另外可以给予二氯乙酸,其可以刺激线粒体中丙酮酸脱氢酶(PDH)的活性以减少乳酸生成[10],并可以通过增加心肌细胞对葡萄糖的利用和产生高能量磷酸盐从而增加心肌收缩力。
关于CRRT在LA治疗中的作用尚存争议。有小型的观察性研究在给予碳酸氢盐方案的基础上应用CRRT,认为其对血流动力学不稳定的严重A型LA是有效的[11]。在B型LA中,如二甲双胍[12,13]、苯乙双胍[14]相关性LA中,应用CRRT治疗的成功案例报道也较多。对于血流动力学不稳定的二甲双胍相关性LA患者,早期应用CRRT是安全有效的,值得推广[13],但对于CRRT方式的选择(CVVH或CVVDH)尚需进一步的观察研究。与传统的间断性透析治疗和碳酸氢盐治疗方案相比,CRRT可能有以下几点优势:①以前稀释的方法给予碳酸氢盐(或等量的柠檬酸盐),同时进行超滤,可以避免液体过负荷;②在体外的循环中滴定式给予碳酸氢盐,较传统静脉输液法更好;③能更好地维持血钙浓度;④在药物或毒物相关的LA中,CRRT在纠正酸中毒和清除过量药物方面的作用是较确切的。
逆转录酶抑制剂所致的LA缘于线粒体毒性所致的丙酮酸氧化障碍和乳酸累积,阻断病因是最重要的治疗措施。核黄素、硫胺素、左旋肉碱,此类改善线粒体功能的药物研究正在进行之中。成功案例的治疗要点包括静脉给予碳酸氢盐、机械通气和CRRT[15,16]。
双胍类口服降糖药物(苯乙双胍、二甲双胍)是治疗2型糖尿病的一线用药,因其抑制肝脏糖异生(即抑制乳酸转化为糖),可起到降糖作用,但也会导致乳酸堆积。苯乙双胍也因此而退出了糖尿病治疗的历史舞台。2006年和2010年salpeter对二甲双胍的荟萃分析[17]和系统分析[18]均显示,服用二甲双胍患者LA的发生率反而低于未服用二甲双胍患者。说明治疗剂量的二甲双胍本身并不会导致乳酸水平升高。二甲双胍相关的LA,特别是致命性病例,更多与自身的潜在状况相关,而不是与二甲双胍直接相关。使用二甲双胍发生LA的危险因素主要包括:①肾衰竭,导致二甲双胍蓄积,乳酸产生增加,同时肾脏对乳酸及氢离子排泄障碍。肾功能不全者(男性Cr>1.5 mg/dl、女性Cr>1.4 mg/dl)禁用;②肝功能受损:肝脏对乳酸代谢(糖异生)受限,造成乳酸堆积;③组织缺氧:心衰、脓毒血症;④老年人:心肾功能逐渐减退,具有潜在危险性;⑤其他:酗酒、药物(单次超量服用,其他药物相互作用)。
根据本例患者初入院数次ABG结果,并排除肾衰竭和酮症酸中毒,LA诊断是成立的。入院已存在严重酸中毒,血流动力学状态不稳定,有组织灌注不足证据,危及生命。患者有长期服用不明成分降糖药物史,而双胍类药物所致LA的报道也屡见不鲜,所以,我们及时送检了药物毒物检测,结果也证实了我们的猜测。同时,根据PICCO结果,患者肺血管通透性显著增加,循环系统呈高排低阻型,其LA的类型应为B型。治疗方面,虽然我们第一时间给予了充分的液体复苏、予碳酸氢钠纠正酸中毒,各系统器官对症及支持治疗,但治疗反应并不理想。其原因可能与患者氧合不佳有关(于转入2小时后行气管插管机械通气)。在给予CRRT治疗,尤其是改为CVVHD模式约2小时后,患者乳酸清除速度迅速增快,血乳酸水平明显降低,pH、HCO3-、BE显著回升。这可能与氧合的暂时改善和CVVHD及时清除过量的苯乙双胍有关。但患者终因ARDS恶化,心脏、肝脏、肾脏、胰腺等多器官功能衰竭而未能避免死亡结局。
从本病例中,我们可以总结对此类重度LA患者,早期给予机械通气改善氧合是治疗的基础,有益于及时改善组织灌注,并可能增加碳酸氢钠类药物纠酸效果。在伴有组织灌注不足的LA,增加组织灌注相比降低乳酸是更重要的治疗要点。对高度怀疑B型原因存在的LA患者,除及时送检药物毒物检测外,早期及时的CRRT治疗可能有益于早期清除病源,增快乳酸清除速度,改善内环境。
参考文献
[1] Kraut J A, Madias N E. Lactic acidosis[J]. N Engl J Med, 2014, 371(24):2309-2319.
[2] Jung B, Rimmele T, Le Goff C, et al. Severe metabolic or mixed acidemia on intensive care unit admission: incidence, prognosis and administration of buffer therapy. A prospective, multiple-center study[J]. Crit Care, 2011, 15:R238.
[3] Iberti T J, Leibowitz A B, Papadakos P J, et al. Low sensitivity of the anion gap as a screen to detect hyperlactatemia in critically ill patients[J]. Crit Care Med, 1990, 18(3):275-277.
[4] Gennari F J. Intravenous fluid therapy: saline versus mixed electrolyte and organic anion solutions[J]. Am J Kidney Dis, 2013, 62(1):20-22.
[5] O'Dell E, Tibby S M, Durward A, et al. Hyperchloremia is the dominant cause of metabolic acidosis in the postresuscitation phase of pediatric meningococcal sepsis[J]. Crit Care Med, 2007, 35(10):2390-2394.
[6] Sabatini S, Kurtzman N A. Bicarbonate therapy in severe metabolic acidosis[J]. J Am Soc Nephrol, 2009, 20(4):692-695.
[7] Kallet R H, Liu K, Tang J. Management of acidosis during lung-protective ventilation in acute respiratory distress syndrome[J]. Respir Care Clin N Am, 2003, 9(4):437-456.
[8] Dellinger R P, Levy M M, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012[J]. Crit Care Med, 2013, 41(2):580-637.
[9] Boyd J H, Walley K R. Is there a role for sodium bicarbonate in treating lactic acidosis from shock?[J]. Curr Opin Crit Care, 2008, 14(4):379-383.
[10] Stacpoole P W, Harman E M, Curry S H, et al. Treatment of lactic acidosis with dichloroacetate[J]. N Engl J Med, 1983, 309(7):390-396.
[11] Baldwin I, Naka T, Koch B, et al. A pilot randomised controlled comparison of continuous veno-venous haemofiltration and extended daily dialysis with filtration: effect on small solutes and acid-base balance[J]. Intensive Care Med, 2007, 33(5):830-835.
[12] Kalantar-Zadeh K, Uppot R N, Lewandrowski K B. Case records of the Massachusetts General Hospital. Case 23-2013. A 54-year-old woman with abdominal pain, vomiting, and confusion[J]. N Engl J Med, 2013, 369(4):374-382.
[13] Keller G, Cour M, Hernu R, et al. Management of metformin-associated lactic acidosis by continuous renal replacement therapy[J]. PLoS One, 2011, 6(8):e23200.
[14] Mariano F, Benzi L, Cecchetti P, et al. Efficacy of continuous venovenous haemofiltration (CVVH) in the treatment of severe phenformin-induced lactic acidosis[J]. Nephrol Dial Transplant, 1998, 13(4):1012-1015.
[15] Chodock R, Mylonakis E, Shemin D, et al. Survival of a human immunodeficiency patient with nucleoside-induced lactic acidosis--role of haemodialysis treatment[J]. Nephrol Dial Transplant, 1999, 14(10):2484-2486.
[16] Roy P M, Gouello J P, Pennison-Besnier I, et al. Severe lactic acidosis induced by nucleoside analogues in an HIV-infected man[J]. Ann Emerg Med, 1999, 34(2):282-284.
[17] Salpeter S, Greyber E, Pasternak G, et al. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus[J]. Cochrane Database Syst Rev, 2006(1):CD002967.
[18] Salpeter S R, Greyber E, Pasternak G A, et al. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus[J]. Cochrane Database Syst Rev, 2010(1):CD002967.
作者:耿爽 - 武汉市中心医院呼吸内科;黄絮、李敏、詹庆元 - 中日友好医院呼吸与危重症医学科
本文转载自订阅号「重症肺言」
本文完
排版:Jerry


