摘要
近年来关于流感相关性肺曲霉病(IAPA)的报道逐年增加,延迟诊治是导致其病死率居高不下的重要原因。为增强临床医生对IAPA的认识,提高对IAPA的诊治能力,本文对IAPA的流行病学特点、危险因素、诊断及治疗方法进行系统总结并对未来该领域研究方向进行展望。
虽然大多数轻症流感被认为是自限性疾病,全球每年仍有约29万~65万人死于流感[1]。总体而言,流感患者的病死率约5%,但ICU中重症流感患者病死率可高达20%~25%[2],而流感继发感染则是造成患者死亡的主要原因之一。有研究显示[3],重症流感继发细菌感染的比例达30.3%,其病死率则高达50%,其中以肺炎链球菌、金黄色葡萄球菌较为常见。近年来,真菌也成为重要的继发感染病原体。一项纳入2 901例重症流感继发感染患者的观察性研究显示[4],曲霉是继肺炎链球菌、铜绿假单胞菌与金黄色葡萄球菌之后的第四大常见病原。
流感相关性肺曲霉病(influenza-associated pulmonary aspergillosis,IAPA)虽然早在1952年即被第一次报道[5] ,但后续仅为散在个案报道。直至2010年,尽管IAPA的患者剧增,但相关高质量的大型研究仍较少[6] 。重症IAPA的定义为重症或危重症流感病毒性肺炎患者于流感确诊后3周内诊断为侵袭性肺曲霉病(invasive pulmonary aspergillosis,IPA)[6] ,其病死率高达51%,明显高于单纯重症流感患者的病死率(约28%)[7] 。相比继发细菌感染,目前临床医生对IAPA缺乏意识,导致诊断及后续抗真菌治疗的延误,严重影响预后。
一、IAPA的流行病学与危险因素
(一)IAPA的流行病学
近年来,多项研究揭示了重症流感患者易继发曲霉感染。Beumer等[8]在对荷兰两家教学医院199例流感患者继发感染的回顾性研究中发现,入住ICU的45例患者中烟曲霉感染者占17.8%。2018年,Schauwvlieghe等[7]纳入比利时和荷兰7家医院432例重症流感患者的回顾性队列研究结果提示IAPA的发生率为19%,而病死率高达51%。另有部分小型的研究报道IAPA的发病率波动于23%~31%[9, 10, 11]。近期加拿大的一项研究表明IAPA发病率为7.2%[12],明显低于之前多项研究;究其原因发现IAPA的发病率在5个流感季中存在较大差异,2014—2018年发病率为0~5.3%,而2018—2019年发病率则为23.1%,因此IAPA的发病率可能因流感季不同而不同。我院2017—2019年两个流感季132例重症流感病毒性肺炎患者中IAPA的发病率为31%,其中2017—2018年发病率为28.1%,而2018—2019年发病率为33.8%[9]。IAPA的病死率可达45%~61%[10, 11,13, 14],我国关于IAPA的大型研究不多。其中,Huang等[9]报道的IAPA病死率为58.5%;而在中国台湾的一项回顾性队列研究[13]中IAPA患者的病死率则高达66.7%,明显高于合并其他感染及未合并感染的患者(66.7% vs 23.7% vs 15.4%,P<0.001)。总体而言,IAPA的发病率及病死率均较高,但可能因地域、时间及诊断方法不同存在一定差异。一项关于重症流感合并IPA的国际调查结果[15]表明欧洲以外地区可能广泛存在IAPA诊断意识不足的问题。
(二)IAPA的危险因素
1、流感病毒感染:早年间,Rodriguez-Goncer等[16]对2012—2016年英国一家三级护理中心接受体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)的134例患者进行的回顾性队列研究中揭示甲型流感病毒感染是IPA发生的独立危险因素(HR=11.4)。随后,Cavayas等[17]纳入了体外生命支持组织(extracorporeal life support organization,ELSO)数据库中2 129例接受ECMO的患者并探究其合并真菌感染的危险因素,亦发现流感是IPA的危险因素(OR=2.48)。Schauwvlieghe等[7]发现流感病毒感染(OR=5.2)与高龄、男性、高APACHE Ⅱ(acute physiology and chronic health evaluation scoring system Ⅱ)评分共同作为IPA的独立危险因素,流感的存在使IPA的发病风险从5%增加到14%。从流感病毒亚型来看,英文文献报道的IAPA病例中甲型流感病毒占87%[6]。现有证据表明乙型流感病毒同样会引起严重的混合感染,重症乙型流感合并肺曲霉病的病例并不少见[18, 19]。因此,无论是甲型流感病毒还是乙型流感病毒都有继发曲霉感染的可能,目前报道的甲型流感病毒继发曲霉感染的病例更多(约87%)[6,20],但甲型流感病毒是否比乙型流感病毒对曲霉易感仍待进一步研究。
2、糖皮质激素:最近的一项研究表明[21],在ARDS亚组中,早期低~中等剂量糖皮质激素可改善预后。然而有证据表明,糖皮质激素的使用与甲型H1N1流感病毒载量下降速度延缓相关,可增加死亡风险[22, 23, 24];此外,多项研究[7,10, 11]表明存在糖皮质激素应用史的重症流感患者易合并IPA。Watures等[11]在40例H1N1重症流感患者的回顾性队列研究中指出入ICU前7天内氢化可的松累积剂量达800 mg是IAPA发生的危险因素。Schauwvlieghe等[7]进行的一项多中心、大样本量回顾性队列研究亦支持上述结论,即入ICU前4周内泼尼松≥0.1 mg·kg⁻¹·d⁻¹与IAPA的发生密切相关。因此,不推荐在重症流感病毒性肺炎合并ARDS的患者中常规应用糖皮质激素。
3、合并基础病:重症流感合并其他影响患者免疫状态的基础疾病也可能增加IAPA的风险。截至2018年6月,英文文献报道的IAPA病例共128例,仅28%患者既往身体健康,大多数患者都存在影响免疫状态的基础疾病如自身免疫病应用免疫抑制剂(32例,25%)、血液系统恶性肿瘤(19例,15%)、糖尿病(19例,15%)、中性粒细胞减少(12例,9%)、慢性阻塞性肺疾病(10例,8%)等[6]。
Huang等[9]通过多因素Logistic分析纳入IAPA发生的独立危险因素首次制定了可以早期识别IAPA的Asper-Press模型,该模型共包括:28 d内激素累计用量达200 mg(2分),听诊闻及干啰音(2分),难治性发热>3 d(1分),CD4+T 细胞计数<200/μl(1分),入ICU 3 d内需肾脏替代治疗(1分),胸部CT多发结节影(2分),晕征(2分),其中评分≥4分,患IAPA危险程度越高。
二、IAPA的发病机制
目前关于IAPA的发病机制并不十分明确,可能的发病机制如下。
第一,流感病毒破坏呼吸道防御屏障。在流感病毒合并细菌感染的研究中[25]发现流感病毒会对呼吸道上皮造成损害,干扰纤毛黏液系统的清除作用,使患者对细菌、真菌等其他病原体易感。另外,研究结果[26]显示甲型流感病毒可引起肺泡上皮细胞-内皮细胞屏障受损,严重时可导致坏死性肺炎,使肺部成为真菌定植和菌丝生长的理想培养基。
第二,流感病毒破坏机体免疫功能。流感病毒病毒可导致天然免疫及细胞免疫功能的破坏,具体表现为:(1)流感病毒抑制肺泡巨噬细胞吞噬功能,影响患者天然免疫功能;(2)流感病毒引起外周血淋巴细胞减少,进而引起CD4+的T淋巴细胞降低,影响患者细胞免疫功能;(3)流感病毒通过影响炎症因子分泌可能使机体处于“免疫麻痹状态”,从而导致曲霉易感。我们的研究表明[26],IAPA患者与无曲霉感染的重症流感患者相比,IAPA组Th1细胞分泌的促炎因子IFN-γ及IL-2明显降低,而Th2细胞分泌的抑炎因子IL-4及IL-10升高。促炎因子降低使真菌易感性增加,抑炎因子升高抑制吞噬细胞功能和细胞免疫应答从而继发真菌感染;(4)低氧的影响:重症病毒性肺炎患者多存在低氧血症,一项低氧环境下树突状细胞对抗曲霉反应的体外研究中发现[27],与正常氧环境相比,在低氧环境中(2% O2)受到烟曲霉刺激的树突状细胞释放的细胞因子(如IL-6,IL-1α等)随着时间的推移逐渐减少,12 h后最明显。此外,在低氧环境中烟曲霉刺激树突状细胞后,表现为树突状细胞成熟障碍,不能发挥抗原递呈作用进而影响适应性免疫应答。因此低氧可减弱人体树突状细胞产生的抗烟曲霉免疫反应从而影响IPA患者的疾病进程和结局。
第三,重症流感患者接受的药物治疗可能导致IPA的发生。例如,广谱抗生素治疗会改变上呼吸道菌群、糖皮质激素治疗导致免疫抑制,均会增加继发感染可能性[28]。
三、IAPA的诊断
IAPA的诊断主要根据临床特征、影像学或气管镜表现和微生物学证据综合判断。
1、IAPA的影像学表现:Park等首次将IPA的CT表现分为血管侵袭型和气道侵袭型[29]。前者包括晕征、楔形实变影、实变中的低密度坏死灶、空气新月征、空洞,多见于粒细胞缺乏患者;后者包括小叶中心型结节影、沿气道分布的结节及斑片影、支气管壁增厚、“树芽征”等,多见于非粒细胞缺乏的免疫抑制患者。Huang等[10]纳入了63例IAPA患者,与对照组相比,IAPA患者的胸部CT以沿支气管血管束分布的多发结节影等气道侵袭型征象(51.6%)为主,而晕征(9.8%)、空洞或新月征(30.8%)等血管侵袭型征象比例较低。IAPA患者的影像学表现与其他非经典免疫抑制IPA患者,如慢性阻塞性肺疾病、实体器官移植患者相近,更多表现为沿支气管血管束分布的结节及斑片影(61.8%)等气管侵袭型征象,而特征性的血管受侵型征象出现率较低[30]。
2、半乳甘露聚糖(galactomannan,GM)实验:半乳甘露聚糖是曲霉细胞壁的重要成分,通过检测血或BALF的半乳甘露聚糖浓度可用于诊断IPA。目前关于非中性粒细胞减少的IPA患者GM实验诊断价值研究表明[31]:血清GM实验(临界值≥0.5)敏感度为41%~78%,特异度为89%~100%;BALF GM实验(临界值≥1.0)敏感度约为80%,特异度为97%。He等[32]在重症慢性阻塞性肺疾病合并肺曲霉病患者中发现血GM实验与BALF GM实验的敏感度/特异度分别为77.8%/100%、88.9%/100%;BALF GM阳性的时间早于下呼吸道标本曲霉培养阳性的时间(1 d vs 3.8 d)。因此,在大部分非粒细胞缺乏的轻度免疫抑制患者中,血GM的敏感度低,而BALF GM则具备较高的敏感度及特异度,且可早于传统培养结果辅助早期诊断IPA。目前尚缺乏大样本量的研究探究血及BALF GM实验在IAPA患者中的诊断价值。但现有研究表明[2,11,14],在IAPA患者中BALF GM试验结果阳性率较高。2011年Wauters等[11]在研究IAPA危险因素时发现BALF GM实验阳性率94%,而血GM实验的阳性率则为78%。同样Veerdonk等[14]发现在23例IAPA患者中18例行BALF GM实验,17例为阳性(阳性率94%);14例患者行血GM实验,10例为阳性(阳性率71%)。在最近的一项关于IAPA患者血GM实验意义的研究中[33],通过比较流感患者组(36例)与非流感患者组(72例)发现纳入血浆GM实验阳性这一诊断条件使流感患者组IPA的发病率从11%增加至17%;使非流感患者组IPA发病率从4%增加至6%,两组间发病率的增加并没有统计学意义(P=0.08)。因此,血GM实验对于IAPA诊断价值可能并不大。由于IAPA患者血清GM实验的阳性率低,因此BALF GM可能是此类患者临床诊断IPA的重要依据。
3、气管镜:Nyga等[34]研究发现,在流感合并曲霉感染的患者中侵袭性曲霉性气管支气管炎(invasive tracheobronchial aspergillosis,ITBA)占27%,所有患者均通过气管镜检查发现病变。由于部分合并曲霉感染的患者早期病变可能仅局限于气道而尚未侵及肺实质,因此通过气管镜检查可在影像学出现异常前辅助早期诊断。ITBA气管镜下的典型表现为假膜、溃疡、结节样的病损,当重症流感患者在气管镜下出现上述典型表现时应高度怀疑曲霉感染的可能[28]。
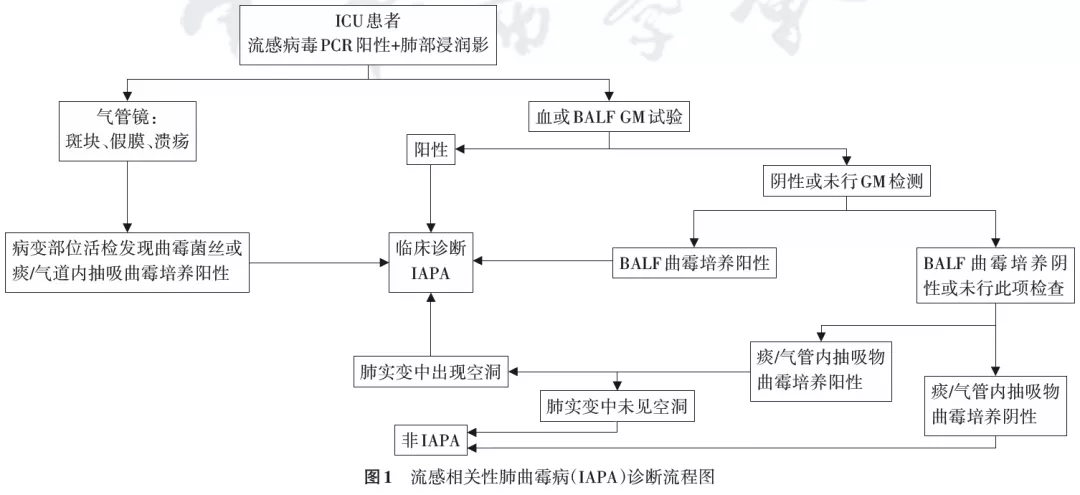
4、诊断标准:IAPA的诊断时间一般为诊断流感后2~3 d[7,11,14]。目前针对IPA的诊断标准有EORTC/MSG标准[35]、Bulpa标准[36]及ICU标准[37],这些诊断标准分别适用于不同的危险人群,共同采用分级诊断,分为确诊(proven)、临床诊断(probable/putative)和疑似诊断(possible),各个诊断标准之间确诊依据都要依靠组织病理学诊断,但由于宿主因素或影像学特定征象的要求并不适用于IAPA的诊断。2020年Verweij等[2]在文献复习的基础上提出了IAPA诊断标准的专家共识。该共识指出因流感伴肺部浸润影收入ICU的患者均应该考虑到IAPA的可能性,其临床诊断流程如图1所示。此共识中,IAPA的诊断标准包括纳入标准、临床特征和微生物学证据,也采用了分级诊断标准。这一新的诊断标准主要特点如下:
(1)强调重症流感本身即为IAPA的危险因素:诊断标准中不包含其他宿主因素,只需要符合入ICU重症流感患者的纳入条件;
(2)明确区分了流感相关的曲霉性气管支气管炎(aspergillus tracheobronchitis,ATB)和IPA:有助于早期识别;
(3)强调了气管镜的重要性:研究表明高达50%的IAPA都是曲霉性气管支气管炎[34],无论是气管镜镜下的典型表现还是气管镜获取BALF标本行GM实验或真菌培养都是诊断标准的重要条目;
(4)未获得高质量下呼吸道标本时的处理流程:若未取得BALF标本而只是痰或气管内吸引物培养阳性的时影像学标准必须严格,一定要出现典型空洞才能诊断;而当GM实验结果和痰培养结果矛盾时应该以GM实验结果为主。这一新的诊断标准更加强调了气管镜检查和GM实验的重要性,未来需基于确诊病例的研究来评价IAPA新标准的诊断效能。
四、IAPA的治疗
1、抗病毒治疗:目前的指南强烈建议,对任何因流感住院的患者,特别是病情严重和病情进展速度较快的患者,无论是否有流感疫苗接种史,都应立即开始抗病毒治疗。目前有证据支持早期(48 h内)应用奥司他韦(成人剂量每次75 mg,2次/d)对于治疗IAPA有的帮助[38];尚无证据支持不同神经氨酸酶抑制剂的联合应用以及加量应用。我国上市的药物有神经氨酸酶抑制剂(neuraminidase inhibitor,NAI)、血凝素抑制剂和M2离子通道阻滞剂。
2、抗真菌治疗:对于强烈怀疑IPA的患者,有必要在进行诊断性评估的同时,尽早开始抗真菌治疗。一项研究结果显示[14],存活的IAPA患者接受抗真菌治疗距流感确诊的中位时间为2 d,而死亡患者的中位时间则为9 d,这表明IAPA早期诊断和治疗至关重要。然而,IAPA患者的临床表现和实验室检查无特异度造成早期诊断困难,进而导致抗真菌治疗的延迟,最终导致病死率的增加。正在进行的研究中应用泊沙康唑对所有入住ICU的重症流感患者进行预防性抗真菌治疗,以期降低IAPA的发病率和病死率(NCT03378479)。而广覆盖的预防性抗真菌治疗是否必要,且是否会增加额外医疗费用仍有待进一步探讨。未来的研究方向期望制定IAPA的危险因素评分系统识别IAPA高危患者并开始针对性的抗真菌治疗。
3、重症流感病毒性肺炎的支持治疗:
(1)呼吸支持治疗:临床实践中,多次气管镜下吸痰、俯卧位治疗、机械通气等通过改善痰液引流及肺通气起到一定的治疗效果,但这些目前尚无相关循证医学证据。对于重症流感患者中无创通气支持治疗的研究较少,有观察性研究表明[39],重症H1N1患者中应用无创通气治疗后治疗失败风险将增加至85%,且存在病情越重,治疗后病死率越高的现象,有创通气治疗往往对于重症流感病毒性肺炎所致急性呼吸窘迫综合征患者起到较好的肺保护作用,较高的持续正压通气治疗往往可以提高ARDS患者的生存率。此外,俯卧位治疗可改善流感所致严重急性呼吸窘迫综合征患者氧合,减少二氧化碳滞留。
(2)体外膜肺氧合(extro-corporeal membrane oxygenation,ECMO):作为终极呼吸支持手段,ECMO在IAPA中有效性及安全性的研究较少。2012年,Otterspoor等[40]报道了2例IAPA患者通过ECMO治疗45和52 d后好转出院,可见ECMO对于IAPA治疗有效,但其治疗时机、合并其他感染及血流动力学等其他问题仍待进一步研究。
(3)连续性肾脏替代治疗(continuous renal replacement therapy,CRRT):可辅助早期清除炎性介质、抑制过度炎症反应,从理论上讲可能辅助IAPA的治疗,但这些目前尚无相关循证医学证据,是未来的研究方向。
五、结语
IAPA的发病率、病死率较高,应引起临床医师的高度关注。未来的研究应着眼于多中心、大样本量、高质量的临床研究探索IAPA的流行病学、危险因素、早期诊断的方法及抗真菌治疗的时机,同时重症病例的个案分析报道,以期降低此类患者的发病率并改善预后。
参考文献(略)
作者:张英芳 黄琳娜 詹庆元; 单位:北京大学医学部中日友好临床医学院;国家呼吸医学中心 中日友好医院呼吸与危重症医学科
引用本文: 张英芳, 黄琳娜, 詹庆元. 重症监护病房中重症流感相关性侵袭性肺曲霉病的研究现状 [J] . 中华结核和呼吸杂志, 2021, 44(7) : 651-655. DOI: 10.3760/cma.j.cn112147-20200814-00900.
本文转载自订阅号「中华结核和呼吸杂志」(ID:cmjlung)
原链接戳:【综述】重症监护病房中重症流感相关性侵袭性肺曲霉病的研究现状
本文完
排版:Jerry


