青年男性患者,既往体健,无基础疾病,以发热、咳嗽、胸痛起病,病情进展迅速,伴多器官功能衰竭,尽管采取了各项积极的治疗,患者最终仍未能获救。对于此类凶险疾病,今后临床该如何应对?此病例或许会带给我们一些启迪。
铜绿假单胞菌(Pseudomonas aeruginosa)是一种多见于免疫功能低下或结构性肺病人群中的机会性致病菌,也是院内感染的常见病原菌。在健康人群的社区获得性肺炎(community acquired pneumonia,CAP)中,铜绿假单胞菌比较少见,但往往侵袭性较强。本文报道重症社区获得性铜绿假单胞菌肺炎1例。患者病情进展迅速,伴随多脏器功能衰竭,虽然经明确诊断和积极治疗,仍死于脓毒症休克。
临床资料
患者男性,31岁,因「发热、咳嗽、胸痛3 d,呼吸困难6 h」于2018年5月12日入院。患者入院前3天出现发热,体温最高39.5℃,无畏寒、寒战,伴随咳嗽,咳黄白色黏痰,偶有痰中带血,感右侧胸背部疼痛明显,服用罗红霉素效果不佳。5月12日于当地医院查血常规:WBC 12.2×109/L,NE% 93.6%;胸部CT:右肺上叶大片实变影伴空洞形成(图1)。6 h前患者呼吸困难进行性加重,至我院急诊就诊。
血常规:WBC 4.03×109/L,NE% 92.3%,Hb 150 g/L,PLT 107×109/L;PCT 16.18 ng/ml;血生化:AST 45 IU/L,TBIL 14.71 μmol/L,DBIL 11.04 μmol/L,TP 58 g/L,ALB 37 g/L,LDH 696 IU/L,CK-MB 45 IU/L,Urea 21.24 mmol/L,CR 351.6 μmol/L,K+ 3.3 mmol/L,Na+ 141 mmol/L;心梗四项:cTNT 0.732 ng/ml,NT-proBNP 25333 pg/ml;血气分析:pH 7.10,PaO2 57 mmHg,PaCO2 57 mmHg,HCO3- 17.7 mmol/L,BE -12.4 mmol/L,Lac 5.7 mmol/L。予无创呼吸机辅助通气,1 h后复查血气分析,患者酸中毒及氧合水平无改善,且出现嗜睡状态。为进一步诊治收入我科。
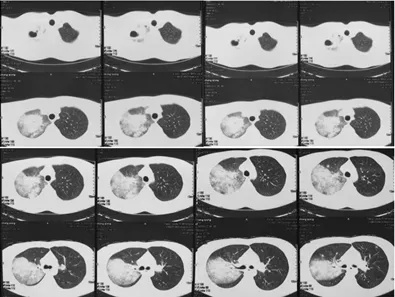
图1:胸部CT提示右肺上叶大片实变影伴空洞形成
患者职业为电焊工人。既往体健,无吸烟、饮酒史,无毒物、家禽、家畜接触史。无家族遗传病史。
入院查体:T 36.2℃,P 154次/min,R 37次/min,BP 84/50 mmHg,嗜睡状态,四肢冰凉,口唇发绀,右肺呼吸音低,双肺散在湿啰音,心律齐,各瓣膜区未闻及杂音。
急查血气分析(FiO2 1.0):pH 7.06,PaO2 60.8 mmHg,PaCO2 72.4 mmHg,HCO3- 16.4 mmol/L,Lac 5.8 mmol/L;血常规:WBC 1.09×109/L,NE 0.5×109/L,Hb 158 g/L,PLT 93×109/L;血生化:肝功能大致正常,Urea 23.03 mmol/L,Crea 410 μmol/L;PCT 23.28 ng/ml;心梗四项:cTnT 0.998 ng/ml,NT-proBNP>35000 ng/ml;凝血功能:APTT 52.5 s,D-D 2.78 mg/L。床旁胸部X线片(图2)可见右侧气胸,肺叶压缩约50%,右肺均匀致密影,左肺团片致密影。
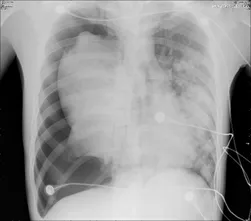
图2:床旁胸部X线片:右侧气胸,肺叶压缩约50%,右肺均匀致密影,左肺团片致密影
入院初步诊断
①重症社区获得性肺炎,Ⅱ型呼吸衰竭,脓毒症休克,爆发性心肌炎?代谢性酸中毒,气胸(右侧);②粒细胞缺乏;③急性肾损伤;④血小板减少。
诊疗经过
入院后立即行气管插管接呼吸机辅助呼吸(PC模式:PC 14 cmH2O,PEEP 3 cmH2O,FiO2 1.0),并行胸腔闭式引流术,积极液体复苏纠正休克,亚胺培南西司他丁1g q8h+万古霉素0.5g q8h+奥司他韦75mg q12h+阿奇霉素0.5g qd抗感染治疗,但患者氧合仍难以维持。入院5 h后建立VV-ECMO,氧合改善,但循环衰竭仍难以纠正[去甲肾上腺素4.8 μg/(kg·min),HR 150~160次/min,血压仅60~70/30~45 mmHg]。心脏彩超提示全心收缩功能减低,射血分数(EF)约10%。考虑脓毒症休克合并心源性休克,ECMO更改为VAV模式。
在积极对症支持和充分抗感染的情况下,围绕患者主要问题进行进一步检查。
感染方面:入院第3天(2018-05-14)行气管镜检查:气管黏膜轻度充血水肿,隆突锐利,双肺各叶段黏膜充血水肿较明显,黏膜未见明显出血及糜烂;各叶段开口通畅,未见新生物;各叶段可见中等量黄褐色稀薄分泌物(当日床旁胸部X线片见图3)。留取支气管肺泡灌洗液(BALF)后送检病原学,于入院后第5天(2018-05-16)回报结果为铜绿假单胞菌,药敏结果见表1。同时,患者右侧胸腔闭式引流液为黄色浑浊液体,经反复送检,培养结果与BALF相同。其他细菌、病毒、真菌、结核等检查均阴性。在明确病原学后,抗菌药物调整为亚胺培南西司他丁1g q8h+万古霉素0.5g q8h。
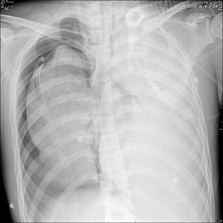
图3:2018年5月14日床旁胸部X线片
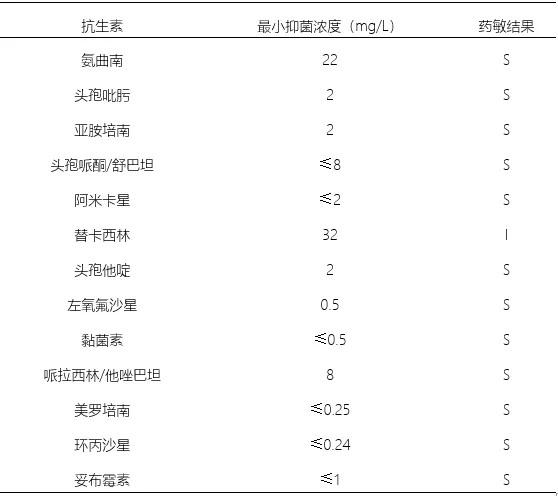
表1:BALF培养药敏结果
呼吸支持方面:采用保护性通气策略,同时保证胸腔闭式引流气泡无明显增多,PC 10~16 cmH2O,PEEP 3~10 cmH2O,潮气量100~150 ml。ECMO血流量控制在4.5~5.5 L/min,气流量5~9 L/min,根据氧合及循环情况调整ECMO流量分配,血氧饱和度维持在90%以上。
循环支持方面:监测NT-proBNP持续>35000 ng/ml,CK-MB持续升高,最高达89.4 ng/ml、cTnI最高达4.28 ng/ml。入院第3天(2018-05-14),床旁心脏超声示心脏收缩功能有所改善(EF 54%),当日下午,患者VAV-ECMO的A端血流速度明显减慢,且在A端近右侧股动脉端肉眼可见明显暗区,可疑血栓形成。遂离断A端,改为VV-ECMO,同时持续给予胶体为主的液体复苏、CRRT替代肾功能及脱水。入院当天(2018-05-12)及第2天(2018-05-13)液体正平衡分别为4200 ml和2000 ml,此后每日液体平衡控制在正500~1000 ml。
血液系统方面:患者入院时表现为粒细胞缺乏,复查Hb、PLT进行性下降,凝血功能异常,PT最高达21.5 s,APTT最高达58.8 s。外周血涂片:WBC数量正常,可见大量异常幼稚细胞,偶见异型淋巴细胞,PLT减少,可见大的PLT。入院第3天(2018-05-14)行骨髓穿刺,骨髓病理显示:造血成分约占60%,三系均可见,幼稚粒系增多,分叶核粒系减少,红系相对少见,巨核系未见显著改变,吞噬细胞增多,可见噬血现象,网织纤维(++)。外送NK细胞活性:12.81%(参考范围≥15.11%)。血清铁蛋白(2018-05-15)2991 μg/L。持续输注血浆、PLT支持治疗,予重组人粒细胞刺激因子促进造血。
虽经过全力积极的抢救,患者仍持续休克难以纠正,入院第6天下午(2018-05-17),生命体征急剧恶化,意识状态深昏迷,对血管活性药物无反应,最终家属要求放弃治疗自动出院。
最终诊断
①重症社区获得性肺炎(铜绿假单胞菌),脓毒症休克,Ⅱ型呼吸衰竭,代谢性酸中毒,脓气胸(右侧);②脓毒症心肌病,心源性休克;③急性肾损伤;④急性肝衰竭;⑤噬血细胞综合征?粒细胞缺乏,血小板减少,中度贫血;⑥凝血功能异常;⑦电解质紊乱,高钠血症。
健康人因何罹患社区获得性铜绿假单胞菌肺炎?为何该病具有如此高的病死率?如何进行早期快速判断?治疗方案如何选择才能更好地救治患者,改善预后?这些都是今后临床需要深入研究的问题。
本文报道重症社区获得性铜绿假单胞菌肺炎1例,该病原体引起健康群体社区获得性肺炎较少见,但往往病情危重。病程中该患者相继出现呼吸衰竭、休克及心脏、肝、肾、凝血系统、血液系统等多器官/系统功能衰竭,治疗难度极高。虽然应用了机械通气、CRRT、ECMO等支持手段,但患者仍因脓毒症休克难以纠正最终死亡。
(1)社区获得性铜绿假单胞菌肺炎(P. aeruginosa associated CAP,PCAP)。
本例患者为青年男性,既往无基础疾病,以发热、咳嗽、胸痛起病,胸部CT见右上肺实变伴空洞形成,随后出现气胸,迅速进展至双肺病变,并合并脓毒症休克,需要呼吸机及更高级的方式支持治疗。患者BALF和胸腔引流液均培养出敏感铜绿假单胞菌,故重症社区获得性肺炎(铜绿假单胞菌)诊断明确。
铜绿假单胞菌是一种广泛分布于自然界中的革兰氏阴性杆菌,毒力很强,能够产生多种毒素,包括外毒素和一些酶。另外,它们产生的生物膜可以保护菌群,减少宿主内环境和免疫系统对其的影响[1]。社区来源的铜绿假单胞菌感染常见于皮肤、外耳等表皮及软组织感染,肺部感染则多发生在既往有结构性肺病,如慢性阻塞性肺疾病、支气管扩张、囊性纤维化等患者中。而既往健康者罹患PCAP的情况非常罕见,过去近60年中国内外公开报道的此类病例约为20例[2,3]。此类肺炎往往进展迅速,并发症多,病死率可达40%~60%。本例患者同时合并了脓气胸、脓毒症心肌病、全血细胞减少及多器官功能衰竭等众多并发症,与已有报道的病例相比更加危重。
PCAP患病人群中男女比例为1.15∶1,中位发病年龄为(44±13.54)岁,发热、咳嗽、胸痛是本病最常见的症状,少数患者体温可达39℃以上,还可以表现为呼吸困难、肩痛、背痛等,一些患者起病时可以仅表现为单侧肩痛。右肺上叶最常受累,约有2/3的患者首次胸部X线片表现为右肺上叶实变[4]。与其他CAP相比,此类患者非常容易出现呼吸衰竭和脓毒症休克。
PCAP可能与暴露于受污染的气溶胶中有关,有文献报道一些PCAP患者曾使用过家用湿化器和水疗仪,并且从可疑的污染水源中分离培养出了与患者肺内相同的铜绿假单胞菌。此外,从事金属铸造和焊接的工人可能因为吸入了受铜绿假单胞菌污染的粉尘而罹患PCAP。这提示本例患者可能是由于吸入了污染的气溶胶而感染了这些细菌[5]。本例患者从事金属焊接工作,存在可疑的高危职业接触史。我们曾与患者所在工厂进行沟通,希望获取工作环境中的标本进行进一步分析,但被拒绝。另外,吸烟可能也是PCAP的危险因素。
本例患者感染的铜绿假单胞菌药敏结果显示其几乎对所有抗生素均敏感,即便如此,在我们经验性选择亚胺培南西司他丁1g q8h+万古霉素0.5g q8h的情况下,感染依然没有得到有效控制,并且病情持续恶化。研究显示,与囊性纤维化相比,导致急性感染的铜绿假单胞菌中能够表达Ⅲ型分泌蛋白的菌株更多,而Ⅲ型分泌蛋白包括ExoS、ExoT、ExoU及ExoY等外毒素,它们的表达明显增加了患者的死亡风险[6]。这可能是PCAP患者病死率高的机制之一。
目前对发生在健康人群中的PCAP尚无公认的治疗意见和经验。尽早开始经验性治疗、积极进行脏器支持、严格隔离避免院内感染发生可能能够降低患者的病死率。
(2)脓毒症心肌病(sepsis-induced cardiomyopathy,SICM)。
脓毒症心肌病是严重脓毒症和脓毒症休克的并发症之一,是由于细胞因子和线粒体功能失调而引起的可逆的心肌结构和功能异常,其主要表现为左心室扩大,EF降低(<50%)并且能够在7~10 d内恢复。根据不同研究报道,在脓毒症和脓毒症休克患者中,脓毒症心肌病的发病率为13.8%~64.0%,且男性更易发病,而青年、高乳酸水平和既往有心力衰竭病史可能是脓毒症心肌病的危险因素。但脓毒症心肌病患者的30 d病死率与其他脓毒症和脓毒症休克患者无明显差异[7]。
本例患者发病初期出现心力衰竭、心源性休克,心肌损伤标志物如cTnT和CK-MB水平升高,床旁心脏超声见全心收缩力明显减低,经VAV-ECMO支持后心功能恢复较快,结合患者的原发病,考虑患者心力衰竭的原因为脓毒症心肌病。
脓毒症心肌病的治疗与无心功能异常的脓毒症休克患者类似,仍以控制感染、稳定血流动力学为主要原则。新型抗心力衰竭药物如左西孟旦或主动脉内球囊反搏(IABP)、ECMO等支持手段在将来可能会成为治疗脓毒症心肌病的选择[8]。
总 结
发生于健康人的PCAP非常少见,但该病进展迅速,并发症多,病死率极高。故提高对该病的认识很有必要。对社区起病、既往体健、免疫功能正常的重症肺炎患者,应想到该病可能。但目前该病治疗经验较少,力争通过及时充分地进行药物治疗并进行相应的器官功能支持以改善患者的预后。
参考文献
[1] FUJITANI S, SUN H Y, YU V L, et al. Pneumonia due to Pseudomonas aeruginosa: part I: epidemiology, clinical diagnosis, and source[J]. Chest, 2011, 139(4):909-919.
[2] RAHDAR H A, KAZEMIAN H, BIMANAND L, et al. Community Acquired Pseudomonas Aeruginosa Pneumonia in a Young Athlete Man: A Case Report and Literature Review[J]. Infect Disord Drug Targets, 2018, 18(3):249-254.
[3] 王方文,曹国强.社区获得性重症铜绿假单胞菌肺炎1例并文献复习[J].重庆医学,2013,42(28):3461-3463.
[4] HATCHETTE T F, GUPTA R, MARRIE T J. Pseudomonas aeruginosa community-acquired pneumonia in previously healthy adults: case report and review of the literature[J]. Clin Infect Dis, 2000, 31(6):1349-1356.
[5] CORDES L G, BRINK E W, CHECKO P J, et al. A cluster of Acinetobacter Pneumonia in foundry workers[J]. Ann Intern Med, 1981, 95(6):688-693.
[6] ROY-BURMAN A, SAVEL R H, RACINE S, et al. Type III protein secretion is associated with death in lower respiratory and systemic Pseudomonas aeruginosa infections[J]. J Infect Dis, 2001, 183(12):1767-1774.
[7] SATO R, KURIYAMA A, TAKADA T, et al. Prevalence and risk factors of sepsis-induced cardiomyopathy: A retrospective cohort study[J]. Medicine (Baltimore), 2016, 95(39):e5031.
[8] SATO R, NASU M. A review of sepsis-induced cardiomyopathy[J]. J Intensive Care, 2015, 3:48.


