摘要
呼吸道病毒感染是急性咳嗽的常见原因。但是在病因清除及发热、鼻塞、流涕等症状缓解后,仍有部分患者存在持续的咳嗽,表明呼吸道病毒可能会介导咳嗽的敏感性增高,导致亚急性或慢性咳嗽的发生。病毒感染后的咳嗽反应是防止病毒从上呼吸道传播到其他部位的保护性策略,但过度咳嗽就成为了一种疾病。本文介绍了呼吸道病毒感染后亚急性或慢性咳嗽发生的病理生理机制,并探讨了相关研究进展。
当呼吸道病毒感染本身急性期症状消失后,咳嗽仍然迁延不愈,临床上称为病毒感染后咳嗽。多表现为刺激性干咳或咳少量白色黏液痰,通常持续3~8周,为亚急性咳嗽,部分患者持续时间超过8周,称为慢性咳嗽。引起感染后咳嗽的常见呼吸道病毒有鼻病毒、呼吸道合胞病毒、冠状病毒、流感病毒与副流感病毒等。病毒感染后咳嗽具有一定的自限性。约81%的急性上呼吸道病毒感染患者有咳嗽症状,69%的患者咳嗽比其他感染症状持续时间长,其他感染症状消失后咳嗽持续的时间超过4周的患者比例达4%[1]。呼吸道病毒感染主要引起机体免疫反应,炎症细胞释放炎性介质,直接或间接影响外周和中枢的调控机制,从而出现咳嗽频率增加和敏感性增强。咳嗽高敏患者存在特征性触发因素,主要表现为气道感觉神经感知气道刺激的阈值降低及咳嗽敏感性增高的一种超敏状态,诸如环境温度变化、深呼吸、大笑、交谈、闻香水或吃易碎的干粮等均可触发咳嗽[2]。病毒感染后咳嗽是排除性诊断,在发病初期有明确的呼吸道感染病史,行胸部X线及肺通气功能检查未见异常及诱导痰中嗜酸粒细胞比例正常,并且排除其他引起咳嗽的病因后诊断成立。对于一般患者可酌情给予对症处理,咳嗽程度严重者可适当给予非特异性镇咳治疗以避免生活质量的严重影响或并发症的发生。随着对咳嗽机制的认识不断加深,加巴喷丁与阿米替林等神经调节剂的使用越来越广泛,以及针对各个咳嗽通路的药物研发已成为新的热点。由此可见,即使病毒感染的诱因明确,咳嗽在经历各种治疗手段后可能效果欠佳,甚至进展为难治性慢性咳嗽,说明病毒介导的亚急性和慢性咳嗽是一个复杂的病理生理过程,亟需阐明其机制才能制定切实有效的治疗方案。
病毒感染后咳嗽高敏的机制主要包括外周神经与中枢神经的咳嗽敏感性增高。本文主要从这两个方面展开阐述。
一、病毒感染与外周神经
咳嗽反射是由支配气道的机械或化学敏感性迷走神经传入纤维的激活引起的,机械刺激的感觉主要由有髓鞘的Aδ迷走神经末梢的咳嗽感受器介导,它们主要起源于结状神经节,从鼻咽到喉、气管、支气管均有分布,对气道轻微机械变化(如肺容积变化、气道平滑肌收缩和气道黏膜水肿等)十分敏感。化学刺激物和内源性炎性介质的识别主要由C纤维介导,C纤维是无髓鞘的迷走传入神经,能被辣椒素、柠檬酸、缓激肽等激活,它们起源于结状神经节和颈静脉神经节,颈静脉神经节C纤维终止于肺外(喉,气管,主支气管)和肺内组织,而结状神经节C纤维主要终止于肺内[3]。由此可见,迷走感觉神经投射到喉和支气管肺泡的所有层面,当呼吸道病毒感染时,肺部免疫反应将直接影响迷走神经。
1、炎症细胞及其释放的细胞因子:
由病毒感染募集炎症细胞后释放的细胞因子,可直接或间接激活气道感觉神经,是最初导致咳嗽敏感性增高的原因。病毒是引起细胞免疫的重要抗原,病毒感染后肺抗原提呈细胞接受病毒抗原并迁移到纵隔淋巴结,在那里它们将主要组织相容性复合体负载的抗原有效地呈递到幼稚T细胞并诱导适应性免疫反应,使CD8+ T淋巴细胞与CD4+ Th1淋巴细胞活化、增殖,成为效应T细胞[4, 5, 6]。病毒感染后咳嗽豚鼠模型BALF中淋巴细胞数量明显增高[7],感染后慢性咳嗽患者的外周血与诱导痰的CD8+CD28- T淋巴细胞数量明显增高,其中重度咳嗽患者组增高程度更明显[8]。活化的CD8+ T淋巴细胞与CD4+ Th1淋巴细胞可产生穿孔素渗透至受感染宿主细胞以诱导细胞凋亡[9],有助于病毒消除。肺部聚集的T淋巴细胞可释放干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)等细胞因子[6]。局部增高的IFN-γ可与肺部巨噬细胞和上皮细胞的相应受体结合,通过 JAK/STAT1/IRF-1信号通路刺激IFN-γ诱导蛋白10(IP-10)、IFN-γ诱导单核细胞因子(MIG)的表达与分泌[10, 11],IP-10与T淋巴细胞表面受体结合,促进肺部募集活化的CD8+ T淋巴细胞与CD4+ Th1淋巴细胞[12],二者又会分泌IFN-γ、TNF-α等细胞因子,形成炎症正反馈,导致气道上皮损伤。呼吸道病毒进入宿主后,被肺泡上皮细胞表面Toll样受体识别,一方面通过衔接子髓样分化因子88激活核因子-κB(NF-κB),导致IL-6、IL-8、IL-1β、TNF-α等细胞因子释放,另一方面可通过β干扰素TIR结构域衔接蛋白(TRIF)发出信号,激活干扰素调节因子(IRF),促进1型干扰素(IFN-α、IFN-β)和趋化因子(IP-10、MIG)的表达[13]。另外,呼吸道病毒感染后巨噬细胞迁移到肺组织,识别病毒相关的病原体相关分子模式,激活IRF和NF-κB信号通路,介导Ⅰ型干扰素、趋化因子和促炎细胞因子的表达[14]。病毒感染后肺效应T淋巴细胞、肺上皮细胞及巨噬细胞释放的细胞因子,促进气道炎症的形成,也可能是激活气道感觉神经的主要原因(图1)。
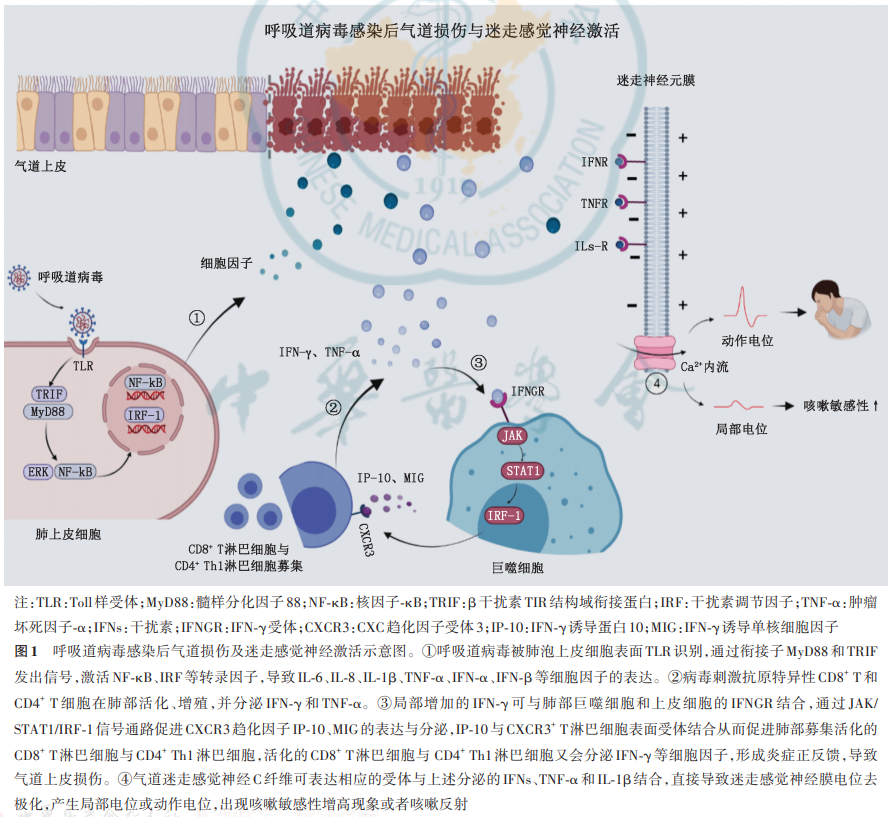
事实上,迷走神经C纤维可大量表达IFNs、TNF-α与IL-1β等细胞因子的受体[3],可与相应的细胞因子结合,导致气道感觉神经元膜电位去极化、兴奋性增高。例如,IFN-γ可通过JAK/STAT-PKA-AMPA途径诱导迷走神经元Ca2+内流和膜电位去极化,使神经纤维的静息电位更加接近阈电位,从而增加气道的咳嗽敏感性[3,15]。IFN-α与IFN-β通过刺激神经末梢的1型干扰素受体和激活JAK1,引起迷走神经支气管肺C纤维末梢的动作电位放电,C纤维激活,从而产生咳嗽反射[16]。TNF-α和IL-1β可直接与小鼠肺感觉神经元上的受体结合,诱导肺部迷走神经C纤维的Ca2+内流,增强其对低剂量辣椒素的敏感性,导致咳嗽高敏[17, 18]。这些细胞因子与迷走感觉神经C纤维的受体结合,导致迷走感觉神经膜电位去极化,降低咳嗽阈值和增加对外界刺激的敏感性,形成过度咳嗽的临床表现(图1)。
2、TRP通道表达上调:
瞬时受体电位(TRP)通道蛋白可选择性地激活迷走神经C纤维,引起患者和清醒动物的咳嗽。考虑非选择性阳离子TRP通道对许多内源性炎性介质敏感,它们很可能在病毒感染导致咳嗽高敏感的过程中同时被激活。细胞实验结果表明,病毒感染后病毒蛋白直接与细胞表面Toll样受体相互作用来诱导炎性介质分泌,上调瞬时感受器电位香草酸受体1(TRPA1)、瞬时感受器电位锚蛋白1(TRPV1)和钙离子酸敏感离子通道3的表达[19]。在动物实验中,3型副流感病毒感染后迷走神经节中TRPV1和TRPA1的基因表达上调,导致豚鼠的咳嗽敏感性增强[20, 21]。迷走神经支气管肺C纤维中TRPA1和TRPV1具有协同作用[22],可能在增加咳嗽敏感性时有明显的增效作用。在临床上,TRPA1和TRPV1可介导难治性慢性咳嗽患者的咳嗽超敏反应[23]。因此,病毒感染后TRP通道的上调以及各通道间的相互作用,可增加迷走感觉神经C纤维的活化程度,导致咳嗽敏感性增加。
3、气道神经源性炎症:
神经源性炎症是指感觉神经末梢(包括C纤维末梢等)释放的神经肽或递质,如P物质、神经肽A、神经肽B、降钙素基因相关肽等所介导的炎症反应[24],表现为血管通透性增高、血浆外渗以及组织水肿等[25]。病毒感染后咳嗽患者诱导痰上清及痰细胞的P物质、降钙素基因相关肽含量显著升高,提示气道神经源性炎症存在[26]。其可能的机制有:各类炎性介质刺激咳嗽感受器并引起神经肽的释放;感染及炎症导致气道上皮损伤,损伤后的上皮细胞合成中性内肽酶减少,使得神经肽降解减少。神经肽既可以直接刺激感受器,又可以导致血管通透性增加、气管黏膜充血水肿,间接刺激咳嗽感受器,导致咳嗽高敏状态[27]。
4、外周神经重塑:
病毒感染后的亚急性和慢性咳嗽往往超过免疫清除病毒感染所需的时间,同时伴随外周感觉神经的敏感性改变,表明病毒感染可能会诱导感觉神经元表型和结构的可塑性变化。病毒感染后神经营养因子可能向迷走神经节中的感觉神经元胞体发出逆行信号,促进转录变化和神经元生长,引起位于远端感觉神经节的胞体中基因表型发生变化[28]。近年研究中发现咳嗽敏感性增高的患者气道上皮中感觉神经纤维长度和分支点数量显著增加,说明这些神经可能通过增加上皮中纤维末端的密度和扩大纤维的感受野来增加气道感觉神经的敏感性,导致咳嗽高敏[29, 30]。有文献报道以严重咳嗽为主的哮喘患者行支气管热成形术,通过减少气道神经纤维数量,使咳嗽症状缓解[31]。这表明感觉神经元表型变化及气道感觉神经纤维重塑,也可能引起慢性咳嗽。
二、病毒感染与中枢神经
支气管肺感觉神经元终止于脑干核团中的二级神经元,结节状神经元终止于孤束核,颈静脉感觉神经元主要终止于三叉旁核。这些二级神经元投射到参与产生反射性咳嗽的脑干呼吸回路,或者投射到感觉辨别(产生咳嗽冲动)和行为性咳嗽调节(咳嗽的诱导和抑制)所需的皮层下和皮层神经网络。因此,中枢网络是咳嗽运动模式和相关感觉的指挥中心。
1、中枢神经敏化:
目前认为一些呼吸道病毒可能通过感染呼吸道的迷走感觉神经纤维,然后逆行到达脑干和大脑,也可能是感染后的外周神经炎症或免疫信号通过血液途径到达大脑区域,最终引起胶质细胞活化和中枢神经炎症,导致中枢敏化。病毒性肺炎的小鼠表现出小胶质细胞活化、星形胶质细胞表达标志物增加,在其脑干匀浆中检测到炎性介质IFN-α和IL-1 β的转录升高[32]。咳嗽也是新型冠状病毒感染后的常见症状,研究发现新冠患者的脑脊液中存在IL-6、IL-18等促炎细胞因子[33];同时在神经系统感染的患者脑部发现神经炎症特征[34],说明感觉神经元的炎症可能为超敏反应提供核心基础。目前常用的神经调节剂如加巴喷丁、普瑞巴林等对部分难治性慢性咳嗽患者具有一定的疗效[35, 36],也提示中枢敏化可能是病毒感染后咳嗽的发病机制之一。
2、中枢神经控制失衡:
已知病毒性呼吸道感染患者的咳嗽冲动会明显增强[37],在表现出咳嗽超敏反应的患者中进行功能磁共振成像检查,发现吸入辣椒素后的咳嗽主要与促进咳嗽的脑干和感觉皮层活动增加,而抑制咳嗽的中枢网络活动减少有关[38]。相反,吸烟者表现出咳嗽敏感性降低,主要与大脑中感觉皮层活动减少和抑制咳嗽的网络活动增加有关[39]。难治性慢性咳嗽患者更难主动抑制辣椒素或其他有害刺激诱发的咳嗽[40, 41]。因此,肺病毒感染后的神经病理生理变化可能会改变中枢网络系统,产生咳嗽感觉增强或者抑制能力减弱的中枢神经控制失衡表现,但是相关的机制还需进一步探讨。
三、小结与展望
病毒感染后炎症细胞募集及其释放的细胞因子、TRP通道上调、气道神经源性炎症和气道神经重塑介导了外周神经敏化过程,促使咳嗽敏感性的增高,而中枢敏化和中枢神经控制失衡则为中枢性咳嗽的关键。对病毒感染后咳嗽与难治性慢性咳嗽而言,调节咳嗽的神经系统可能经历了激活、敏化和重塑过程。
目前在呼吸道病毒感染后咳嗽机制中,更多的是关于外周及中枢神经机制的讨论。随着对机制、临床表现和咳嗽管理的进一步了解,有望出现更好的治疗选择,以改善感染后咳嗽患者的症状及预后。
参考文献(略)
作者:李凤英 邓政;单位:广州医科大学附属第一医院 国家呼吸医学中心 呼吸疾病国家重点实验室 广州呼吸健康研究院
本文转载自订阅号「中华结核和呼吸杂志」
原链接戳:【综述】病毒感染后咳嗽发病机制的研究进展
引用本文: 李凤英, 邓政. 病毒感染后咳嗽发病机制的研究进展 [J] . 中华结核和呼吸杂志, 2022, 45(2) : 213-217. DOI: 10.3760/cma.j.cn112147-20210610-00415.


