2016年,我主编并出版了《肺癌个体化治疗》。当时为什么取「肺癌个体化治疗」这个名字?我认为个体化治疗和精准化治疗之间有相同之处,也有不同之处,但个体化治疗所包含的内容更为丰富。

精准治疗的核心是驱动基因的改变,肺癌的个体化治疗包括精准化治疗,范围更广
个体化治疗主要依据患者的驱动基因改变来选择治疗方案,但同时须全面考虑其临床因素。第一,个体化治疗必须考虑患者的PS评分(体力状况评分)。评分好(0,1)的患者,才可能耐受化疗、手术、放疗及免疫治疗等,同时PS评分好的患者治疗效果可能更好。第二,个体化治疗必须考虑患者的病理学类型。在治疗选择上,组织学类型是非常关键的一环,如JMDB研究首次证明培美曲塞联合铂类对腺癌疗效更好,而吉西他滨联合铂类对鳞癌疗效更好。再如非鳞非小细胞肺癌,尤其腺癌,可以选择抗血管生成药贝伐珠单抗,而鳞癌患者接受贝伐珠单治疗后更易发生大咯血。又如二代铂类药物奈达铂,JUST研究证明奈达铂联合多西他赛可能是鳞癌一线治疗的优选方案。很多研究都显示,组织学类型不同,治疗方案的选择有一定倾向性,从化疗到靶向、再到免疫,它都具有影响。第三,个体化治疗必须考虑患者的TNM分期,这是最基本的临床决定因素。如I、II期非小细胞肺癌首选手术治疗,III期,尤其是IIIA期患者异质性最大,往往需要进行多学科讨论,制定个体化治疗方案。
评估患者主要脏器的功能也是个体化治疗必须考虑的临床因素。如患者心脏功能如何?肺脏功能如何?肝肾功能如何?这些都是个体化治疗需要关注的内容。早期患者能否进行手术治疗,肺功能是关键,因为肺功能不好,就不能耐受麻醉,也就不能选择手术。
还有一些特殊情况,如慢阻肺合并肺癌。这种情况比较多,应该引起高度重视,欧洲研究发现,51.5%肺癌患者同时也患有慢阻肺;28.4%的患者在诊断肺癌前先诊断了慢阻肺。日本研究提示肺癌患者中约54.5%同时患有慢阻肺。慢阻肺,尤其是重度慢阻肺合并肺癌时,肺癌是导致患者死亡的主要原因,对这类患者的治疗包括化疗、靶向、免疫等都要特别小心。用药前一定要评估患者的肺功能、影像学改变。有些化疗药也会导致肺损伤;尽管检测发现有驱动基因突变,也有好的靶向药物,但如果有明显的间质增生时,选靶向药物时要特别小心,因为靶向药物有一个比较少见但严重的副作用,就是导致间质性肺炎、肺间质纤维化。对肺功能特别差的患者,一旦发生间质性肺炎,可能就是致命性的事件。
如果患者肺上有明确的阴影,尤其是非感染性阴影,在免疫治疗时一定要小心。因为免疫治疗时约1%-2%的患者会出现免疫相关性肺炎,而重度免疫相关性肺炎可能会导致呼吸衰竭,甚至死亡。所以,肺上如果有阴影,进行免疫治疗前一定要检查清楚阴影是感染引起的?还是自身免疫病引起的?还是其他原因?在免疫治疗中,如果出现了肺炎,鉴别诊断非常重要,但有时候比较困难。
当然,年龄也是个体化治疗需要关注的因素。年龄越大,治疗上限制因素越多,如超过70岁,化疗时原则上要求单药化疗;免疫治疗时年龄大(>65岁)的患者相对于年龄小(<65岁)的患者可能更容易出现超进展,而超进展可以说是免疫治疗的噩梦,一旦出现,患者或很快在短期内死亡。
以上都是个体化治疗的内容。
该病例告诉我们,肺癌的免疫治疗一定要「个体化」
免疫治疗总的来讲安全性比较好,但有时也会引起间质性肺炎,甚至发展成肺间质纤维化。我们曾治疗过一例小细胞肺癌患者,男性,60多岁,长期吸烟,走路气短。入院后发现肺功能较差。开始用化疗,效果不佳,经患者同意,用PD-1抑制剂进行免疫治疗。第一个周期结束后,患者出现发热,气短加重,CT检查发现肺部双肺弥漫性浸润性阴影。当时我们首先考虑免疫相关性肺炎,立即停药,吸氧并给予激素治疗等治疗。但患者依然发烧、气短,乏力,饮食差,咳嗽、咳痰不严重,出现呼吸衰竭,生活质量日渐转差,吸氧效果也不佳,接着逐渐出现肺间质纤维化。尽管用上了激素(甲基强的松龙),而且后来加量到240毫克,效果依然不好,加其他免疫抑制剂效果也没有明显效果。患者最终在3个月后去世。
该病例告诉我们:肺癌的免疫治疗一定要个体化,将患者的基础情况评估清楚。还有一种情况是肺间质纤维化,现在这种疾病比较多,有继发的,有原发的,肺间质纤维化患者发生肺癌的比例比较高。只要有肺间质纤维化,免疫治疗的时候都要特别谨慎。
小结上述内容:肺癌的个体化治疗第一要关注患者的体力状况,身体情况怎么样?这对治疗方案的选择及疗效的判断都非常重要;第二要明确病理学类型,是非小细胞肺癌,还是小细胞肺癌?如果是非小细胞肺癌,还要看是鳞癌还是非鳞非小细胞肺癌?治疗方案都不一样,有些药物适用于非鳞非小,不适用于鳞癌,有些药物对鳞癌效果偏好,这都是差异;第三要关注肺癌的分期,也就是早期还是晚期;第四是关注患者脏器功能等;第五要关注特殊类型的疾病,比如慢阻肺合并肺癌,肺纤维化合并肺癌,肺癌合并肺栓塞,这都是些特殊情况,一定要个体化;第六是关注患者的年龄。
而精准化治疗的核心是驱动基因的改变,有驱动基因,就有靶。有靶,就能精准。这是精准化治疗的核心。个体化治疗涵盖精准治疗,还包括了体力状况评分、组织学类型、特殊类型的肿瘤和年龄等等其他因素。所以,个体化内容相对来讲范围较广,但两者核心一样。
该病例本属局限期,有手术机会……这时如果治疗中出现放射性肺炎,有效通气面积哪怕减少一点点都可能成为「压死骆驼的最后一根稻草」
由于小细胞肺癌与吸烟关系非常密切,大部分小细胞肺癌患者都有吸烟史。吸烟时间长了往往会出现慢阻肺等疾病,肺功能变差。有一例患者我印象非常深:
这个患者来自铜川,63岁,看上去红光满面,体型微胖。右肺上叶可见一2×1.6cm,肺功能很差,气短明显,做了气管镜后没有明确诊断,我们给他做了CT引导下经胸壁肺活检,确诊为小细胞肺癌。
小细胞肺癌对放化疗较敏感,但随着治疗时间的延长,会出现耐药,耐药后生存时间往往很短。尽管该患者属于I期小细胞肺癌,有手术机会,但由于他肺功能非常差,不能耐受麻醉,因此不允许手术。同时,肺功能太差也接受不了放疗,因为放疗就可能出现放射性肺炎,导致呼吸衰竭。如果治疗中出现放射性肺炎,有效通气面积减少。哪怕减少一点,都可能像「压死骆驼的最后一根稻草」,出现呼吸衰竭。因此,该患者当时不能放疗,也不能手术,只能化疗。但化疗药物也会造成肺损伤,当时我们用了经典的EP方案,化疗两个周期后,病灶明显缩小,症状有所改善,坚持继续化疗。由于小细胞肺癌目前的标准一线治疗推荐4-6个周期的化疗,此后,就进入观察期。该患者一线治疗共做了6个周期后,效果非常好。观察到一年时,病情复发。这时的复发属敏感复发,可再用原治疗方案,但有效率明显降低。到二线治疗时,大多数患者效果不好。当时是2016年,免疫治疗(主要指免疫检查点抑制剂)刚刚面世,价格昂贵,且无适应症,该患者没有用上免疫治疗。由于小细胞肺癌目前的靶向治疗都以失败告终,因此他也没有得到靶向治疗,13个月时死亡。
如今,肺癌患者已有免疫治疗一线、二线级三线治疗的适应症,尽管患者有慢阻肺,肺功能差,容易出现免疫治疗的不良反应,但相比其他方法,如手术时麻醉的风险,放疗可能出现放射性肺炎,导致呼吸衰竭等,总体而言,免疫治疗风险相对小一些。尽管目前依然没有特别好的办法,但免疫治疗或免疫联合化疗,可能是患者生存获益的较为可行的方法。
针对小细胞肺癌的基因改变研发的靶向药物效果都不好,这些靶向药物临床前有效,一到临床试验就无效,数十个研究铩羽而归,近40年来都没有取得突破性进展
近年来,由于分子靶向治疗的出现,非小细胞肺癌治疗快速进入了一个更加精准的个体化治疗时代,随着二代测序技术应用的日益广泛,越来越多的肺癌驱动基因被发现,包含小细胞肺癌。如何看待小细胞肺癌的靶向治疗进展和未来探索方向呢?
小细胞肺癌约占肺癌总数15%左右,是肺癌中治疗效果最差的类型,属于极端恶性肿瘤,如果不治疗,患者从诊断到最后结束,大约只有3-6个月左右。小细胞肺癌因其恶性程度高而倍受大家关注,近年来相关研究很多,发现小细胞肺癌有多种基因突变,有癌基因,也有抑癌基因。抑癌基因的典型代表就是RB1基因,叫视网膜母细胞瘤基因1,几乎在所有的小细胞肺癌中都有突变,它本来应该是一个保护性基因,但它发生突变,导致患者罹患小细胞肺癌。第二个常见的基因TP53,在小细胞肺癌中表达率也非常高,大约90%以上,它与RB1基因一样,也是抑癌基因,发生突变后变成了癌基因,而且TP53基因突变以后往往治疗效果差。还有一些其他基因,如FHIT基因,叫脆性组氨酸三联体基因,这个基因和吸烟关系非常密切,吸烟的患者容易导致这个抑癌基因突变;其他如C-myc基因,这个癌基因和小细胞肺癌关系也非常密切。小细胞肺癌发现的癌基因、抑癌基因远不止这些,但到目前为止,针对这些基因设计靶向药物非常困难,有些在体外研究时有效,但一到临床试验往往无效;少数药物在Ⅰ期、Ⅱ期临床试验有效,到Ⅲ期就失败。
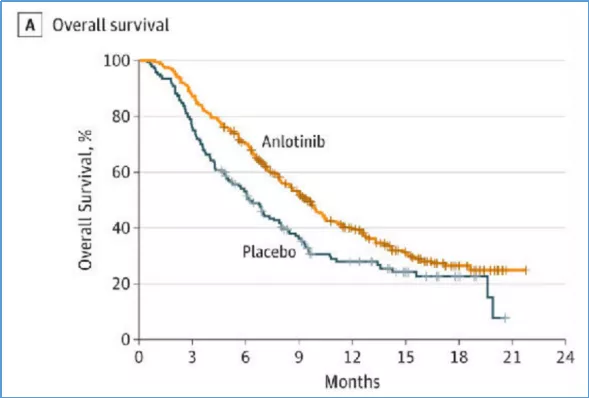
曾被寄予厚望的小细胞肺癌靶向治疗明星药Rova-T,这是一种抗体药物偶联药,MERU研究——评估Rova-T作为广泛期小细胞肺癌患者一线化疗后维持治疗的Ⅲ期临床研究,结果为阴性(因为未带来生存获益,2019年8月被建议中止研究);安罗替尼作为小细胞肺癌三线标准治疗,显著延长了OS(9.63个月 vs .6.30个月,P=0.0018);安罗替尼属于多靶点酪氨酸激酶抑制剂(TKI)。
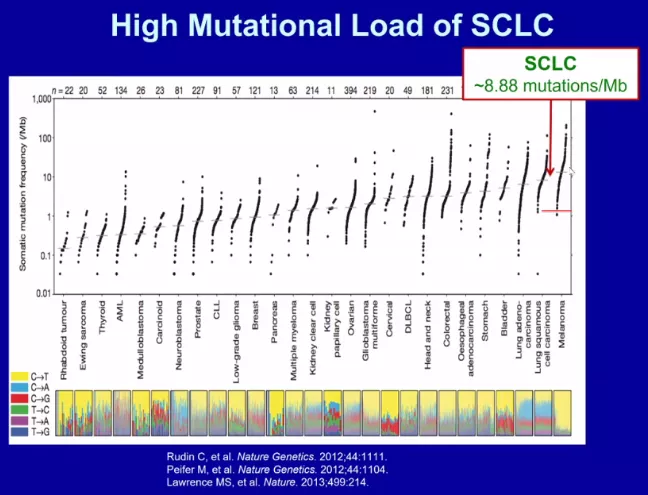
单靶点药物结果阴性、多靶点药物有效的可能原因分析:小细胞肺癌往往同时存在多种基因突变或多条信号通路激活,故针对单个基因或一条信号通路的靶向药物往往无效,而多靶点药物可能有效,如安罗替尼。研究显示,小细胞肺癌中,肿瘤突变负荷达到8.88个突变/Mb,提示免疫治疗可能有效。
针对小细胞肺癌的数十项靶向治疗研究都都铩羽而归。因此,小细胞肺癌的治疗近40年来没有任何突破性进展。
目前小细胞肺癌治疗进展以PARP抑制剂、Aurora抑制剂、BCL-2抑制剂等最受瞩目,但能否成为小细胞肺癌有效治疗药物前景依然扑朔迷离,必须对小细胞肺癌发病机制、驱动基因及生物标志物进行深入研究,免疫联合化疗是将来的方向之一
尽管小细胞肺癌靶向治疗的研究困难重重,但我相信终能柳暗花明。只是目前可能没有找到关键性的驱动基因。目前有几个方向受到各国学者的关注,但相关靶向药物研发之路崎岖坎坷:

一、PARP抑制剂。又称多聚ADP-核糖聚合酶。这个蛋白质是一个DNA修复蛋白,DNA在翻译中出错以后容易导致各种疾病,包括癌症,而PARP能够修复纠正错误,从而避免罹患癌症。它还能够影响癌细胞的自我复制,目前也是研究的热点。PARP抑制剂可通过抑制DNA的修复,促进癌细胞凋亡,增强放化疗疗效,是近年来的研究热点。但迄今做了很多研究,在小细胞肺癌治疗中都失败了。目前PARP抑制剂有三个药,一个叫奥拉帕尼,目前在卵巢癌治疗中成功了,效果较好;第二个药叫尼拉帕尼;第三个药叫鲁卡帕尼。这些药目前都是用于卵巢癌的治疗,尤其是有BRCA1或者BRCA2基因突变的卵巢癌的治疗,它是有效的。奥拉帕尼目前比较火,研究也很多。
二、抗凋亡基因BCL-2抑制剂。该基因在小细胞肺癌中表达率较高,其实在很多肿瘤中,这个基因表达都较高,它是抑制细胞凋亡的一个基因。细胞存活的时间越长,出现基因改变的几率就越大,患者得癌症的机会就越多。所以这个靶点也是目前的一个热门靶点。但其靶向药物的开发也非常坎坷,迄今至少有3-4种药临床前研究都显示有效,一到临床试验就失败了。针对BCL-2抑制剂,目前成功的例子是在血液肿瘤如慢性淋巴细胞性白血病、急性髓细胞性白血病,但在小细胞肺癌都失败了。
其实反过来看,正因为这些研究的失败,更加说明小细胞肺癌患者的发病机制复杂,个体差异大。肿瘤本身就有异质性,几乎存在于所有的肿瘤,肺癌属异质性较强的肿瘤,而小细胞肺癌的异质性尤甚。举例说明:肿瘤细胞最开始可能只是一个单克隆起源,随着疾病的发展、细胞的增生、克隆的增多,有些克隆就具备了一些倾向性,具有了自己的特点,于是它和其他的克隆细胞就不尽相同了,包括在遗传物质方面都不太一样。因此,就出现了肿瘤的异质性。可能用药之后对一部分癌细胞有效,但对另外一部分无效,无效的部分出现过度生长。因此我认为:
第一,一定要对小细胞肺癌的发病机制、驱动基因及生物标志物进行深入、系统地研究,这是源头,目前的结果只能说明我们研究得还不够充分和深入。我们对癌症,尤其是小细胞肺癌的认识只是冰山一角。
第二、小细胞肺癌可能更需要多学科联合治疗,即MDT。因为它很复杂,有异质性,我们用一种药只能控制一部分细胞,再加上其他不同作用机制的药物,效果可能会更显著一些。免疫联合化疗的治疗模式,可能是将来的方向之一。
抗原提呈和T细胞活化是当前肿瘤研究热点;活化的免疫细胞越多,人体内发挥杀灭癌细胞的效应性T细胞就越多
具体再说说免疫治疗,包括它的现状和未来的探索方向:
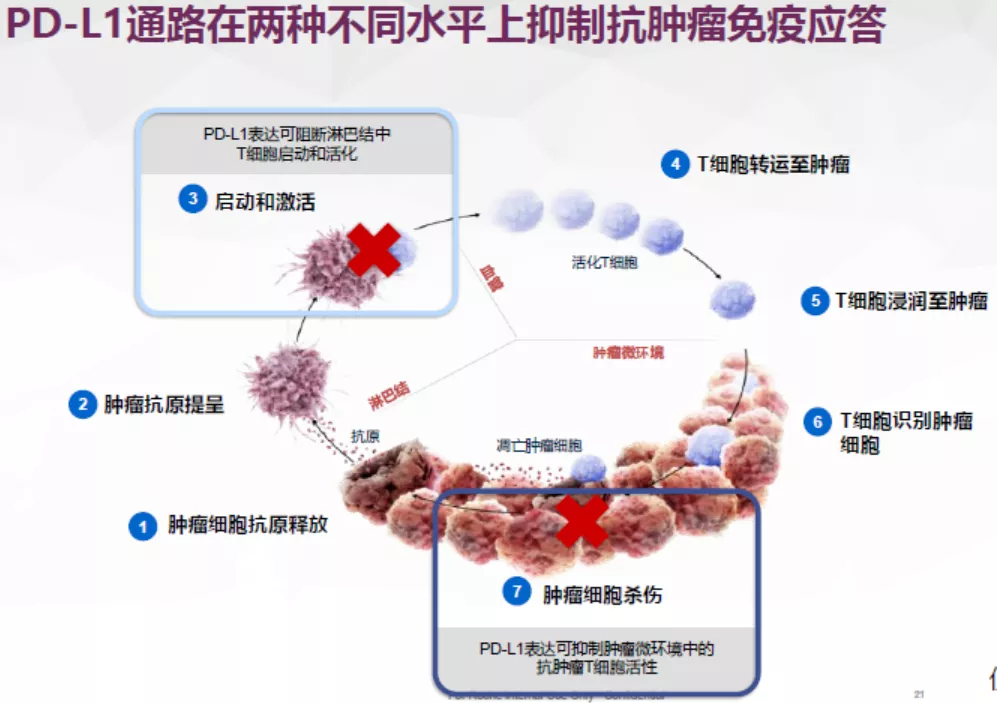
免疫治疗联合化疗的协同机制:肿瘤细胞的肿瘤相关抗原越多(TAA),肿瘤细胞的免疫原性越强,T细胞越容易活化。放化疗诱导肿瘤细胞死亡,调节肿瘤的免疫原性;PD-1/PD-L1通路可通过阻断淋巴结中新T细胞的启动和活化以及抑制肿瘤微环境中细胞毒性T细胞活性,从而抑制抗肿瘤免疫应答,PD-L1抑制剂可增强T细胞启动和活化,活化的T细胞可直接靶向作用于肿瘤细胞。如何来理解这一段话呢?
免疫细胞发挥抗肿瘤作用通常有几个步骤。第一步就是肿瘤抗原的释放。通过化疗、放疗或其他方法破坏癌细胞后,让肿瘤细胞中抗原暴露出来。目前对于肺癌来讲,还没有发现肿瘤特异性抗原,主要是TAA,抗原越多,免疫治疗的效果可能会越好。这也是免疫联合放化疗的主要原因。
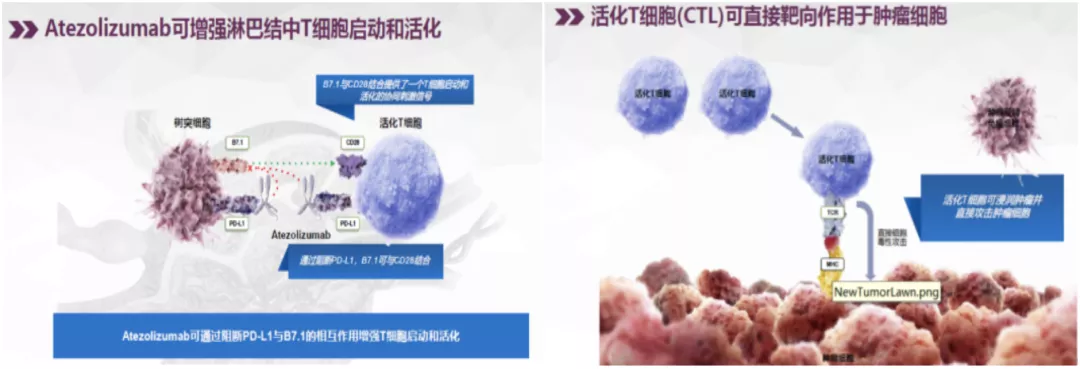
第二步是抗原提呈。抗原暴露出来了,需要把它呈递给免疫细胞。目前最主要的抗原提呈细胞(APC)叫树突状细胞,即DC细胞,它能够捕获、加工肿瘤抗原,最后呈递给T细胞。而这就是T细胞活化的第一信号。T细胞活化还需要第二信号,即T细胞上的CD28和肿瘤细胞上的CD86、CD80这些分子结合,这就是协同刺激信号。也就是说,T细胞活化需要两个信号,第一信号和第二信号,第一信号是抗原,第二信号是协同刺激分子。这两个信号都具备了,T细胞就活化了。我们人体消灭肿瘤细胞主要依靠T细胞,尤其是CD8+T细胞,也叫细胞毒性T淋巴细胞(CTLs)。CTLs活化的数量越多,消灭肿瘤细胞的作用就越强。活化的T细胞就会变成效应性T细胞。因此,效应性T细胞越多,杀灭肿瘤的作用就会越强。另外,约5%的效应性T细胞会变成记忆性T细胞,从而持续发挥抗肿瘤作用。这就是免疫治疗疗效持续时间长的原因。
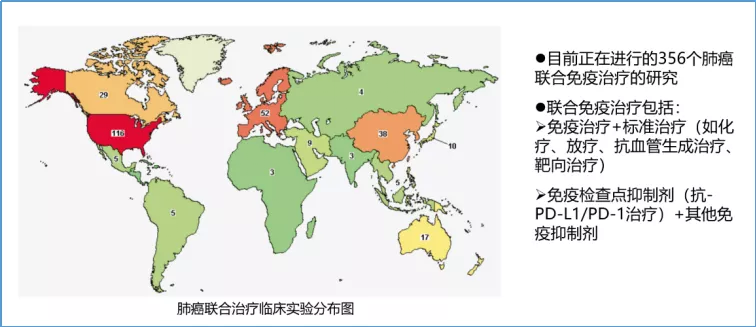
由于肺癌属弱免疫原性较肿瘤,所以,采取基因工程的方法对树突状细胞(DC)、T细胞进行基因修饰,增强DC抗原识别、处理和呈递能力,提高T细胞结合抗原的能力,增强活化信号的转导,延长T细胞在体内的生存时间,提高免疫治疗的效果。另外,活化的T细胞还会产生干扰素-Ƴ,干扰素-Ƴ可以促进APC细胞表达MHC II类分子,更多更好的呈递抗原,同时促进T细胞的分化。2种或多种方法联合可以显著提高免疫治疗的有效率,延长患者生存时间。全球正在进行中的初期基础试验及临床研究约有300余项,在SCLC免疫联合治疗的探索中,有多种联合治疗方式(免疫联合化疗;免疫联合放疗;免疫联合免疫;免疫联合靶向等)。这些是目前免疫治疗研究的热点。
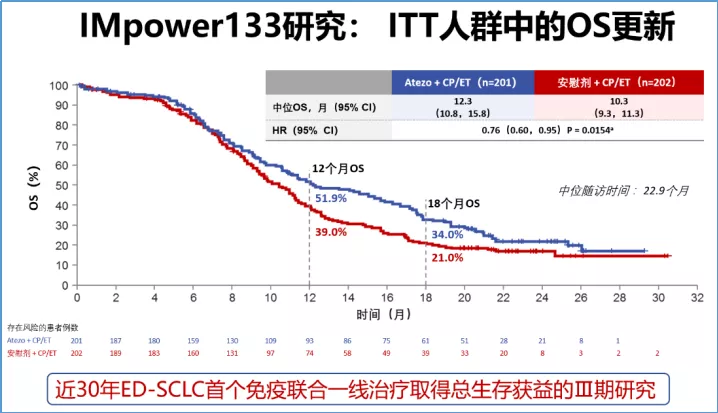
目前免疫治疗的临床研究结果:免疫治疗联合化疗用于广泛期小细胞肺癌一线治疗,如IMpower-133研究的阿替利珠单抗+EC方案,是近40年来广泛期小细胞肺癌首个免疫联合化疗,一线治疗取得PFS和OS双获益的Ⅲ期研究,让小细胞肺癌患者的中位OS延长到一年以上,而且在更长的随访中生存持续获益,超过1/3的患者OS超过18个月!该药近期在中国获批,可惠及更多国内患者。
「双免疫」治疗目前在黑色素瘤、非小细胞肺癌、小细胞肺癌等肿瘤中都获得成功,但并不代表免疫治疗中的每一种方法都能「包打天下」,适应症和获益人群的筛选尤为重要
免疫单药ORR较低(一线20%-45%,二线15%-18%左右)。为了提高有效率,免疫和其它方法联合是目前的热点。前面讲的是联合化疗、放疗两种主要方式。第三种方式就是免疫联合免疫。
我们现在说的免疫治疗,主要是指免疫检查点抑制剂(ICIs)。其实免疫治疗这个概念非常大,有主动免疫、被动免疫。其中目前最主要的就是ICIs,属主动免疫。2018年,美国的艾利森和日本的本庶佑获得诺贝尔奖就是因为他们发现了CTLA-4/B7信号通路和PD-1/PD-L1信号通路。这两条信号通路都是抑制性通路,不管哪一条通路激活后,都能抑制T细胞的生成和活化。事实上,华裔学者陈列平教授在免疫治疗方面也作出了很大贡献。他发现了B7-H1(PD-L1)和和B7-DC(PD-L2),前者成为免疫治疗中非常重要的明星分子,但他把PD-L1称为B7-H1,与国际上主流的名称不一样。
我们目前开发的药物更多的是PD-1单抗和PD-L1单抗。PD-1/PD-L1信号通路起作用相对来讲时间上较晚,而CTLA-4这条信号通路起作用时间较早。所以,这两条信号通路联合抑制有基础,这就是「双免疫」。双免疫治疗目前在黑色素瘤、在非小细胞、在小细胞肺癌,还有其他的多种肿瘤中都获得了成功。
尽管双免疫治疗目前获得了成功,但我认为适应症和获益人群的筛选尤为重要。因为免疫治疗药物再多,每一种方法都并不能「包打天下」。能够把哪一部分患者适合免疫治疗,适合哪一种免疫药物筛选出来,这样接受治疗的患者疗效更好,副作用更小,费用更少。
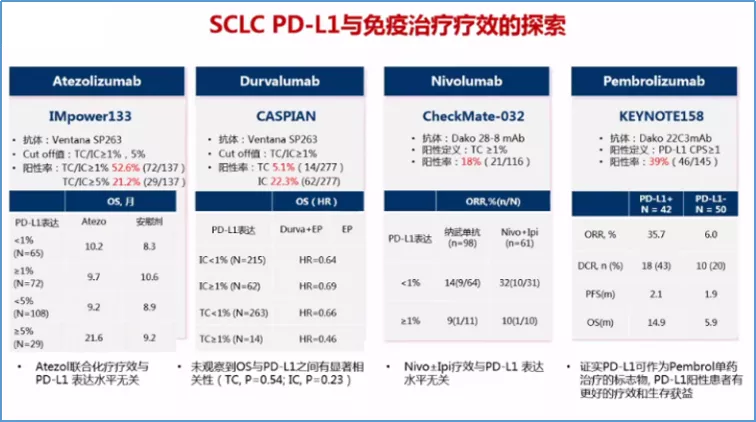
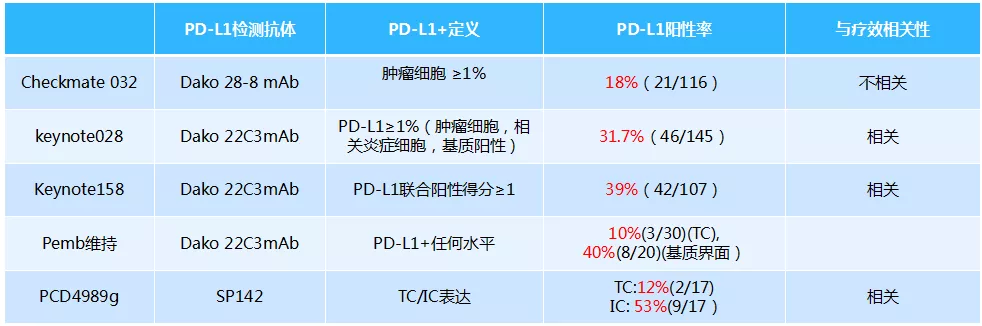
目前来看,预测免疫药物疗效的标志物最好的还是PD-L1,不管是PD-1单抗还是PD-L1单抗,基本上都符合这个规律,当然更符合这个规律的是PD-1单抗,尤其是帕博利珠。如果肿瘤细胞上PD-L1表达在50%以上,就叫高表达;如果是1%到49%,就是中低表达;如果检测PD-1是阴性,就叫阴性表达。阴性表达、中低表达到高表达,患者生存获益都不同,表达越高生存获益越多,OS越长。而对于免疫治疗,我们更重要的就是看OS、DOR及HR。对于PFS来讲,它的价值是有限的。
而对于TMB/bTMB:根据IMpower-133研究,bTMB对于Atezo疗效无预测作用,无论是以10或16 mut/Mb为拐点,bTMB高组和低组之间的OS似乎没有显著差异;但对于nivolumab + ipilimumab的双免疫检查点抑制剂,可能是一个有价值的预测标记物。可能的原因是小细胞肺癌的免疫微环境和非小细胞肺癌有很大不同:虽然TMB很高,缺少有效的肿瘤新抗原,同时抗原呈递过程也可能存在缺陷,不能产生有效的免疫应答。
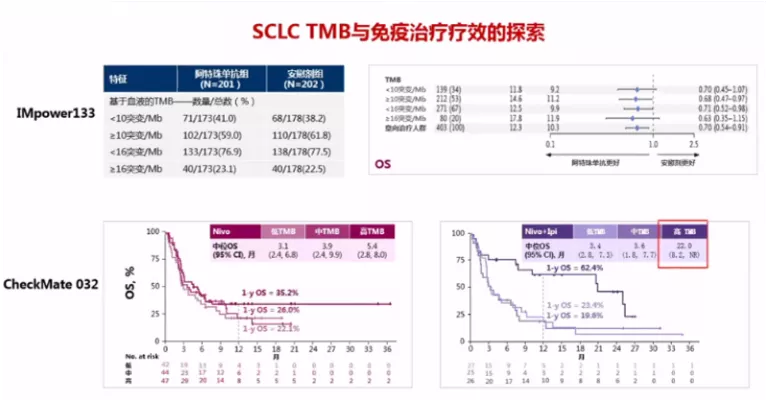
TMB就是肿瘤突变负荷,是目前仅次于PD-L1的免疫治疗疗效预测标志物,主要适用于那武利尤单抗。有一个代表性研究,Checkmate 227研究,这是TMB的首个前瞻性研究。其定义每100万个碱基中有10个或以上的碱基发生突变,就叫TMB高;小于10就叫TMB低。结果发现,TMB高的患者使用那武利尤单抗疗效比较好,或者是那武利尤单抗联合伊匹单抗效果比较好。这就为PD-L1弱表达甚至阴性表达的患者争取了一线生机:对于这类患者可行TMB检测,如果TMB≥10mut/Mb可以一线采用PD-1/PD-L1抑制剂联合CTLA-4抑制剂治疗。之后,CheckMate-026、POPLAR和OAK研究同样采用TMB作为筛选指标再次分析入组患者,进一步明确了TMB越高免疫治疗获益越大这一结论。
这个指标目前主要通过二代测序检测血液,不像PD-L1检测很方便,用免疫组化检测,花费很小,时间也短。因此,TMB作为小细胞肺癌免疫治疗的预测标志物,还需更多探索。
小细胞肺癌免疫靶向四药联合是不是一个探索方向?ICIs+抗血管生成治疗+化疗;用于非小细胞肺癌的IMpower150研究带来的思考……
四药联合经典的研究,是关于非小细胞肺癌的研究,即IMpower150研究,是用免疫联合贝伐珠单抗,再联合化疗,一共4个药,这个研究获得了阳性结果。
目前广泛期小细胞肺癌新的标准治疗就是免疫联合化疗,我认为可以在我们的临床研究中,设计一些和标准方案的对比研究。比如在这个方案里加一个除贝伐珠单抗外的抗血管生成药物。这个方案的优化有几个方面:
一、从方案本身来优化,就是加一个抗血管生成药如安罗替尼或阿帕替尼或恩度等。另外,这个方案在应用时,提前3-5天用抗血管生成药物后再用化疗和免疫。因为肿瘤有一个特点,血管不正常,结构不完整,我们先加一个抗血管生成药以后,让血管正常化以后,肿瘤内压力减小,药物就容易扩散到肿瘤组织。也就是说,在免疫联合抗血管双重肿瘤微环境调整的基础上联合化疗,目前我国正在探索免疫靶向四药联合的模式。观察疗效如何,副反应有无增加,尤其是严重的毒副反应有无增加。
二、对于局限期小细胞肺癌,目前的标准治疗是同步放化疗,这种方案很多患者体质上都接受不了,尤其是年龄偏大及有合并症的患者。所以,对这一部分患者能否把免疫联合化疗这个方案也推广到局限期小细胞肺癌。

其它,如PD-1/PD-L1抑制剂联合DDR(DNA损伤修复基因,这是一类基因,如BRCA1,BRCA2,TP53,MSH2等)抑制剂、MYC抑制剂等,都是将来可以作为临床探索的方向。
该病例告诉我们,小细胞肺癌早发现一定不能依靠胸片,要以低剂量CT(LDCT)为标准,40岁以上尤其长期吸烟者更要每年定期检查……临床经验总结的这七点可作为肺癌自我发现的手段
值得一提的是,对于局限期小细胞肺癌,目前的标准治疗方案同步放化疗效果确实较好,但它的毒副作用也较大,很多患者无法耐受,尤其是有合并症的患者,该方案达不到。大多数患者做的是序贯治疗,先化疗再放疗。关于免疫治疗,个人认为在小细胞肺癌介入的时机,一线就可以使用。任何一种方法,只要发现确实有效,越早用越好。现在关于免疫治疗的临床研究,入选的患者PS评分都是0-1。因此,临床实践中,选择免疫治疗也要适当考虑PS评分。
肺癌的早发现、早诊断非常重要。以小细胞肺癌为例,目前约5%患者能够手术。所有人都应当有体检的意识,尤其40岁以上、长期吸烟人群更要重视每年的体检。我们推荐40岁以上人群要每年定期体检,尽可能作CT。低剂量CT(LDCT)是标准方法。举一个发生在我身边同事身上的例子:
2020年3月,我的一个大学同学,体检时照了一个胸片,报告正常。胸片做完时间不长,他就出现咳嗽症状近一个月,抗炎治疗效果不好。他做了一个普通CT,拿片子来让我看。CT显示,右肺中叶不张,纵隔淋巴结广泛肿大融合,显然这是一个晚期肺癌的表现。我告诉他,赶快做气管镜。气管镜做出来一看,小细胞肺癌。现在,他正在做第三个周期化疗。尽管是局限期,我也建议加免疫治疗,把阿替利珠单抗加上,他有点犹豫,他始终认为只要能手术,就可能治好。我认为手术不适合,最好的治疗方案是可能是同步放化疗加免疫。最后他慢慢接受了。
关于肺癌早发现早诊断,我非常想强调肺部小结节。我的观点是肺小结节一定要高度重视,少数孤立性肺小结节可能是早期肺癌,并且在我们的临床实践中,现在孤立性肺小结节的发生率比较高,性质难定。我们可以通过仔细观察征象,知道哪些一定要高度怀疑肿瘤:
一、混合性磨玻璃影要高度小心早期肺腺癌,而越是实性结节、密度越高的结节,恶性肿瘤的概率越小;
二、边缘光滑的结节一般恶性几率不大,但如果是边缘清晰的一个磨玻璃影,有分叶,有血管、支气管进入,恶性的可能性较大,哪怕是小于5毫米,都要格外小心。
一般来讲,国内外的指南公认5毫米以下的肺小结节恶性的可能性不足10%,对5毫米以下的结节,推荐年度体检,一年做一次CT。但光凭大小判断并非绝对,主要观察界限是否很清楚?是否有分叶?是否有毛刺?是否有血管进入?是否有支气管进入?磨玻璃影中间逐渐出现实性成分了,标志着它可能已经恶变了。所以,影像学征象是非常重要的。
经验告诉我们:
1、一定体检要重视,尤其是40岁以上,并且检查肺部一定要做CT,最好是LDCT。做胸片至少漏诊30%;
2 、原本不咳嗽,现在咳嗽的时间超过两周,且抗炎治疗没有效果;
3、年龄在40岁以上的人群,无原因痰中带血,尤其是带血丝,持续或间接性;
4、消瘦,但无糖尿病、结核和甲亢等消耗性疾病,尤其是当体重比之前减轻5%时,要警惕恶性肿瘤;
5、肺脏同一部位反复发生炎症;
6、咳嗽性质变了,尤其是音调变高了,或出现刺激性咳嗽;
7、发热,胸片或CT 发现阻塞性肺炎,抗炎治疗效果不好;
8、肺脏同一部位医生听诊发现持续性喘鸣;
9、肺部发现小结节,尤其是混合型磨玻璃结节。
专家介绍
杨拴盈
一级主任医师,教授,博士生及博士后导师。西安交通大学第二附属医院呼吸与危重症医学科主任。教育部新世纪优秀人才。中华医学会呼吸分会委员;中华医学会呼吸分会肺癌学组委员;;中国呼吸医师协会肺癌工作委员会委员;国际肺癌研究会会员;《中华结核和呼吸杂志》、《中华肺部疾病杂志》、《中国肺癌杂志》、《国际呼吸杂志》《现代肿瘤医学》、《中国呼吸与危重症杂志》、《西安交通大学学报(医学版)》常务编委或编委。主持国家自然科学基金4项,发表论文182篇,SCI 53篇,获省科技进步二等奖2项,主编专著1部,参与制定肺癌诊疗相关指南、共识13部。


