一、小细胞肺癌疾病特征
小细胞肺癌是肺癌其中的一种分型
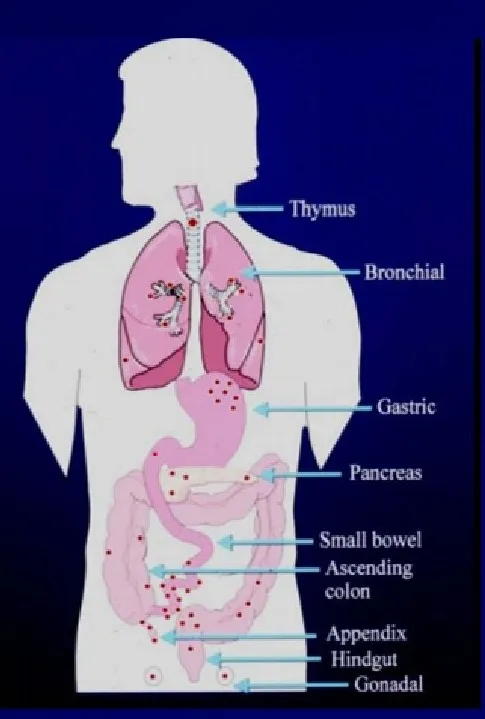
小细胞肺癌的起源不明,一般认为小细胞肺癌起源于支气管粘膜或腺上皮内的Kulchitsky细胞(嗜银细胞)。从肺癌的组织学分型来说,分为腺癌、鳞癌、小细胞肺癌和大细胞肺癌,小细胞肺癌约占肺癌的15%,SCLC的亚型包括小细胞癌与合并的小细胞癌(含NSCLC成分的SCLC)。从2015年WHO的神经内分泌肿瘤分型来看,类癌可以分为典型类癌和非典型类癌,其中肺癌约占神经内分泌肿瘤的20%,SCLC占绝大多数,约为15%。
侵袭性、高级别神经内分泌肿瘤,肺癌中预后最差的类型
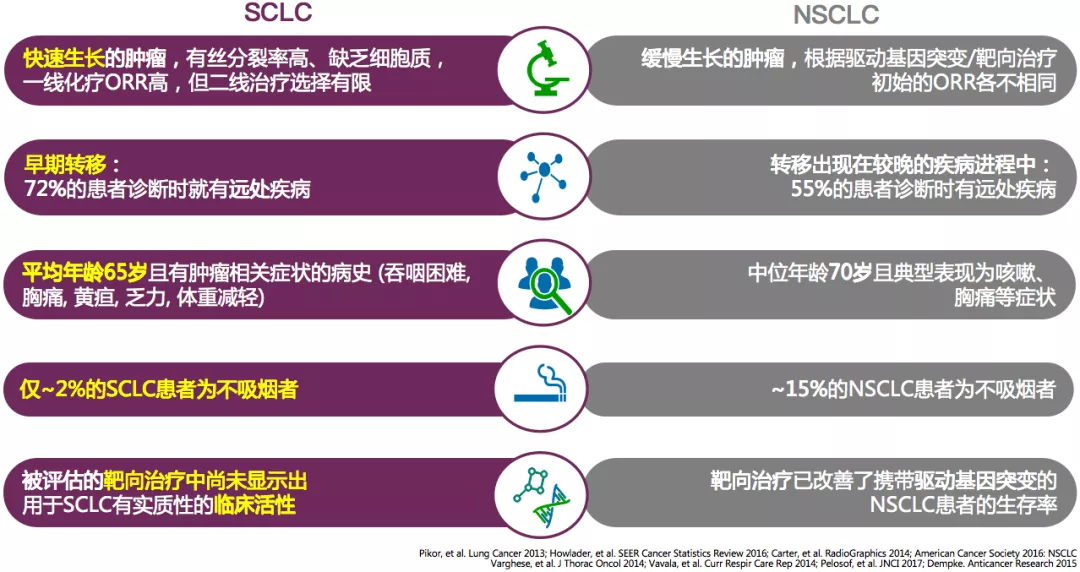
小细胞肺癌是一种低分化神经内分泌瘤,约占肺癌的15%-20%,高度恶性。发病年龄较轻(40-50岁),几乎都是吸烟患者。小细胞肺癌的生长较快,侵袭力较强,转移发生早。对放疗和化疗较敏感,对初始化疗高度敏感,但大部分患者2年内出现疾病复发。SCLC的生存率较低(与NSCLC比较,5年生存率:6% vs. 21%)。

小细胞肺癌通常见于主支气管和叶支气管,约70%病例表现为肺门周围肿块。患者典型表现为瞬时记忆、呼吸困难的症状与持续咳嗽,或者是痰中带血,与吸烟有一定的相关性。
病理表现
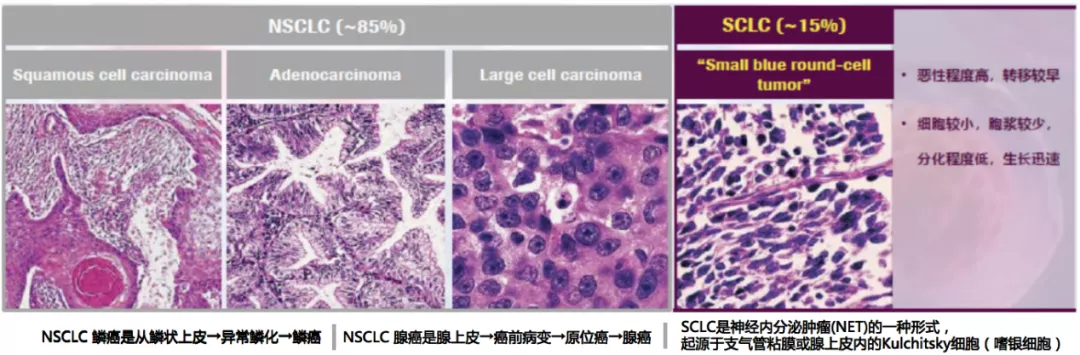
SCLC是神经内分泌肿瘤(NET)的一种形式,NET可分为SCLC、大细胞神经内分泌癌、非典型癌与典型癌。SCLC的亚型包括小细胞肺癌与混合小细胞肺癌(含NSCLC成分的SCLC),混合型小细胞肺癌占所有SCLC病例的10~25%。
相比较于NSCLC:截然不同的两个癌种
多基因变异,无驱动靶点
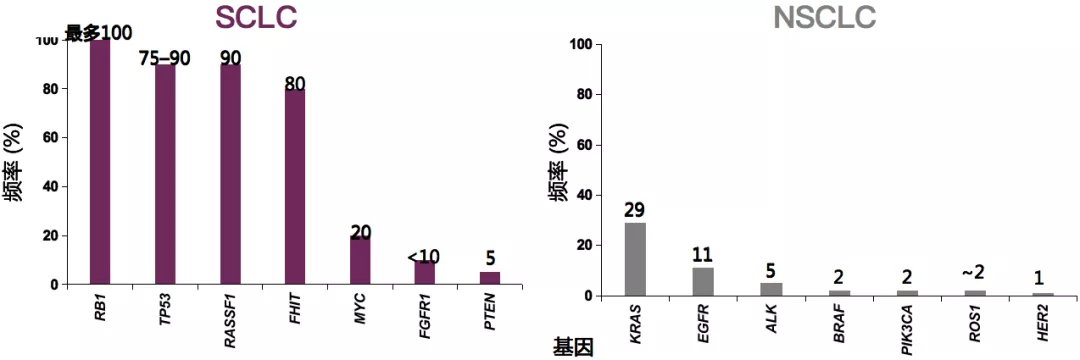
SCLC的特征是多个基因变异,突变通常都是很差的治疗靶点,包括RB1、TP53等。与NSCLC发现了驱动基因并且靶向药物成功治疗不同,SCLC的变异没有获批的靶向药物。基因变异的表达可重叠,因为它们并不是相互排斥的。
二、小细胞肺癌三十年沉浮
三十年道阻且长:治疗领域存在巨大未被满足需求
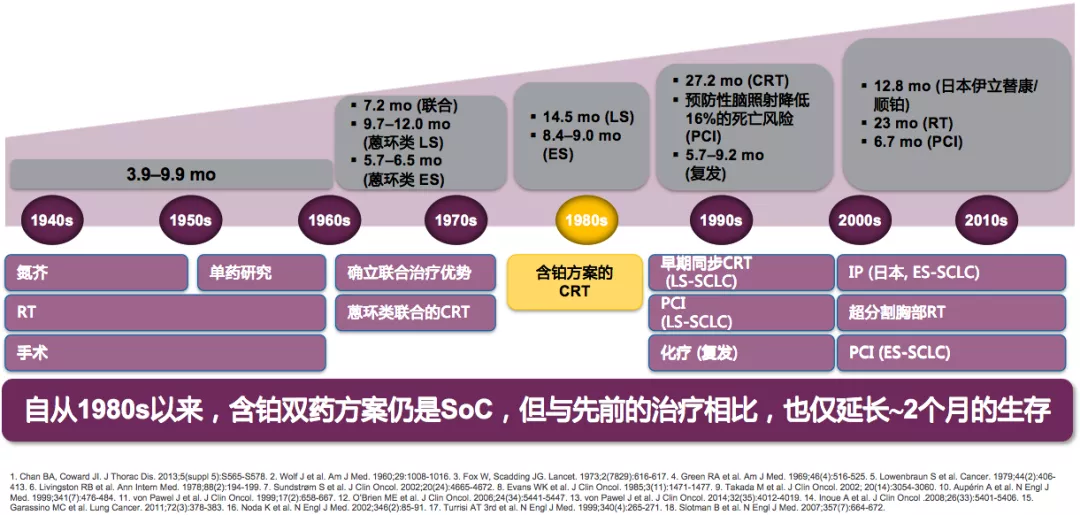
小细胞肺癌经过30年历程,很多上世纪的临床研究还在进行。但是到目前为止,至少在前几年都没有非常好的用于临床的其他治疗方法。1980s以来,含铂双药方案仍是小细胞肺癌的标准治疗,但与先前的治疗相比,比如全脑放疗、胸部放疗等,总生存期仍未突破一年。所以,治疗领域中的需求并没有被满足。
曾经在靶向治疗后,有很多基因突变的患者可以选择不住院,在家里就能得到很好的治疗,只要到医院随访就可以。有段时间病房里有很多小细胞肺癌患者,因为年龄相对较轻,以中央型为主,呼吸道症状会非常严重,没有好的药物用于治疗,含铂双药仍然是小细胞肺癌的标准治疗。
SCLC化疗的前世今生
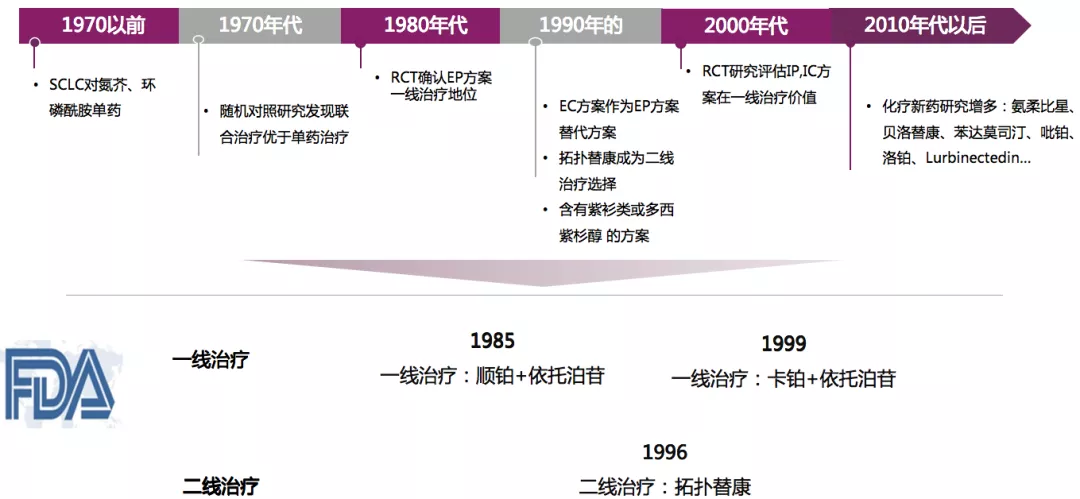
回顾小细胞肺癌的一线、二线治疗来看,从80年代到90年代末,一线治疗的标准方案为顺铂+依托泊苷或卡铂+依托泊苷。1996年,二线治疗可以加入拓扑替康。
1985:首次确认依托泊苷+铂类一线治疗SCLC标准地位
在加拿大4家研究中心进行的一项多中心临床试验,确立了EP方案在SCLC一线治疗中的地位。
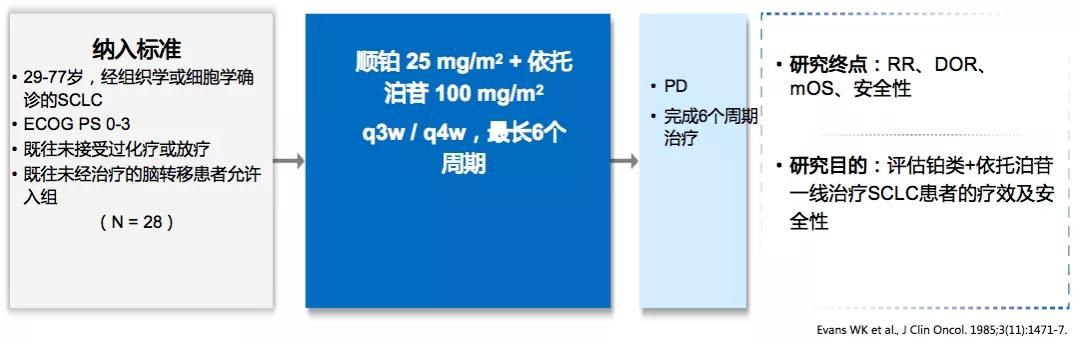
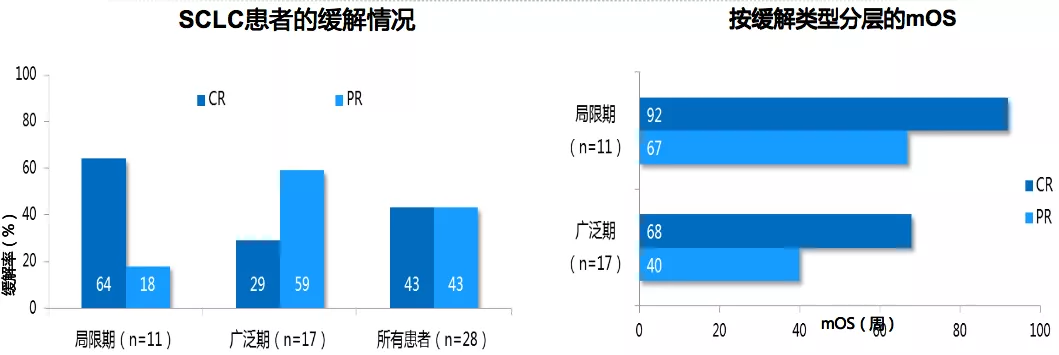
这个化疗方案最早于1985年发表在JCO上,当时只入组了31名患者,其中20名广泛期的SCLC患者。在最后可评估的28名患者中,CR率和PR率都达到了43%。这给EP方案一线治疗提供了有力的支撑。后来研究者们又试图寻找更强有力的化疗组合方案。将伊利替康联合卡铂方案(IP)与EP进行比对,发现IP方案也并不次于EP方案。
这给ES-SCLC患者又增加了一个化疗选择。但总体上来说,不管是EP方案还是IP方案,ES-SCLC患者的mOS仅能达到10个月左右。虽然ES-SCLC患者对化疗的ORR很高,但是疾病又会很快进展,PFS非常短。这也是小细胞癌的一个特性,即对放化疗敏感,但又很快进展,疾病控制时间短。
结论:这些结果较标准诱导化疗方案更佳,推荐将依托泊苷+顺铂作为禁忌使用以阿霉素为基础的化疗的SCLC患者的一线治疗方案。
历经数十载:一线治疗依旧局限于铂类化疗,生存获益有限

广泛期SCLC化疗近期疗效高(ORR60%-70%),但进展快。如果停止治疗,可能在一两个月中病灶复发。中位PFS ~6月;OS ~10月。所以生存有限,近期的治疗效果好,但是对于PFS和OS而言,如果病人能耐受不断地、反复地化疗和放疗,可能还能得到一定时间的稳定。
ES-SCLC二线治疗疗效有限
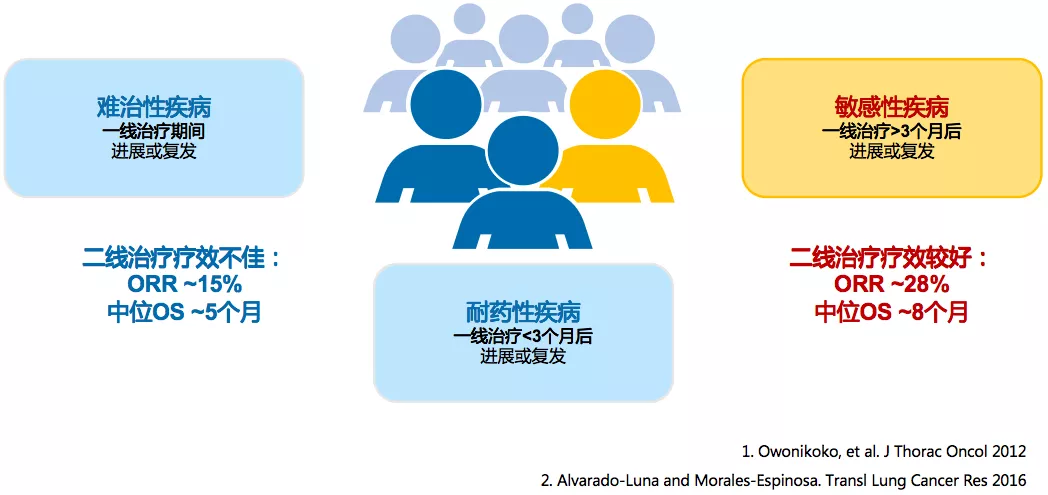
SCLC对化疗敏感,但绝大部分SCLC患者都会复发。
2012年,SCLC第二个研发阶段
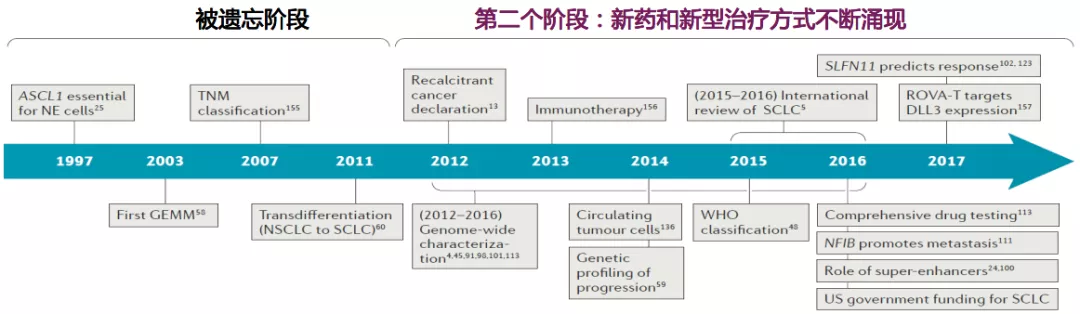
从1997年开始,对SCLC的研究戛然而止,没有新的药物或治疗的探索,SCLC进入了被遗忘的阶段。直到2012年,美国国会定义SCLC为难治性疾病,世界范围内掀起了转化研究的热潮,很多潜在的分子靶点/信号通路被发现,甚至进入临床研究,新的药物和治疗方式不断涌现,SCLC进入第二个黄金阶段。2012年,SCLC开启了免疫治疗的篇章,试验药物逐渐丰富,治疗方式逐渐多样,为SCLC的治疗带来了新希望。
美国国家癌症局对于SCLC的定义以及美国NCI对SCLC攻克计划

由于SCLC的疾病恶性程度,美国国家癌症局通过了「难治性癌症研究法案」,将SCLC定义为「反抗的,顽固的、高度侵袭性肿瘤」。
除新药探索,该科学计划确定了五项针对SCLC的举措:①组织收集的新工具和新的肿瘤分期模型;②SCLC的基因组分析;③为有较高患病风险的人提供新的诊断测试;④基于分子分型的疗法;⑤对SCLC治疗有效性和耐药性的因素的研究。
相关研究的常见药物靶点
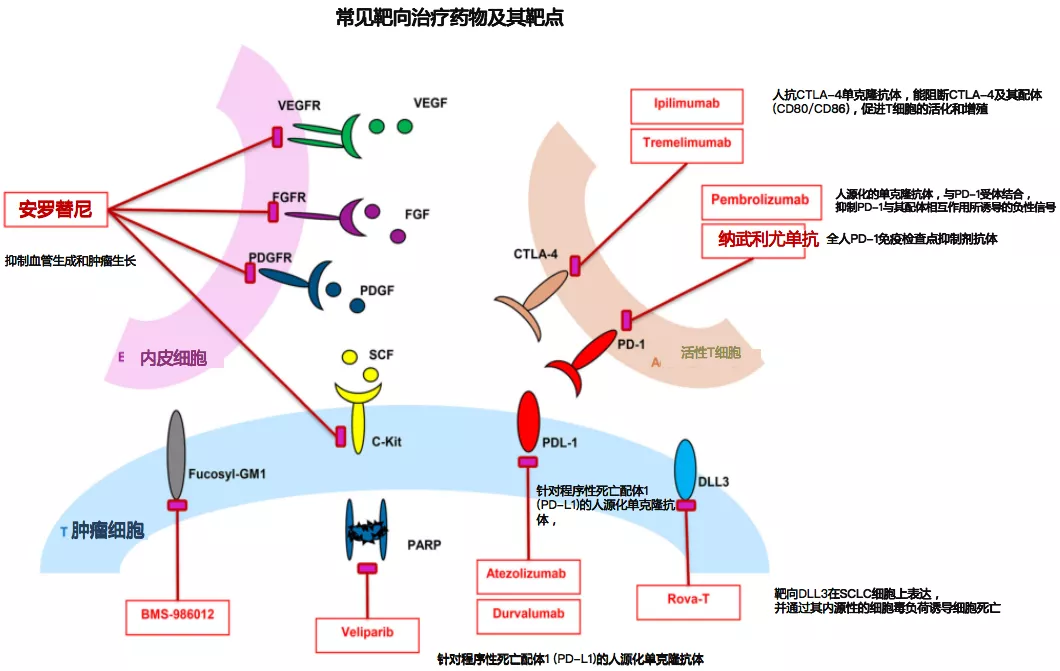
SCLC相关的常见药物靶点包括:抗血管生成相关靶点包括:VEGFR、FGFR、PDGFR等;免疫相关靶点包括:CTLA-4、PD-1;作用于SCLC细胞周期的主要靶点包括:Fucosyl-GM1、PARP、PD-L1等,PD-L1是一种通过与PD-1受体结合来负调控T细胞活化和增殖的抑制性配体。上述靶点为SCLC药物研发提供了方向。针对这三类常见的药物靶点进行相关临床研究,看看能否找到治疗小细胞肺癌的良好的手段。
分子靶向治疗SCLC的试验多以失败告终
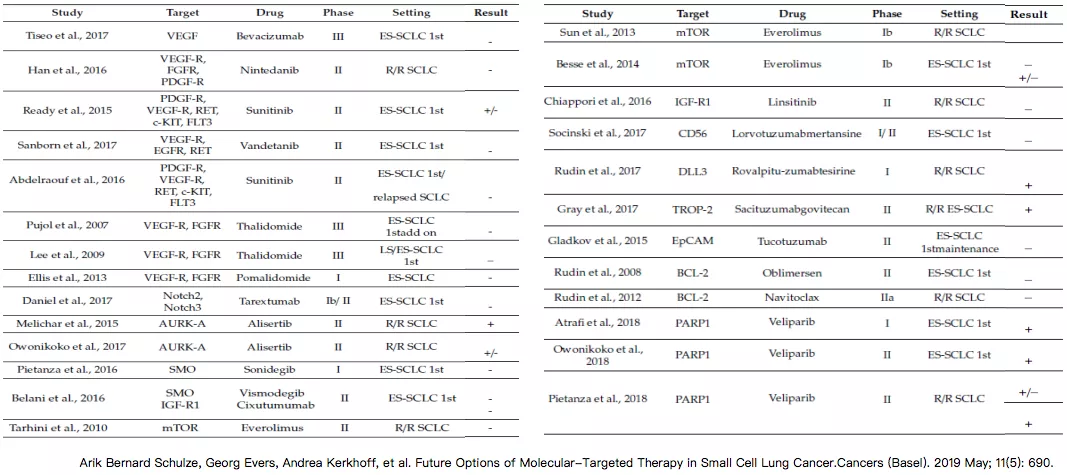
因为分子靶点突变比较多,所以研究以后均没有得到临床的疗效,以失败而告终。失败的原因包括SCLC遗传变异复杂,单靶点的抑制对小细胞肺癌治疗作用有限,因为它可能有多靶点共存,以失败而告终。
总结:过往40年,SCLC研究及治疗发展历程甚少突破 靶向探索失败。
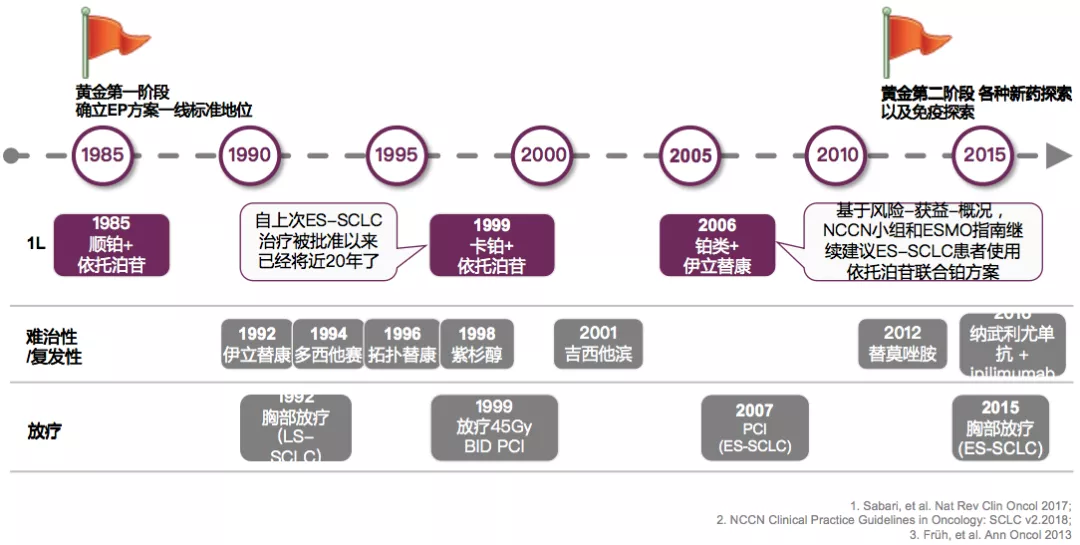
三、小细胞肺癌的免疫史:免疫时代的新标准
SCLC免疫治疗的崛起
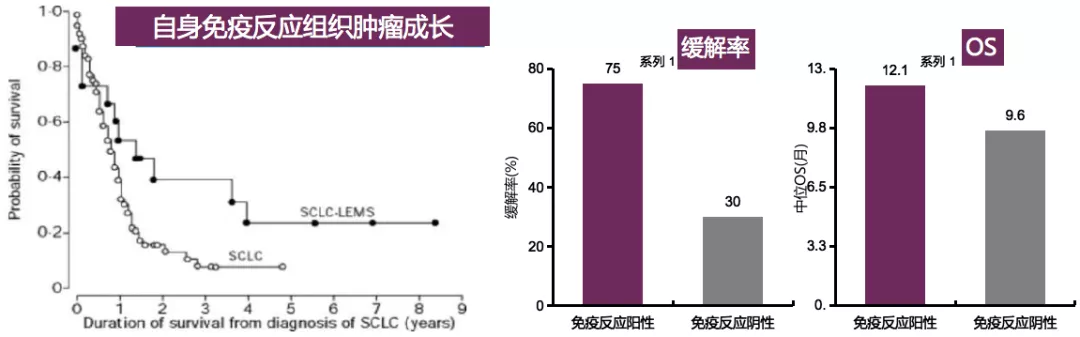
1999年,《The Lancet》发表文章首次揭示了免疫与SCLC患者生存之间的关系。如果是小细胞肺癌合并肌无力综合症的患者相对于单纯小细胞肺癌来说,合并肌无力综合症的患者的生存时间可以达到17.3个月,一般的小细胞肺癌为10个月。因为肌无力综合症与电压依赖性钙通道有关,所以从这个文献中提示自身免疫反应组织肿瘤成长,可能自身免疫性疾病的患者治疗过程中疗效会好。
另外,TP53相关的疫苗治疗后,免疫反应阳性的小细胞肺癌患者对后续化疗的缓解率和免疫反应阴性相比,分别为75%和30%;免疫反应阳性的中位OS也比免疫反应阴性的中位OS高,分别为12.1个月和9.6个月。因此,疫苗治疗后免疫反应阳性的SCLC患者对后续化疗的缓解率高,且该研究提示免疫治疗在SCLC上或许也有一定的长尾效应。
肿瘤免疫循环是所有肿瘤免疫治疗的基石
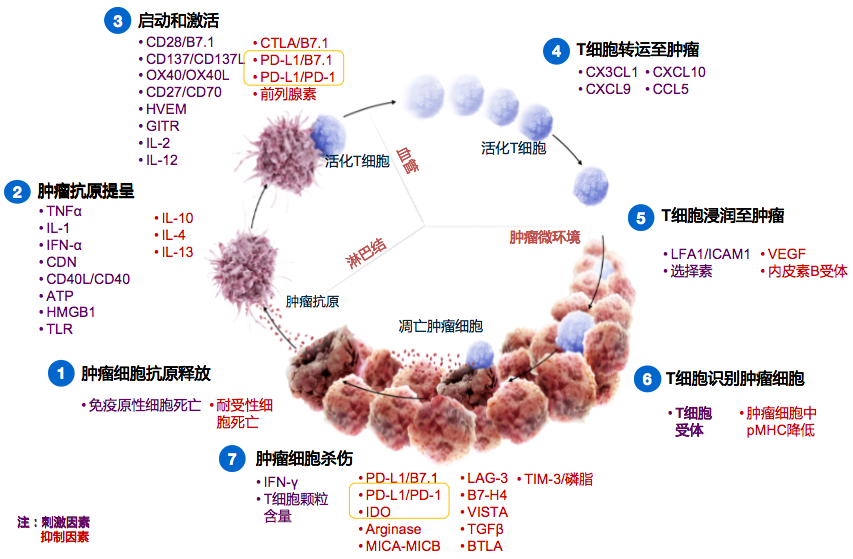
肿瘤免疫包括肿瘤细胞抗原释放、肿瘤抗原提呈、启动和激活、T细胞转运至肿瘤、T细胞浸润至肿瘤、T细胞识别肿瘤细胞、肿瘤细胞杀伤。
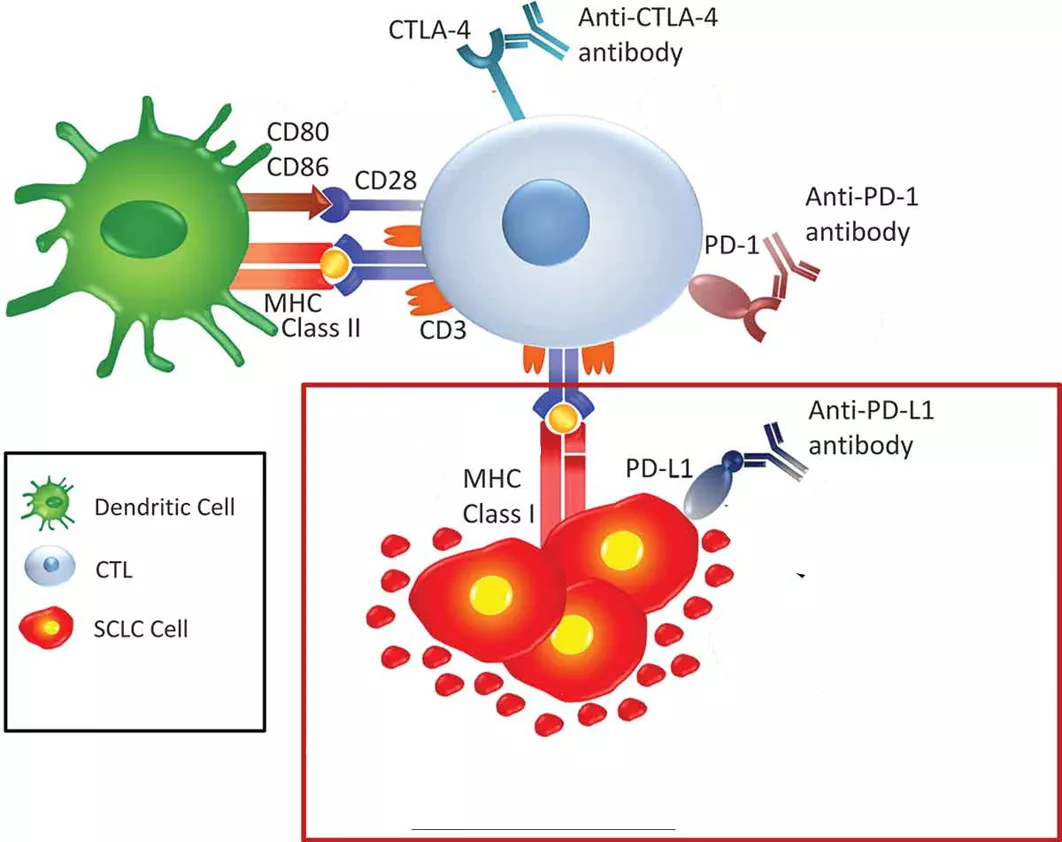
肿瘤细胞微环境包括血管、免疫细胞、成纤维细胞、骨髓来源的炎症细胞、细胞外基质等整个免疫循环的正/负调控因子,他们共同决定着免疫治疗的疗效。
98%SCLC吸烟相关,TMB高表达,显示高免疫原性
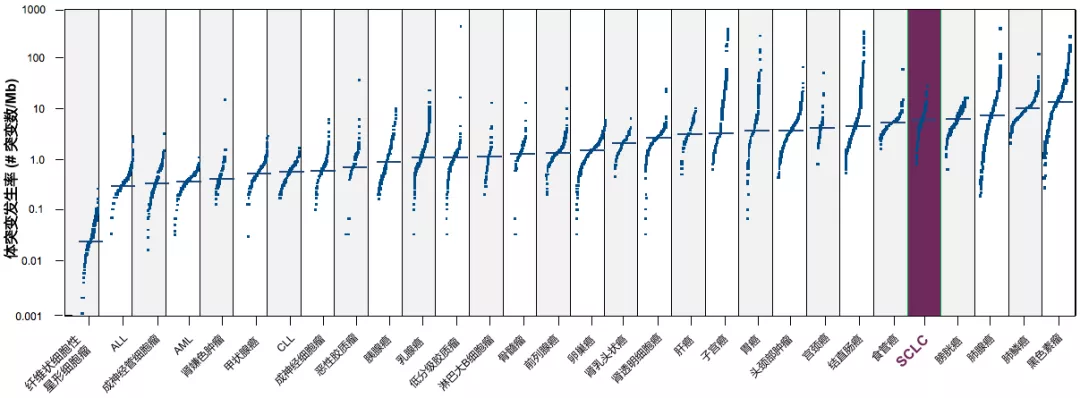
已在多个瘤种中观察到TMB与肿瘤免疫治疗疗效相关,包括NSCLC、膀胱癌、结直肠癌和黑色素瘤。
SCLC是具有免疫原性的肿瘤
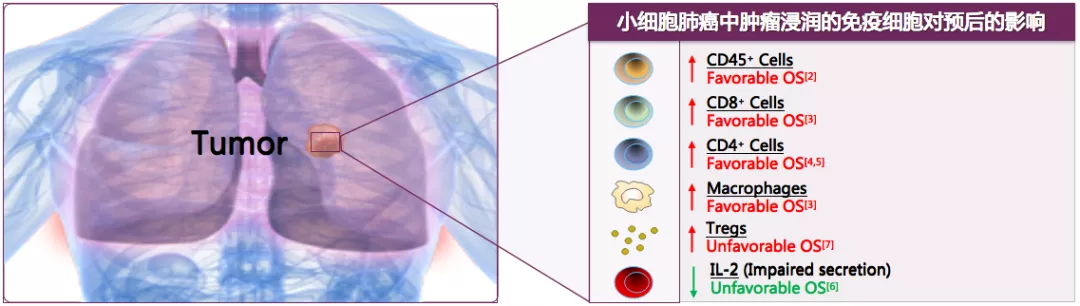
尽管免疫系统受到抑制,但存在针对SCLC肿瘤持续的免疫反应。比如小细胞肺癌中肿瘤浸润的免疫细胞对预后的影响,包括CD45+、CD8+、CD4+等。所以,不同的免疫细胞浸润小细胞肺癌,对预后的影响也不同,但白细胞介素-2是一个不太好的指标。
免疫治疗为小细胞肺癌带来了希望
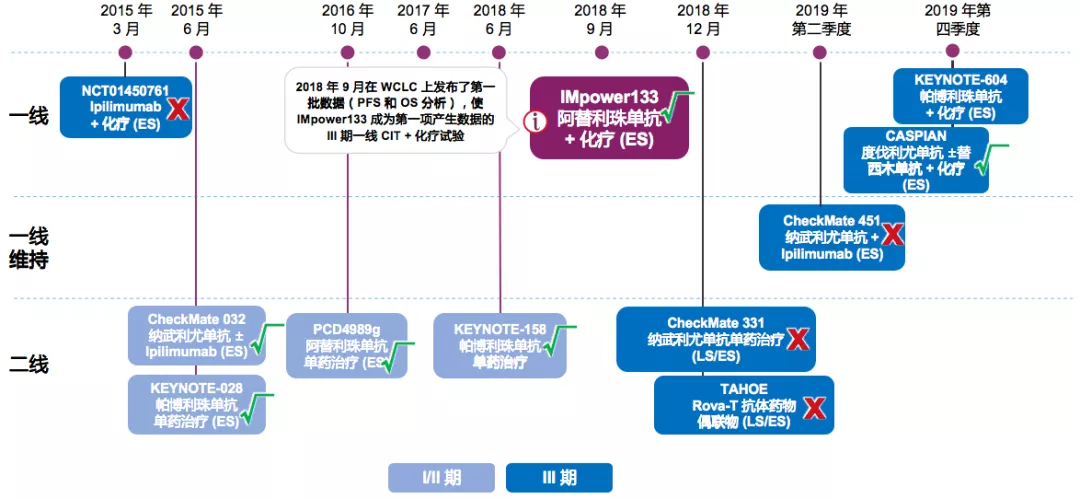
基于上述的前期的研究,免疫治疗为小细胞肺癌带来了希望。在2018年9月在WCLC上发布了第一批数据(PFS和OS分析),使IMpower133成为第一项产生数据的III期一线CIT+化疗试验,这是一个非常好的临床结果。还有2018年的IMpower133阿替利珠单抗+化疗(ES),2019年的CASPIAN度伐利尤单抗±替西木单抗+化疗(ES),验证了免疫治疗对于小细胞肺癌的疗效。
II期Keynote158和Ib期Keynote028汇总:帕博利珠单抗治疗后线SCLC
选择人群是对既往治疗失败或进展、PD-L1表达大于等于1%的SCLC患者表现出一定的抗肿瘤活性和持久反应。纳入131例SCLC患者,83例患者符合疗效分析的条件,36%的患者接受了≥3线治疗。
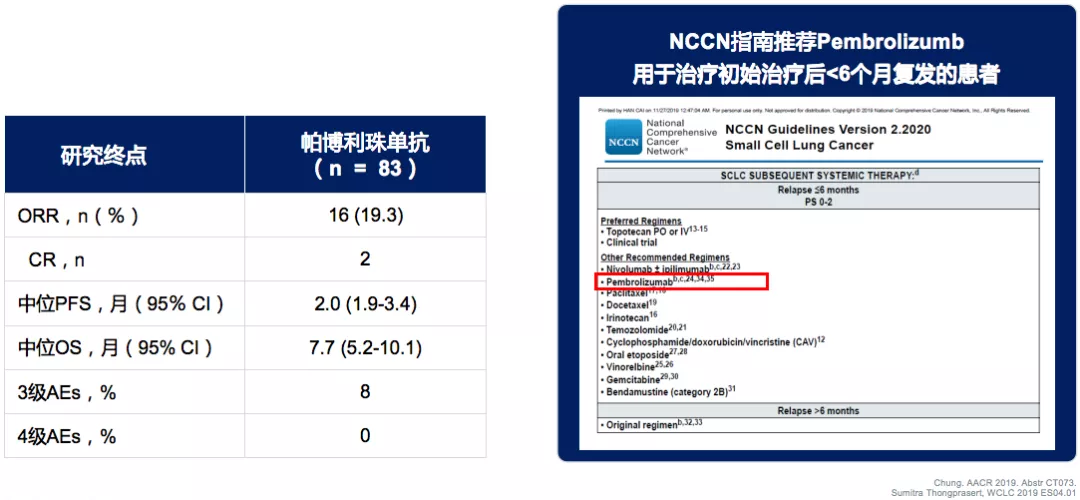
CheckMate032纳武利尤单抗单药三线治疗SCLC
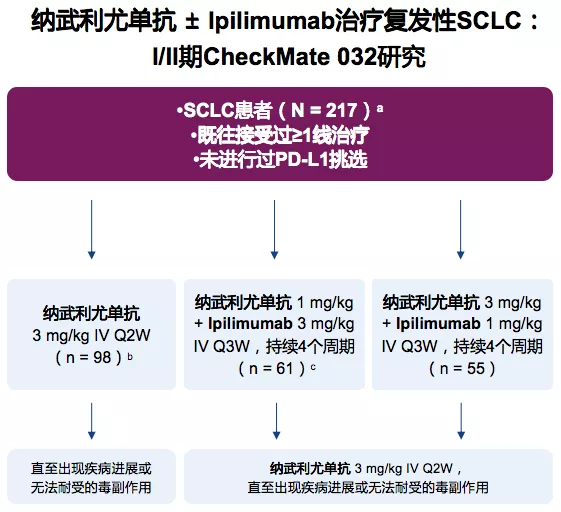
纳武利尤单抗 ± Ipilimumab治疗复发性SCLC:I/II期CheckMate 032研究,纳入SCLC患者(N=217),入组标准也是既往接受过≥1线治疗、未进行过PD-L1挑选。这样的研究结果给三线SCLC带来了一线之光,因为三线治疗是比较后线的治疗,纳入了接受既往接受过≥2线治疗的患者(n=109):中位随访时间为28.3个月,ORR:11.9%,中位DoR:17.9个月,中位OS:5.6个月,≥3级AEs:11.9%。因此,NCCN指南推荐纳武利尤单抗 ± ipilimumab用于治疗初始治疗后<6个月复发的患者。
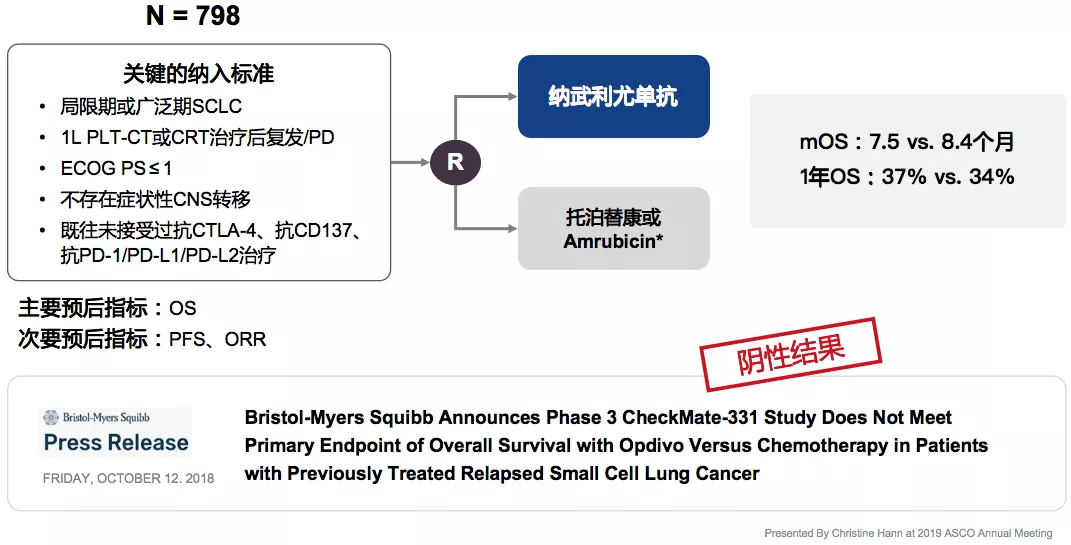
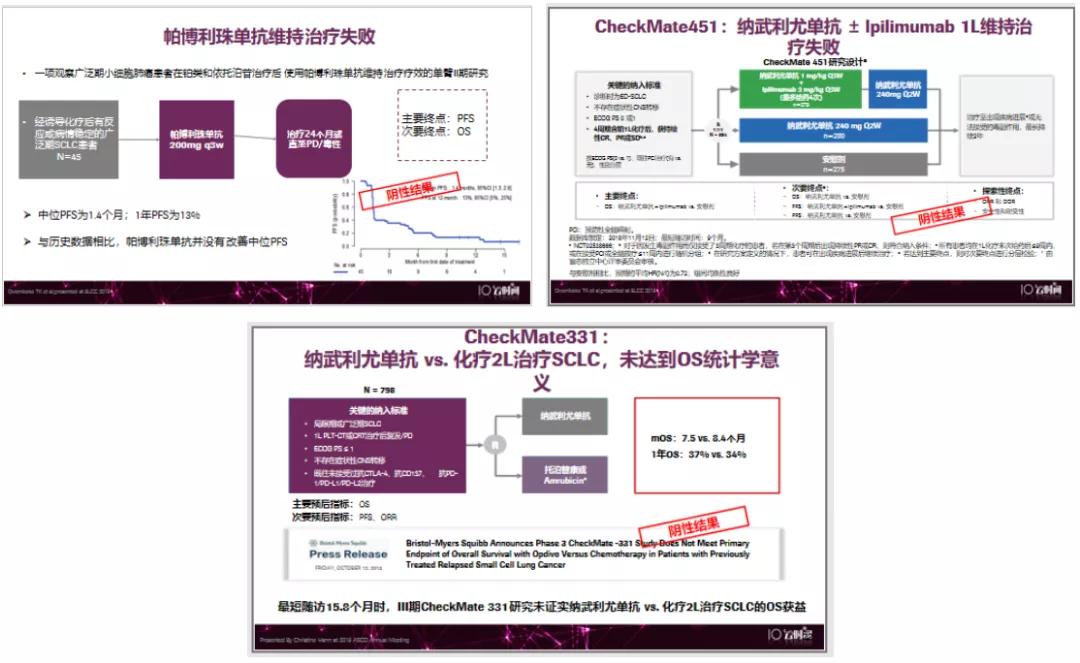
III期CheckMate331未能证实纳武利尤单抗 2L疗效
CheckMate451 纳武利尤单抗±lpilimumab 1L维持治疗铩羽而归
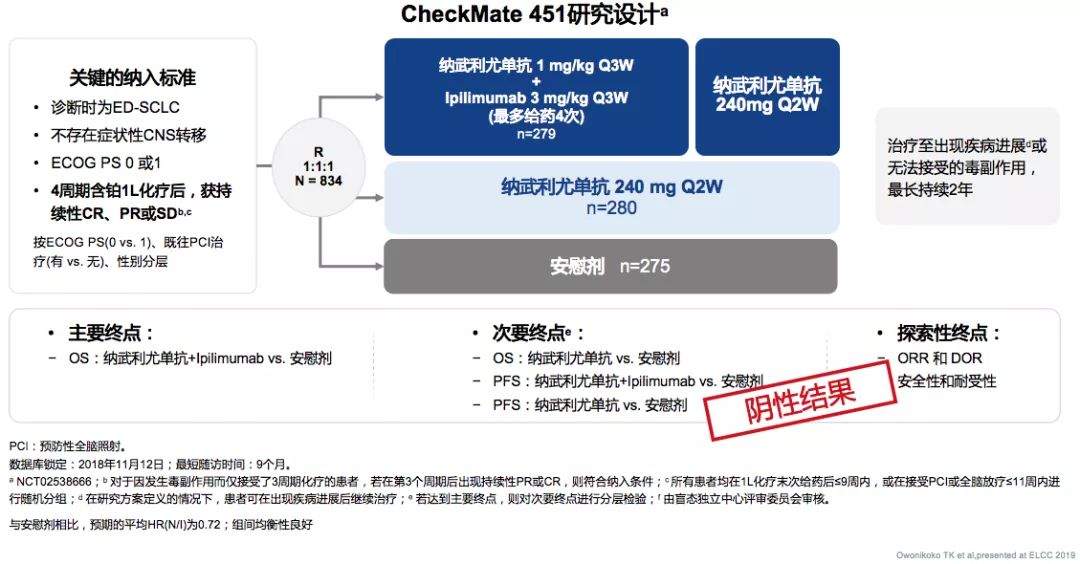
纳武利尤单抗±lpilimumab作为一线维持治疗,也没有取得比较好的临床结果。
IMpower133:三十年首个改变指南的ES-SCLC一线免疫治疗方案
从2016年-2017年5月,来自26个国家106家研究中心的403例患者纳入本项临床研究。
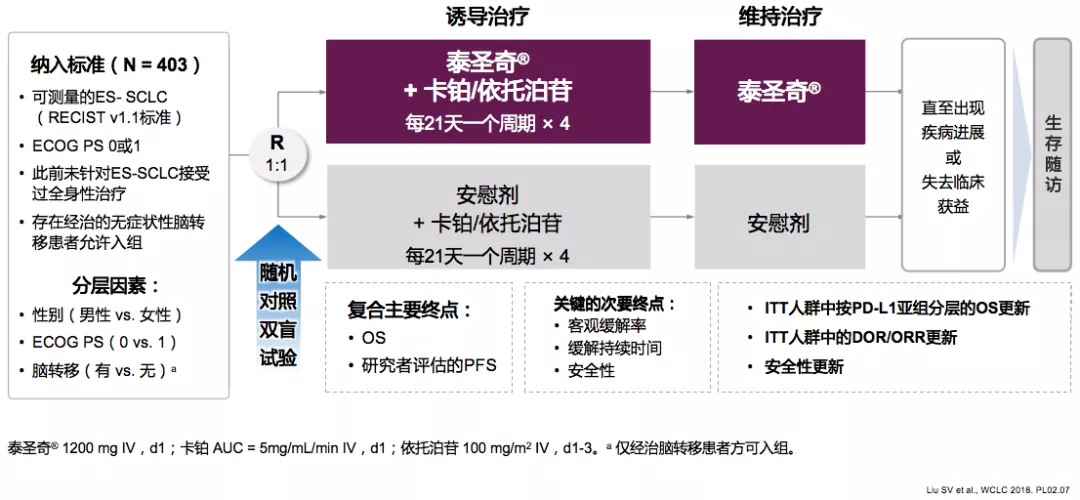
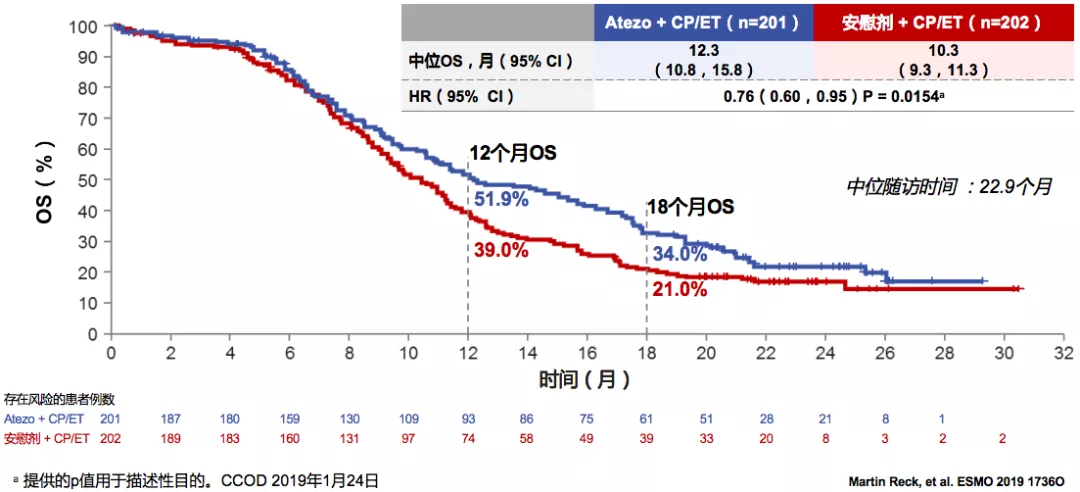
ITT人群中的OS更新
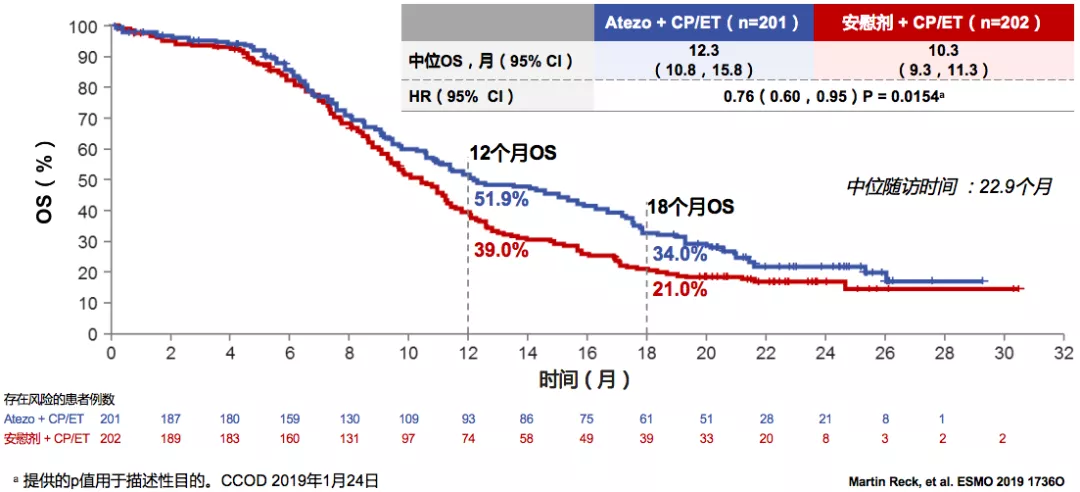
中位随访时间为22.9个月,Atezo+CP/ET的中位OS为12.3个月,安慰剂+CP/ET的中位OS为10.3个月。这是近30年ES-SCLC首个免疫联合一线治疗取得总生存获益的Ⅲ期研究。
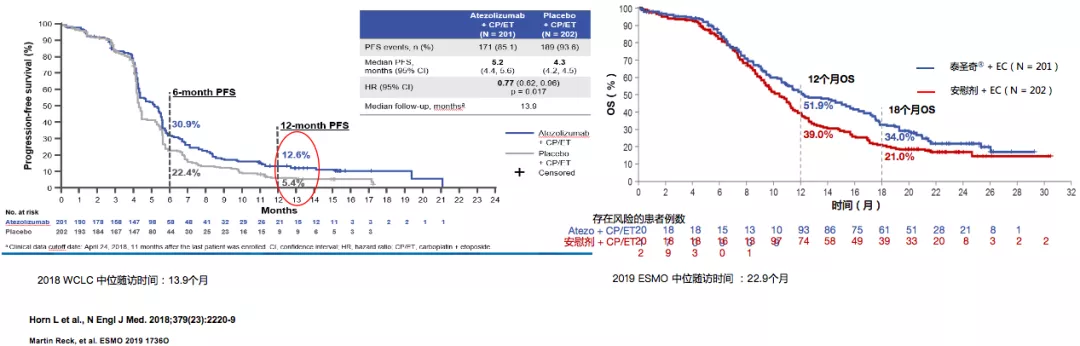
IMpower133达到OS/PFS获益双终点
泰圣奇®+卡铂/依托泊苷显著延缓广泛期小细胞肺癌疾病进展,1年PFS率翻倍。更长的随访中,生存获益持续,超过1/3患者生存超过18个月。
免疫联合化疗较化疗总体安全性相当
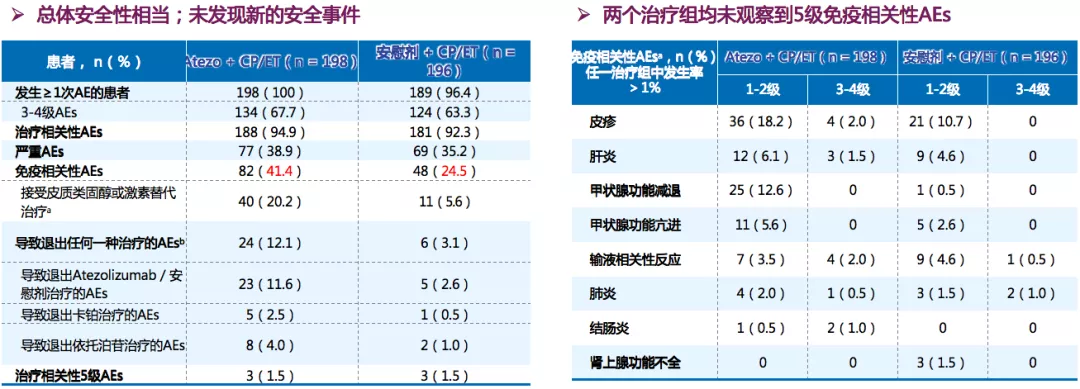
在免疫治疗中,我们会更多关注免疫治疗相关的安全事件。从临床中,我们可以看到Atezolizumab的中位治疗持续时间为4.7个月(范围:0-29)。中位给药次数:Atezolizumab:7次(范围:1-39),化疗:卡铂4次;依托泊苷12次(两组相同)。总体安全性相当,未发生新的安全性事件。两个治疗组均未观察到5级免疫相关性AEs,包括肝炎、甲状腺功能减退、免疫相关性肺炎等。
研究真实病例分享

这是一位56岁的右侧中央型的ES-SCLC患者。基线有肺门的侵犯、淋巴结侵犯、上腔静脉受压;与基线相比,第9个周期以后,肿瘤有一定比例缩小;第113周时,与基线相比,肿瘤还是持续缩小。所以,这个病人在2017年4月25日入组了IMpower133的临床研究,他每年吸烟35包,2017年4月21日诊断为右侧中央型广泛期小细胞肺癌,除了胸腔积液以外,还有腹部淋巴结肿大。到第113周,病人仍为PR,依旧使用泰圣奇维持治疗。治疗耐受性良好,自第5周期开始出现无症状性甲状腺功能减退,接受优甲乐100 μg 1xtgl 治疗。
CASPIAN:进一步证实了PD-L1联合化疗在ES SCLC一线治疗的地位
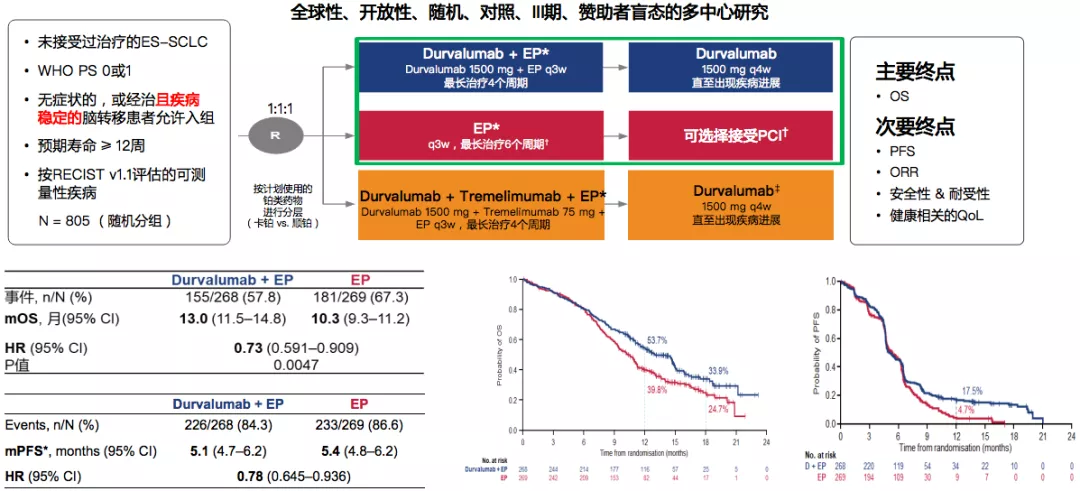
目前该研究仅公布Durvalumab/EP与EP两组患者数据:EP由依托泊苷80-100mg/㎡联合卡铂 AUC 5-6或顺铂75-80mg/㎡组成;根据研究者的判断,患者可接受额外的2个周期EP(最长共6个周期)和PCI治疗;EP后患者接受了额外的一次Tremelimumab给药。
KEYNOTE604:不同免疫抑制剂对于ES-SCLC的临床疗效不同
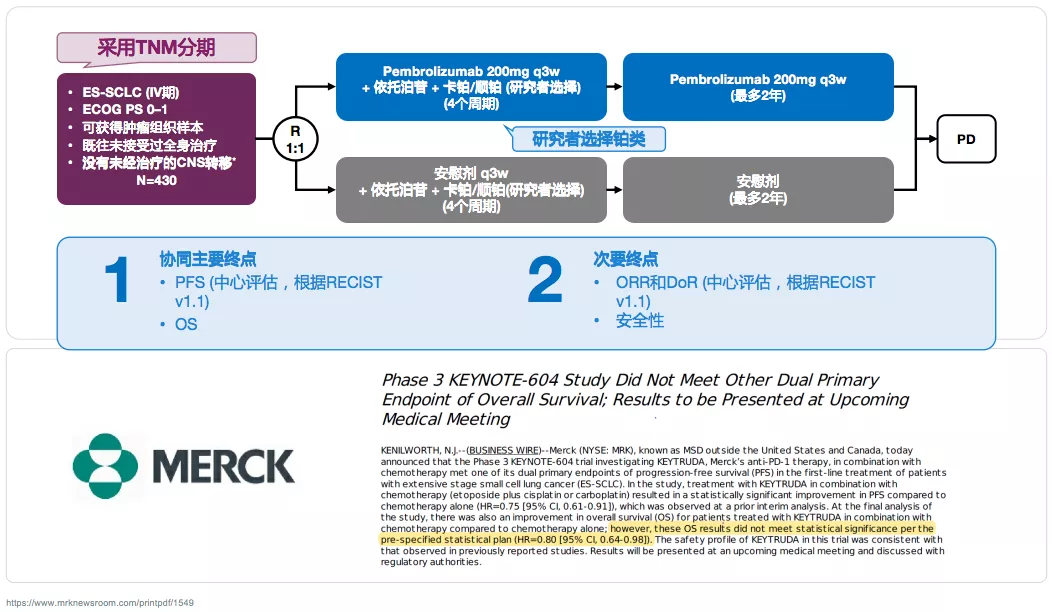
四、小细胞肺癌的思考
SCLC免疫治疗的探索之路,如何让SCLC从免疫治疗中获益更多?
小细胞肺癌经过30年的不断努力,从去年以来,治疗过程当中除了免疫治疗以外都没有被突破。
> All comer approach 所有人群
在我们可以开始小细胞肺癌免疫治疗以后,在临床过程中可以观察临床数据、上市后的药物对病人的获益或者相关的潜在副作用。
早期临床数据并不支持TC PD-L1表达与CIT反应之间的相关性
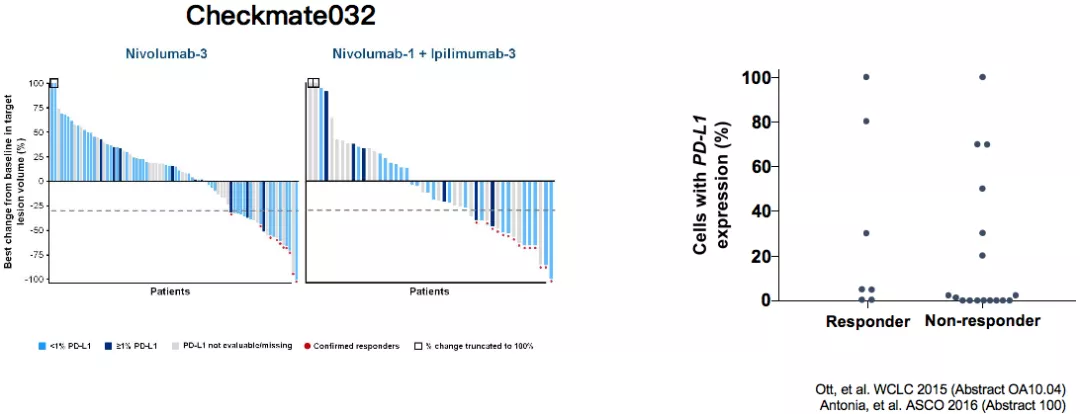
肿瘤细胞阳性评分(TPS):PD-L1阳性细胞数(肿瘤细胞)/总体肿瘤细胞数x100。复发性SCLC患者对pembrolizumab的应答与TC PD-L1表达无关(KEYNOTE-028;n=28)。在小细胞肺癌中还有很多需要探索的内容。
两项III期1L ES-SCLC研究证实,PD-L1表达水平与OS无显著相关性
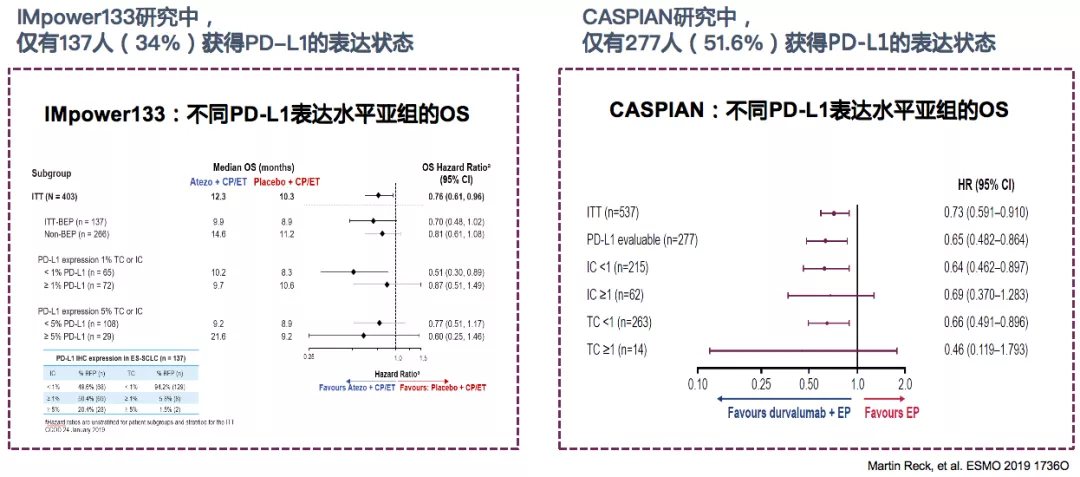
> Start from 1L为何需要从一线开始
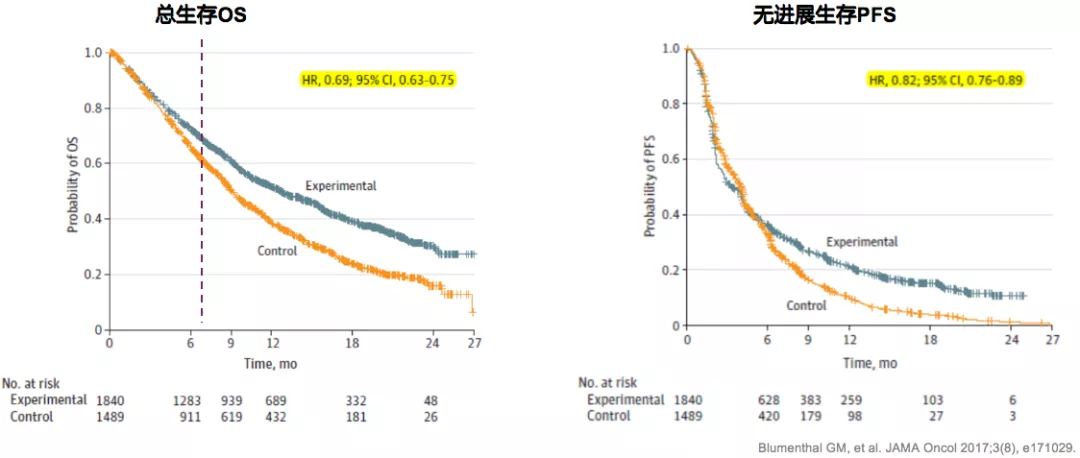
从NSCLC荟萃分析提示:早用免疫治疗患者生存获益更显著
纳入25项mNSCLC随机临床研究的荟萃分析(2003.01.01~2016.12.31),共计20013例患者,探讨里程碑率作为免疫治疗研究替代终点的可行性。免疫治疗组(先用免疫治疗)的OS和PFS均显著高于对照组(先用化疗)。
SCLC化疗时代,体能状态影响治疗疗效
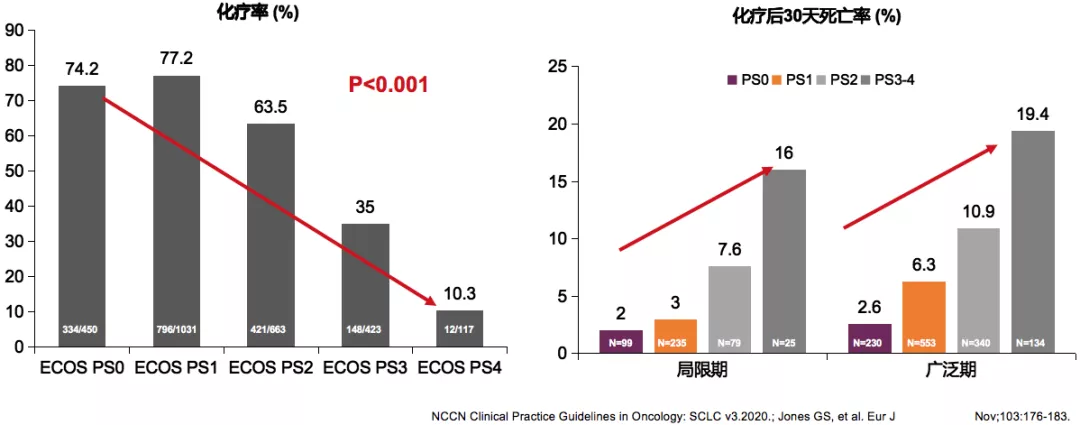
从疗效评估可以看到,如果体能状态好,获益的概率高。所以PS是影响SCLC患者化疗后治疗选择和30天死亡率的独立相关因素。因此,我们认为体能状态也是一个非常好的评判。
SCLC一线治疗至关重要,仅50%人群有机会进入二线
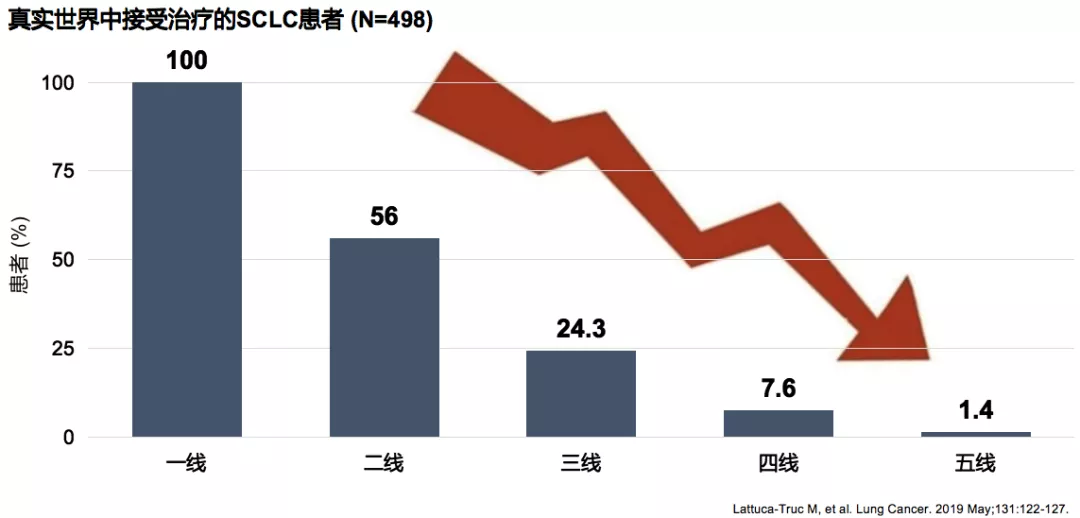
小细胞肺癌一线治疗至关重要,原因是如果进展以后,仅50%人群有机会进入二线治疗。
临床研究的启示:免疫治疗后线/维持治疗尽管有小样本提示有效,但III期研究提示2L/维持治疗无生存获益
> Opportunity for optimization
放疗是SCLC重要治疗手段,优化小细胞肺癌生存
在小细胞肺癌中,一直认为放疗是小细胞肺癌的重要治疗手段,也可以优化小细胞肺癌生存。因为放疗对肺癌肿瘤细胞和肿瘤微环境具有潜在作用,放疗也可以加强抗PD-1/抗PD-L1的疗效,比如上调肿瘤表面MHC-I和PD-L1表达、升高有益TILs比例及其活性、驱动多克隆T细胞反应、形成肿瘤抗原库。另外,当放疗与ICIs联用,可能可以恢复需氧代谢和T细胞的mTOR信号,分化出效应T细胞。所以对于小细胞肺癌而言,放疗也是一种很好的选择机会。
2015年,CREST研究证实对于化疗后CR的ES-SCLC患者,给予胸部放疗可显著延缓疾病进展,延长生存期
CHEST研究纳入来自欧洲的498例对初始化疗应答良好的广泛期小细胞肺癌患者,完成化疗后随机接受胸部放疗(放疗组)或未接受胸部放疗(对照组),所有患者同时接受PCI,旨在评估胸部放疗治疗广泛期小细胞肺癌的疗效,主要终点为1年生存率;次要终点为PFS。
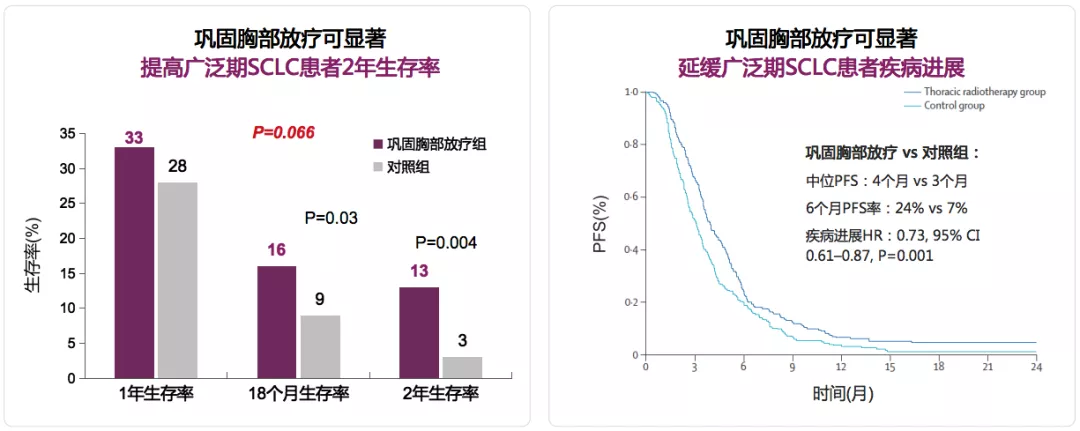
CREST研究证实,对于化疗后CR的ES-SCLC患者,给予胸部放疗可显著延缓疾病进展,延长生存期。所以,在既往小细胞肺癌治疗的过程中,会采用化疗、放疗的综合治疗手段。
在新的时代,免疫的时代,放疗依旧是最好的协同?

胸部放疗联合免疫治疗,是否可以提高胸部放疗以外放疗的价值?常规应用巩固胸部放疗,是否可以进一步提升免疫治疗的系统活性?免疫治疗是否可以:将部分既往需要常规PCI的ES-SCLC患者,转变为积极MRI监测?对于脑转移患者,免疫治疗是否可以为SRS替代WBRT提供理论基础?这些问题都值得我们去探索。
未来SCLC的精准治疗,也许是Biomarker的指导治疗、不同的SCLC分型、免疫新靶点的探索。这都是我们需要寻求的标准。
新的SCLC亚型分型预测不同的治疗反应
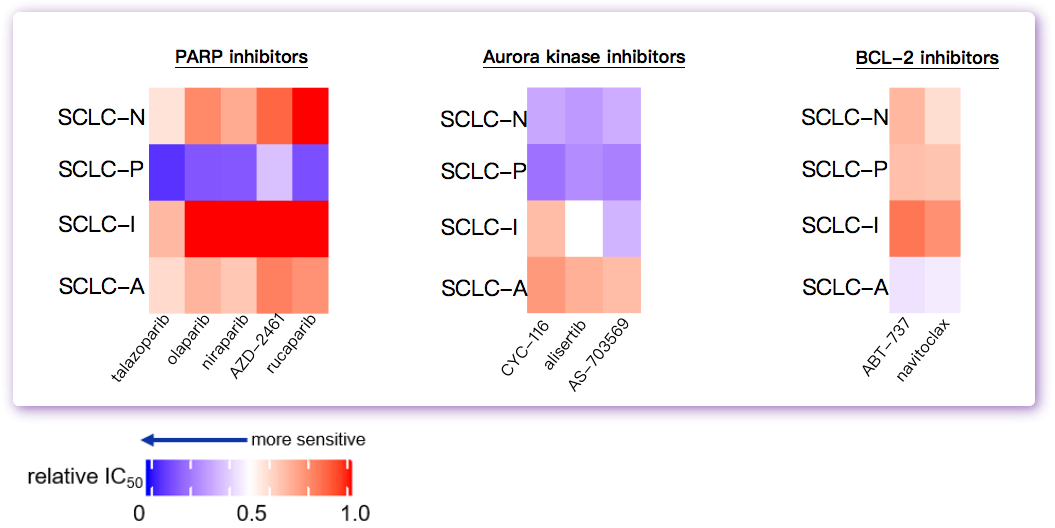
不同亚型的SCLC细胞对靶向治疗和化疗具有独特的治疗敏感性。
未来,新的靶点?

未来还有很多新的靶点有待于临床发现,用于临床研究,为小细胞肺癌提供更好的治疗手段。
总结
三十年来,广泛期小细胞肺癌的一线治疗仍以EC/EP方案化疗为主,亟待新的治疗方案。IMpower133是首个达到双终点阳性的1L ES-SCLC 免疫+化疗方案,目前已成为是ES-SCLC一线治疗新标准,获得NCCN指南一类优选推荐,开启ES-SCLC治疗新时代。一线免疫联合化疗治疗获益人群、生物标记物的选择,需要将来进行更深入的研究。
答疑讨论
陈闽江:在小细胞肺癌治疗的这30年过程中,化疗还是晚期小细胞肺癌的治疗基石,虽然近一年来IMpower133研究中化疗联合免疫在病人的PFS和OS上都达到了延长的效果,首个达到了一个双终点的阳性。在这个药物进入临床应用,进入中国之后,我们非常想听听您的意见,您在治疗晚期小细胞肺癌的过程中,对于免疫治疗有什么样的看法?对这个研究的结果有一些怎样的解读?
周建英:肺癌是我们的亚专科。在很多地区的呼吸科中肺癌亚专科都做得很好,虽然小细胞肺癌发病率占肺癌的15%-20%,记得在3-4年以前我们科里转上来的病人很多都是小细胞肺癌,大概有几个原因:第一因为小细胞没有靶点突变,第二是因为通常病情比较重、中央型、上下气道堵塞、静脉输液困难等。我们知道肺癌的三大致死原因,第一个是颅内转移,第二个是上气道阻塞,第三个是恶性胸水。
由于小细胞肺癌的治疗手段很少,只是含铂双药的标准化疗加上放疗,放疗对于ES-SCLC有时候也比较困难。对小细胞肺癌来说,如果能延长中位PFS或OS的时间,病人能获得后线治疗的时间和机会,总生存时间可能会延长。
另外,因为这个药物上市时间不长,我们也在临床中尝试使用免疫治疗加上含铂双药化疗一线治疗ES-SCLC。在临床实践过程中,我们还会做一些观察,即真实世界中是否也能做出这样的一个单中心的分享。我觉得从评估来看,疗效还是不错的。目前来说,相关免疫不良事件发生率大概大于三级的一例都没有发生(中心单位应用数据还有限)生命是无价的,在肿瘤治疗的过程中可以延长,还是非常不错的。希望药物上市以后,有更多的机会给更多的病人做一个选择,另外上市以后的研究还可以再进行探索。
陈闽江:谢谢周教授。我理解您的意思是因为小细胞肺癌这么多年以来在新的治疗上的发展非常少,对于治疗上难以突破的一种疾病来说,延长了两个月还是对患者有一个非常积极的意义的,您在工作中其实也会建议病人在有条件的情况下,尝试这种免疫联合化疗的方式吗?
周建英:是的,首先要进行评估,第一个是病人的经济情况,第二个是病人的PS情况,第三个还要评估病人具体的情况,不是每个病人都适用,要做一些选择。因为这个药物刚刚上市价格不是很便宜,所以我认为在治疗过程中为了能获得我们预计的临床疗效,要进行很好的评估。
陈闽江:对于晚期小细胞肺癌免疫联合化疗,不像非小细胞肺癌可以根据TMB、PD-L1的表达,对病人进行更进一步的个体化的选择。小细胞肺癌应用免疫治疗,在病人选择和生物标志物的探索上,一直没有太多的经验,不知道周教授在生物标志上对广大的临床工作者有没有什么建议,包括从临床上的选择和从科研角度上的探索。
周建英:从非小细胞肺癌来说,如果没有靶点突变,驱动基因阴性的非小细胞肺癌的话,我们会选择化疗加上免疫治疗。但是如果病人是腺癌,基因突变为阴性,如果PD-L1高表达,单药免疫治疗可以作为一线治疗的选择。如果PD-L1低表达或者不清楚的话,建议化疗加上免疫治疗。
但是小细胞肺癌与之不同,目前不认为需要用PD-L1、TMB的指标来预测,所以对小细胞肺癌来说,目前仍然没有良好的、可预测的、提示预后的biomarker,目前建议在小细胞肺癌中,如果PS评分良好,局部病灶是广泛型的,而其他方面比如转移的部位并不是非常多而且又是吸烟的病人,那么我们可以用免疫治疗加EP这样标准的方案进行治疗。化疗联合免疫治疗作为广泛期小细胞肺癌一线治疗来选择,如果未来有更好的biomarker出现,对临床治疗还是有帮助的。
陈闽江:现在您的临床工作中,会建议小细胞肺癌病人再进一步做大套餐的多种基因突变的检测或者PD-L1的染色吗?
周建英:对于小细胞肺癌来说,病理科做一些常规的免疫组化以后,一般不建议病人再去做。我觉得病人去做大panel检测的话,如果进行一些临床研究,可以留一些血样本、组织样本;如果对病人的治疗没有太多的帮助,我们一般不选择做大panel检测。
陈闽江:谢谢周教授。您刚才提到小细胞肺癌会有一些神经内分泌的并发症,在临床中也经常见到有些小细胞肺癌的病人出现神经系统的症状,比如出现边缘叶脑炎等,那么这样本身已经有神经系统副作用的小细胞肺癌,应用免疫治疗是否会有新的担忧?比如免疫系统相关的神经系统副作用,可能会掺杂其中不好分辨,对于这些病人用免疫治疗有什么顾忌吗?
周建英:因为现在是一个刚开始使用的过程,所以我觉得适应症还是抓得牢一点好。如果病人出现神经系统症状,主管医生仔细询问病史,诊断是原发病所致的,我认为可以使用免疫治疗。如果是免疫治疗以后再出现,要鉴别诊断看一下是不是免疫相关性肺炎。
陈闽江:刚才IMpower133研究中提到的阿替利珠单抗获批用于广泛期小细胞肺癌的一线治疗,除此之外,现在在指南中批准可以用于小细胞肺癌的后线治疗的药物,还有K药和O药也会用于一些难治复发的耐药的小细胞肺癌的治疗,您在工作中对这种不同的免疫治疗的药物如何选择的?
周建英:以前我们在用的过程中,还是会选择一些其他的PD-1这样的免疫抑制剂作为病人的治疗方式。目前来说,如果是一线治疗,我还是会选择有适应症的药物。后续的治疗,要和病人谈清楚免疫相关性的不良事件。
陈闽江:有些医院在呼吸科治疗肺癌的病人,有些肺癌的病人归在肿瘤内科。作为呼吸医生在肺癌的发展上,与肿瘤科相比有什么独到之处?因为在化疗方面,大家针对的治疗方向都是相似的,我们在自身的发展上有什么更值得注意的地方和发展的方向吗?
周建英:我们从80年代就开始关注肺癌。肺癌是个亚专科,近几年肺癌的发展势头很猛,发病率很高,也是高死亡性疾病。如果呼吸科没有把肺癌这个亚专科很好的规范起来的话,我觉得在学科的发展中存在欠缺。呼吸科和肿瘤内科并不矛盾,因为肺癌整体病人量比较多。对于呼吸科而言,与其他科室相比有两方面的优势:第一,呼吸科有支气管镜检查、肺穿刺活检、胸腔镜的手段,这些都能开展,对早期诊断存在优势;第二,在治疗过程中,大家都会开始免疫治疗,但是出现相关的副作用的过程中,不一定每个学科都能很好的甄别出来的。我们的团队在肺癌中能发展迅速,是因为我们参加了很多国际多中心临床实验,包括前段时间发布的每个学科参加国际多中心临床实验,我们参加global的项目排在全国前三,经过这样不断的临床实验,我们可以获得第一手的资料。我们做临床实验,首先是质量的把控,其次就是在安全性方面可以早期发现,我们做得很好。
举个例子,在2019年的春节,我们也接了一个一线免疫治疗加上化疗的方案,病人在春节以后打电话给我们,他有点胸闷,然后就让他回到医院,发现病人出现免疫相关性肺炎、免疫相关性心肌炎,后来出现格淋巴综合症,眼睛都不能睁开,所以整个春节都没过好。我们发现比较早,很好的把这个病人救回来 仅注射一次,肿瘤病灶有40%缩小,后来就不能打了,一直持续这么稳定。所以呼吸科在不良事件的处理中,比如相关性肺炎的治疗措施中,我们还有非常好的呼吸科的功底在里面。但不论如何,对于每个学科的亚专科来说,我觉得还是要均匀发展,因为现在的疾病谱改变了很多,以前重症肺炎、COPD、多脏器功能不全,现在这样的病人减少了,而会出现疑难的多重耐药的肺炎发生,并且肺癌的发病率高,所以我想我们每个学科对亚专科用心慢慢做起来的话,对学科的发展还是很有利的。此外,我们医院有很强大4个肿瘤内科和综合放疗中心,我们多学科合作都特别好,会做一些MDT的讨论。
陈闽江:免疫治疗逐渐地应用广泛,我们也看到越来越多的免疫不良反应,您对于这些患者免疫不良反应的监测和治疗上,有什么经验可以跟我们分享吗?
周建英:因为没有一种治疗方式会提出很多副作用,只有免疫治疗会讲许多相关性的不良事件,这是它特殊性所在。我们无法判断病人在获益的同时副作用是否最小,我们能做的就是要做到早发现。所以相关性的系统损害,病人一定会有相关的主诉,所以对免疫相关性的病人要关注出现干咳、发热等情况。免疫相关性的不良事件重在早期发现,早期发现对预后一定有帮助,如果在其他科室发现以后,可以寻求相关专科的会诊。还有一点:早治疗 。激素要早期使用且足够用量,不能用很长时间,撤得要快,防止一些支持性损害。在免疫治疗过程中还要注意,如果来势比较猛,进展比较快,激素适当的加大剂量,可能还是有帮助的。
陈闽江:各种不良反应最重要的就是有这个意识,早发现、早治疗、早处理,才能给病人相对好的预后。我们在临床中,对于相对症状比较缓、发展比较慢的免疫相关的间质性肺炎,大多数病人在基础治疗后都有很好的疗效,处理也相对简单,但是对于一些发展迅速、症状重的,我们觉得病人肺里的病灶在短期内迅速进展,往往我们的处理都非常棘手,不知道您对于这些病人的处理有什么经验,比如免疫制剂是应该早期加,还是等到激素控制效果不好再加,生物制剂又应该是什么时候开始考虑应用?能请周教授和我们分享一下经验吗?
周建英:我们一般会加一个激素,虽然也用过生物制剂,比如抗白介素使用的白介素抗体,我们用过1~2个病人,似乎效果不太好,而且价格比较高。在如果早期发现,通过常规的手段也可以救治。这样的疗效,要对具体病人具体分析。
参考文献
[1]Ann Oncol2010;21(Suppl 5):v220–222
[2]Pikor, et al. Lung Cancer 2013.
[3]Howlader, et al. SEER Cancer Statistics Review 2016.
[4]Carter, et al. RadioGraphics 2014
[5]American Cancer Society 2016: NSCLC
[6]Varghese, et al. J Thorac Oncol 2014.
[7]Vavala, et al. Curr Respir Care Rep 2014.
[8]Pelosof, et al. JNCI 2017.
[9]Dempke. Anticancer Research 2015.
[10]Kahnert, et al. Clin Lung Cancer 2016.
[11]Arcaro. Crit Rev Onc Hematol 2015.
[12]Barlesi, et al. Lancet 2016.
[13]Bergethon, et al. J Clin Oncol 2012.
[14]Chan BA, Coward JI. J Thorac Dis. 2013;5(suppl 5):S565-S578.
[15]Wolf J et al. Am J Med. 1960;29:1008-1016.
[16]Fox W, Scadding JG. Lancet. 1973;2(7829):616-617.
[17]Green RA et al. Am J Med. 1969;46(4):516-525.
[18]Lowenbraun S et al. Cancer. 1979;44(2):406-413.
[19]Livingston RB et al. Ann Intern Med. 1978;88(2):194-199.
[20]Sundstrøm S et al. J Clin Oncol. 2002;20(24):4665-4672.
[21]Evans WK et al. J Clin Oncol. 1985;3(11):1471-1477.
[22]Takada M et al. J Clin Oncol. 2002; 20(14):3054-3060.
[23]Aupérin A et al. N Engl J Med. 1999;341(7):476-484.
[24]von Pawel J et al. J Clin Oncol. 1999;17(2):658-667.
[25]O’Brien ME et al. J Clin Oncol. 2006;24(34):5441-5447.
[26]von Pawel J et al. J Clin Oncol. 2014;32(35):4012-4019.
[27]Inoue A et al. J Clin Oncol .2008;26(33):5401-5406.
[28]Garassino MC et al. Lung Cancer. 2011;72(3):378-383.
[29]Noda K et al. N Engl J Med. 2002;346(2):85-91.
[30]Turrisi AT 3rd et al. N Engl J Med. 1999;340(4):265-271.
[31]Slotman B et al. N Engl J Med. 2007;357(7):664-672.
[32]Okamoto, et al. 2007.
[33]Ihde, et al. 1994.
[34]Hermes, et al. 2008.
[35]Asian Pacific J Cancer Prev, 13 (10), 4959-4962.
[36]Chin J Lung Cancer, 2014, Vol.17, No.1.
[37]Thorac Oncol. 2015 Jan;10(1):206-11.
[38]Sun et al. BMC Cancer. 2016; 16:265.
[39]Owonikoko, et al. J Thorac Oncol 2012.
[40]Alvarado-Luna and Morales-Espinosa. Transl Lung Cancer Res 2016
[41]Gazdar AF, et al. Nat Rev Cancer. 2017 Dec;17(12):725-737.
[42]National Cancer Institute, Bethesda, MD, USA DOI: 10.1158/2159-8290.CD-NB2014-114 Published September 2014.
[43]J Hematol Oncol. 2019 May 2; 12(1): 47
[44]Arik Bernard Schulze, Georg Evers, Andrea Kerkhoff, et al. Future Options of Molecular-Targeted Therapy in Small Cell Lung Cancer.Cancers (Basel). 2019 May; 11(5): 690.
[45]Sabari, et al. Nat Rev Clin Oncol 2017.
[46]NCCN Clinical Practice Guidelines in Oncology: SCLC v2.2018.
[47]Früh, et al. Ann Oncol 2013.
[48]Maddison P, et al. Lancet. 1999 Jan 9;353(9147):117-8.
[49]Antonia SJ, et al. Clin Cancer Res. 2006 Feb 1;12(3 Pt 1):878-87.
[50]Chen DS, et al. Clin Cancer Res 2012.
[51]Chen DS, et al. Immunity 2013.
[52]Alexandrov, et al. Nature 2013
[53]Morabito, et al. Crit Rev Oncol Hematol 2014
[54]Sabari, et al. Nat Rev Clin Oncol 2017
[55]Carbone, et al. N Engl J Med 2017;
[56]Snyder, et al. N Engl J Med 2014
[57]Galsky, et al. ESMO 2017 (Abstract 848PD)
[58]Rosenberg, et al. Lancet 2016
[59]Rizvi, et al. Science 2015;
[60]Le, et al. N Engl J Med 2015;
[61]Kowanetz, et al. ESMO 2016 (Abstract 77P)
[62]Kowanetz, et al. WCLC 2016 (Abstract OA20.01)
[63]Gandara, et al. ESMO 2017 (Abstract 1295O)
[64]Spigel DR, Socinski MA. J Thorac Oncol. 2013;8(5):587-598.
[65]Wang W et al. Chest. 2013;143(1):146-151.
[66]Eerola A-K et al. Clin Cancer Res. 2000;6(5):1875-1881.
[67]Studnicka M et al. Chest. 1994;105(6):1673-1678.
[68]Koyama K et al. Clin Cancer Res. 2008;14(21):6770-6779.
[69]6Fischer JR et al. Ann Oncol. 1997;8(5):457-461.
[70]Wang W et al. Int J Cancer. 2012;131(6):E928-E937.Abbreviations can be found in the speaker notes
[71]Chung. AACR 2019. Abstr CT073.
[72]Sumitra Thongprasert, WCLC 2019 ES04.01
[73]Presented By Christine Hann at 2019 ASCO Annual Meeting
[74]Owonikoko TK et al,presented at ELCC 2019
[75]Liu SV et al., WCLC 2018. PL02.07
[76]Martin Reck, et al. ESMO 2019 1736O
[77]Horn L et al., N Engl J Med. 2018;379(23):2220-9
[78]PR/TCNGI/1812/0005a www.roche.com
[79]Luis-Paz Ares, et al. WCLC 2019 PL02.11
[80]https://www.mrknewsroom.com/printpdf/1549
[81]Ott, et al. WCLC 2015 (Abstract OA10.04)
[82]Antonia, et al. ASCO 2016 (Abstract 100)
[83]Blumenthal GM, et al. JAMA Oncol 2017;3(8), e171029.
[84]NCCN Clinical Practice Guidelines in Oncology: SCLC v3.2020.; Jones GS, et al. Eur J Cancer. 2018 Nov;103:176-183.
[85]Lattuca-Truc M, et al. Lung Cancer. 2019 May;131:122-127.
[86]Kordbacheh T, et al. Ann Oncol 2018;29 (2), 301-310.
[87]Slotman BJ, et al. Lancet. 2015 Jan 3;385(9962):36-42.
[88]Slotman BJ, et al. Transl Lung Cancer Res. 2015 Jun;4(3):292-4.
[89]Nesbit EG, et al. Transl Lung Cancer Res. 2019 Sep;8(Suppl 2):S153-S162.
[90]Immunotherapeutic approaches for small-cell lung cancer Nat Rev Clin Oncol. 2020
专家介绍

周建英
教授,主任医师,博士生导师;浙江大学附属第一医院呼吸与危重症医学科主任;浙江大学附属第一医院肺部疾病诊疗中心主任;中华医学会呼吸病分会全国常委;中华医学会呼吸病分会肺癌学组副组长;浙江省医学会呼吸病分会主任委员;浙江省抗癌协会肺癌专业组副主任委员;中国医师协会呼吸医师分会常委;浙江大学呼吸病研究所副所长。

陈闽江
呼吸与危重症医学科专业 医学博士 副主任医师,自2006年起于北京协和医院工作,擅长呼吸系统疾病尤其是肺部恶性肿瘤的诊断治疗以及介入操作,参加国内多个肿瘤协会并担任委员,中国肺癌防治联盟青年委员,中国抗癌协会介入治疗专业委会内镜分会青年委员,北京肿瘤防治研究会呼吸内镜分会青年委员,北京医学会呼吸内镜和介入学分会青年学组委员等。


