在近期举办的GOLD慢阻肺大家谈会议上,来自基尔大学呼吸科教授兼 Grosshansdorf诊所肺科主任的Klaus F Rabe教授和来自英国国家心肺研究所NHLI呼吸科的Omar Usmani教授分别对慢性阻塞性肺疾病(COPD)的诊断和治疗进展、慢阻肺患者吸入装置的选择进行内容分享,让我们一起回顾大会精彩内容吧!
危险因素多样,表型各异
治疗宜个体化
Rabe教授首先分享了目前慢阻肺的诊疗现状。
迄今为止,世界各国所颁布的慢阻肺指南已更新迭代,版本诸多。近年来,越来越多的指南强调慢阻肺是一类表型多样的呼吸系统疾病,不同个体可以表现为完全不同的表型,如频繁加重慢阻肺表型、肺气肿表型、血EOS增多表型等,不同表型的患者治疗存在差异性。
慢阻肺危险因素多样、表型各异。
Rabe教授指出,慢阻肺的发生并不是从老年才开始的,儿童期重症哮喘和青少年时期吸烟造成的肺功能快速下降都可能是慢阻肺发生的风险因素。
一项研究调查了2013年至2017年间北京空气污染与慢阻肺急性加重住院率之间的关系,研究发现,短期暴露在空气污染环境下的慢阻肺患者会增加其住院风险,进一步发现,女性和年龄65岁以上的患者相较男性、65岁以下的患者更容易受到空气污染物的影响,增加其住院风险[1]。
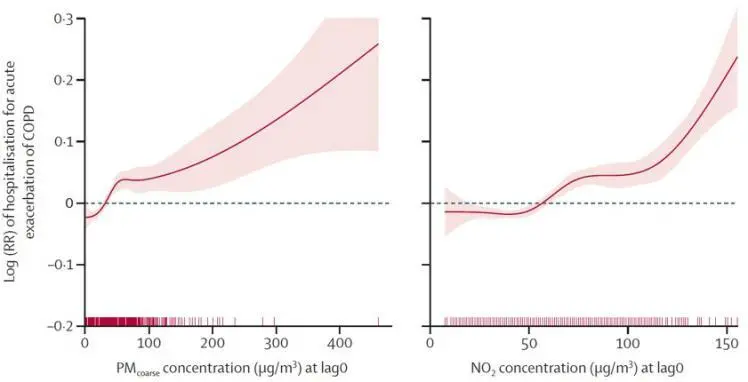
【图1】2013-2017年单污染物模型中污染物颗粒、二氧化氮与慢阻肺急性加重住院之间的暴露-反应关系[1]
这是中国独有的现象吗?并不是。
英国一项监测空气污染和慢阻肺关系的研究同样证实空气污染物浓度的升高和肺功能的下降具有相关性[2],和上述我国的研究一同证明了空气污染是肺功能下降的重要危险因素。
除烟草、空气污染外,近年来,电子烟对健康的影响也日益受到社会和学术界的广泛关注。多项研究揭示电子烟中含有的许多有毒成分可引起严重的肺损伤和呼吸衰竭[3,4]。
令人深思的是,慢阻肺和心血管疾病之间存在一定的关系,Rabe教授在大会上表示,影响慢阻肺发生发展的危险因素同样也会增加心血管疾病的发生风险,由心血管疾病引起的全身炎症、呼吸困难、运动不耐受在一定程度上会影响慢阻肺患者疾病进程,反之,慢阻肺的急性加重、低氧血症等也会加剧心血管疾病[5]。
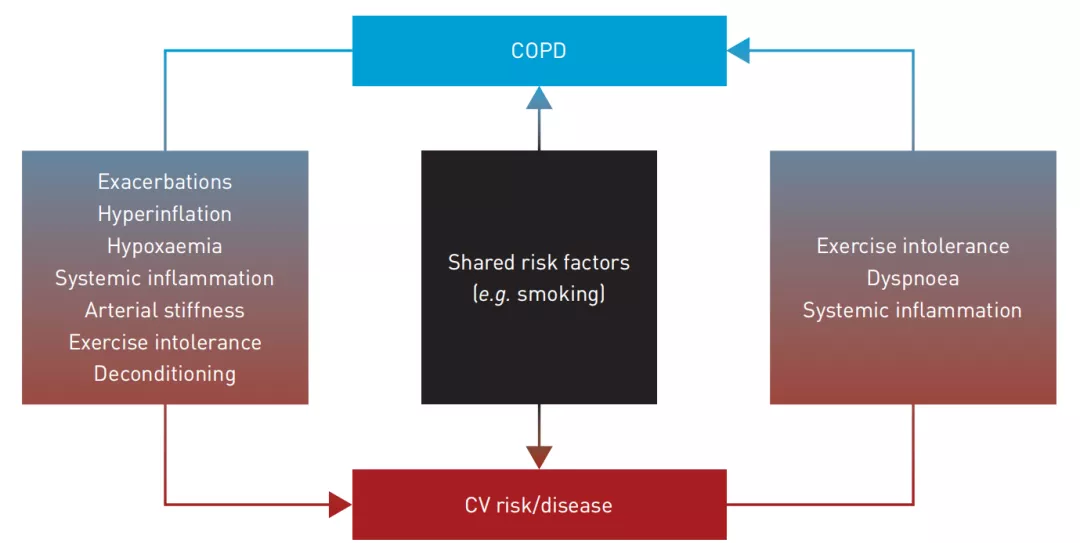
【图2】慢阻肺和心血管(CV)风险/疾病之间的潜在相互作用[5]
慢阻肺患者使用ICS需个体化
近年来,吸入糖皮质激素(ICS)在慢阻肺人群中应用普遍,在预防慢阻肺急性加重方面给患者带来一定的获益,然而并非所有慢阻肺患者均受益于ICS。 Rabe教授表示,ICS对于血嗜酸性粒细胞增多的患者获益更大。 对于存在呼吸道感染病史的慢阻肺患者,反对使用ICS。
对于初始治疗,GOLD 2020报告建议在D组(高风险,多症状)中启动ICS的阈值为血EOS≥300个/μL; 如果患者血EOS≥100个/μL,有两次或两次以上中等程度急性加重或一次严重急性加重住院,则考虑添加ICS。 其中对于反复发生肺炎、血EOS<100/μL、存在分枝杆菌感染史的慢阻肺患者,应避免使用ICS[7] 。

表1 :GOLD 2020慢阻肺患者起始ICS治疗的考虑因素[7]
Rabe教授最后总结道,慢阻肺患者表型复杂多样,治疗需充分考虑个体差异,此外空气污染、吸烟是慢阻肺患者的危险因素,治疗期间,不能忽视危险因素的影响。另外在启动ICS时,要注意询问患者急性加重病史,合并症、肺炎病史、分枝杆菌感染史,检查血EOS,然后个体化选择含ICS的药物。
装置主宰,药物起效
双剑合璧,无往不利
来自英国国家心肺研究所NHLI呼吸科的Omar Usmani教授为慢阻肺患者选择吸入装置带来指引。
Usmani教授首先强调了慢阻肺治疗观念。他表示,临床医生可能更侧重于治疗药物的选择,但给药装置同样重要。无论是患者来自慢阻肺门诊亦或社区,给药装置和治疗药物应给予同等地位进行考量。
在为患者选择装置时,医生是否考虑到以下4种情况:
① 是否仅考虑到易于患者操作的装置,而忽视了使用干粉吸入器(被动吸入装置)时患者费力吸气的情况?
② 是否意识到患者吸气峰流速不足的问题,而在实际选择装置时并未考虑这一点?
③ 慢阻肺不同严重程度会影响患者的吸气流速,临床医生是否低估了患者使用干粉吸入器时的吸气困难问题?
④能倍乐给肺部沉积带来一定的益处,临床医生是否考虑到其对临床结局的影响?
GOLD 2020强调了吸入装置的重要性。为了让药物沉积到外周气道从而发挥理想疗效,在吸入装置的选择方面通常取决于两项因素[8]:
① 吸入装置因素:包括气溶胶喷出速度、吸入装置喷出药物的持续时间、药物颗粒大小、吸入装置阻力等因素;
② 患者本身因素:包括患者吸气峰流速、患者吸入技术以及依从性等因素。
只有将两项因素结合考量才能达到有效药物治疗的目的,使得药物顺利沉积到小气道,进一步发挥作用。
此外,患者表型与吸入装置有效性密切相关,当患者存在吸气肌乏力、过度通气、各种合并症时,药物疗效将大打折扣。因此,在装置选择时需考虑装置对个体的适用性。
在吸入装置研制、改良的道路上,人们一直力图追求完美的吸入剂型,但绝对完美显然并不存在。通常而言,在装置选择上需考量如下6个方面:
①微细药物颗粒;
②最终产生的微细颗粒比例是否够高;
③气溶胶速度是否够慢,以使药物更好地到达下呼吸道;
④药物喷出的持续时间是否足够长,慢阻肺患者吸气困难,需要足够时间将药物吸入肺部;
⑤口咽部沉积是否够少;
⑥外周肺部沉积率是否够高。
由于慢阻肺疾病本身的特点,许多患者存在吸气流速不足,便导致吸入药物剂量不足[9]。目前的临床工作中面临最多的问题之一,许多患者往往忽略了吸入装置需配合呼吸来使用。对于使用p-MDI装置的患者来说,与良好的协调性相比,不能做到深而慢的吸气是患者常出现的错误。
在为患者选择吸入装置时,需要根据患者自身情况考虑以下3个方面:
①患者能否有意识地吸入装置;
②患者能否产生足够的吸气流速;
③患者能否协调装置使用。
一项通过电子声音记录装置记录吸入有效性的研究表明,48%的慢阻肺患者使用准纳器时吸气流速不足(<35 L/min),影响疗效。多项临床研究表明,约32%-70%不等的门诊或住院慢阻肺患者都达不到最佳吸气流速[10]。
另外一项研究为探讨吸气峰值流速对慢阻肺患者因急性加重入院的影响,研究纳入123例慢阻肺患者,52%(64/128)的患者吸气峰值流速并未达到理想结局(PIF≤60L/min),再分别对其中22例慢阻肺患者(10例使用干粉吸入器,12例使用雾化器)进行分析,尽管2组肺功能存在差异,如下表所示,雾化组(Nebs)慢阻肺30天和90天全因再入院率均低于干粉吸入器(DPI)组,差异具有统计学意义[11]。
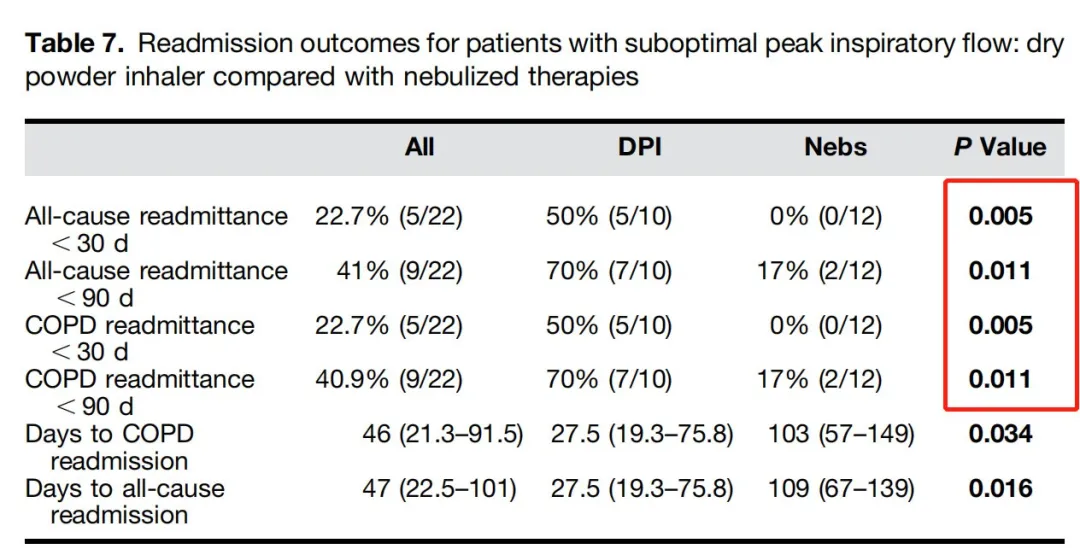
表2:DPI组和Nebs组吸入峰流量不理想患者的再入院结果比较
吸气流速不佳在慢阻肺急性加重患者中较为常见,研究者建议在为急性加重入院的慢阻肺患者选用吸入装置时,需评估测量患者的吸气峰值流速。
综上,在患者使用吸入装置时,不应仅仅考虑装置的易于操作性,此外还需考虑患者自身情况,尤其是患者吸气流速,对于吸入装置的选择是一个非常重要的因素。此外,疾病严重程度不同也会到导致患者吸气流速的改变,影响患者吸入疗效。
Usmani教授在大会上形容:药物好比汽油,装置好比汽车引擎。众所周知,一辆车的引擎质量比用什么标号的汽油更重要。这意味着医生需重视装置的选择,才能使药物更好地发挥作用。
参考文献
[1] Liang L, Cai Y, Barratt B, Lyu B, Chan Q, Hansell AL, Xie W, Zhang D, Kelly FJ, Tong Z: Associations between daily air quality and hospitalisations for acute exacerbation of chronic obstructive pulmonary disease in Beijing, 2013-17: an ecological analysis. The Lancet Planetary health 2019, 3(6):e270-e279.
[2] Doiron D, de Hoogh K, Probst-Hensch N, Fortier I, Cai Y, De Matteis S, Hansell AL: Air pollution, lung function and COPD results from the population-based UK Biobank study. The European respiratory journal 2019, 54(1).
[3] Dinakar C, O'Connor GT: The Health Effects of Electronic Cigarettes. The New England journal of medicine 2016, 375(26):2608-2609.
[4] Barrington-Trimis JL, Leventhal AM: Adolescents' Use of "Pod Mod" E-Cigarettes - Urgent Concerns. The New England journal of medicine 2018, 379(12):1099-1102.
[5] Rabe KF, Hurst JR, Suissa S. Cardiovascular disease and COPD: dangerous liaisons? [published correction appears in Eur Respir Rev. 2018 Nov 21;27(150):]. Eur Respir Rev. 2018;27(149):180057. Published 2018 Oct 3. doi:10.1183/16000617.0057-2018
[6] Ferguson, G. T., Rabe, K. F., Martinez, F. J., Fabbri, L. M., Wang, C., Ichinose, M., … Reisner, C. (2018). Triple therapy with budesonide/glycopyrrolate/formoterol fumarate with co-suspension delivery technology versus dual therapies in chronic obstructive pulmonary disease (KRONOS): a double-blind, parallel-group, multicentre, phase 3 randomised controlled trial. The Lancet Respiratory Medicine. doi:10.1016/s2213-2600(18)30327-8
[7] Agusti, A., Fabbri, L. M., Singh, D., Vestbo, J., Celli, B., Franssen, F. M., … Papi, A. (2018). Inhaled corticosteroids in COPD: Friend or foe? European Respiratory Journal, 1801219. doi:10.1183/13993003.01219-2018
[8] Global Strategy for the Diagnosis, Management,and Prevention of Chronic Obstructive Pulmonary Disease, 2020 REPORT.
[9] Ghosh S, Ohar JA, Drummond MB: Peak Inspiratory Flow Rate in Chronic Obstructive Pulmonary Disease: Implications for Dry Powder Inhalers. Journal of aerosol medicine and pulmonary drug delivery 2017, 30(6):381-387.
[10] Ghosh S, Ohar JA, Drummond MB: Peak Inspiratory Flow Rate in Chronic Obstructive Pulmonary Disease: Implications for Dry Powder Inhalers. Journal of aerosol medicine and pulmonary drug delivery 2017, 30(6):381-387.
[11] Loh CH, Peters SP, Lovings TM, Ohar JA: Suboptimal Inspiratory Flow Rates Are Associated with Chronic Obstructive Pulmonary Disease and All-Cause Readmissions. Annals of the American Thoracic Society 2017, 14(8):1305-1311.


