摘要
与普通病房及病情相对稳定的患者相比。ICU环境微生态更为复杂,标本采集和送检污染机会多,危重症患者接受气管镜检查和支气管肺泡灌洗要求也更为苛刻,标本检测程序和结果解读需要精细准确。因此,ICU危重症患者合格的BALF获取、及时送检、规范检测和结果的正确判读直接影响到患者的诊治,直接决定患者预后。因而有必要制定针对ICU危重症患者的BALF标本留取、送检、检测及结果解读规范。由中华医学会呼吸病学分会呼吸危重症医学学组和中国医师协会呼吸医师分会危重症医学工作委员会牵头撰写ICU中BALF的操作规范,对提高BALF的诊断价值有积极意义。
支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的规范化采集和送检流程,是获得正确BALF微生物学和细胞学结果的前提,而通过不恰当的操作方式获得的结果易误导临床诊疗。1999年欧洲呼吸学会颁布了「支气管肺泡灌洗技术规范化操作和非细胞成分检测指南」[1],2012年美国胸科医师协会颁布了「BALF的细胞学分析在肺间质性疾病中的临床应用」[2],2017年中华医学会呼吸病学分会颁布了「肺部感染性疾病支气管肺泡灌洗病原体检测中国专家共识」[3],均对支气管肺泡灌洗规范化操作流程提出具体指导意见,但上述指南或共识并不适用于重症监护病房(intensive care unit,ICU)这一特殊医疗单元,亟需制定针对ICU危重症患者的BALF标本留取、送检及临床应用的操作规范。为此,中华医学会呼吸病学分会呼吸危重症医学学组及中国医师协会呼吸医师分会危重症医学工作委员会联合制定了本规范,以期为ICU患者的BALF采集、送检及临床应用提供标准化流程。
一、适应证与禁忌证
(一)适应证
1、危重症患者支气管-肺疾病的诊断及鉴别诊断。
2、明确重症肺炎的病原学。
3、明确支气管-肺部疾病的病因、发病机制等需要获取标本者。
4、下呼吸道疾病的内镜治疗(气道阻塞,黏痰或痰栓的清除等)[4,5]。
(二)禁忌证
危重患者接受支气管镜下肺泡灌洗无绝对禁忌证。相对禁忌证如下,并建议有经验的医师进行操作。
1、严重的低氧血症:鼻导管吸氧、面罩吸氧、经鼻高流量氧疗及无创呼吸机的患者吸氧浓度(FiO2)为0.9~1.0不能维持脉搏氧饱和度>90%;经气管插管机械通气患者呼气末正压>15 cmH2O(1 cmH2O=0.098 kPa);气道峰压>35 cmH2O或PaO2/ FiO2比值<80 mmHg(1 mmHg=0.133 kPa),气管插管内径过小(<7 mm)[6,7,8,9,10]。
2、心血管病急重症:4周内急性冠脉综合征、恶性心律失常、急性心力衰竭、血液动力学不稳定(尽管应用血管活性药物仍表现为平均动脉压<55>0.15 μg·kg-1·min-1或多巴酚丁胺>5 μg·kg-1·min-1)[6]。以上情况原则上应推迟支气管镜操作。
3、凝血功能紊乱:血小板计数<20×10^9/L或国际标准化比值(INR)>3,凝血酶原时间(PT)或活化部分凝血活酶时间(APTT)大于1.5倍正常值[3,6,7,11,12]。以上情况建议输注血小板或血浆后行支气管镜操作。
4、颅内高压>20 mmHg、癫痫、颈椎不稳、气道痉挛、上腔静脉阻塞综合征、主动脉瘤等,应选择深度镇静或全身麻醉下操作[13,14]。
5、近期大咯血者若未行支气管动脉栓塞,有再次大咯血风险者。
二、支气管肺泡灌洗围操作期工作
(一)消毒与防护
1、环境消毒:地面应用400~700 mg/L有效氯的含氯消毒液擦拭,作用时间30 min。
2、物品消毒:物体表面使用400~700 mg/L有效氯的含氯消毒液或1 000~2 000 mg/L季铵盐类消毒液擦拭,有条件时可使用消毒湿巾擦拭,尤其是患者和医务人员双手高频接触的环境表面如病床栏杆、床边桌、呼叫按钮、监护仪、微量泵、床帘等。
3、针对如新型冠状病毒等具有高危传播风险感染患者进行检查前一定要进行充分风险评估,如需要操作建议在负压病房进行,按照三级防护级别(佩戴N95口罩,一次性防护服加防渗透隔离衣,2层乳胶手套,2层鞋套,全面型呼吸防护器或正压式头套)进行操作。
(二)物品准备
1、常规物品:
无菌隔离衣、无菌手套、无菌治疗巾;无菌石蜡油、灭菌注射用水500 ml、酶洗液;注射用盐酸丁卡因50 mg、2%盐酸利多卡因或2%盐酸利多卡因凝胶、雾化器、麻醉喷壶、常用镇静药物(如右美托咪定、丙泊酚等);0.9%氯化钠100 ml、0.12%洗必泰(或无菌生理盐水、0.12%氯已定溶液)、10 ml及20 ml注射器、负压吸引器、一次性无菌集痰器、一次性使用牙垫、一次性口腔护理包、紫外线灯、500 mg/L或1000 mg/L含氯消毒剂(或消毒湿巾)等。
2、抢救物品:
监护室急救物品车(配备常规抢救用药物器械等)。
(三)患者准备
1、基础准备:
符合适应证患者由患者本人或授权家属签署知情同意书,有相对禁忌证者根据病情酌情进行预处理;镇静患者建立中心静脉通路。
2、围操作期准备:
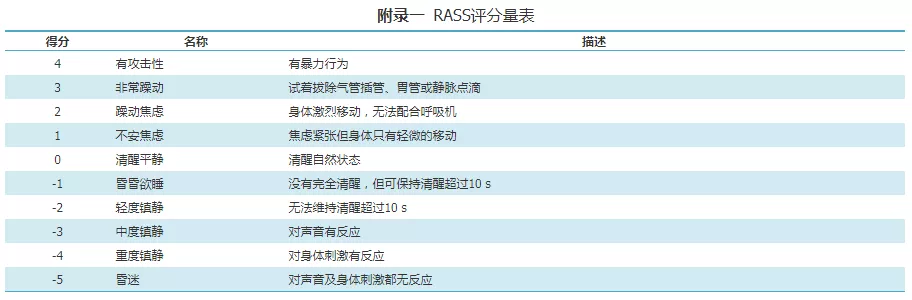
(1)消化道准备:自主进食者需术前4~6 h禁食,留置鼻胃管者术前4 h停鼻饲,留置空肠营养管者术前0.5 h停鼻饲,深镇静(richmond agitation-sedation scale,RASS评分<-3分)者术前8 h禁食,均术前2 h禁水[15];如存在胃排空障碍或胃潴留,适当延长禁食水时间;如有活动义齿,于检查前取下(RASS评分量表见附录一)。
(2)体位准备:经鼻高流量氧疗(high-flow nasal cannula,HFNC)及普通氧疗者选取仰卧位;无创、有创正压通气者选取30°~45°半卧位;高误吸风险者选取至少30°半卧位[16]。
(3)检查结束后,浅镇静(RASS评分≥-3分)2 h、深镇静6 h内患者不能进食水或鼻饲,保持至少30°半卧位2 h以降低误吸风险[17,18];应在检查中及结束后2 h避免患者剧烈咳嗽,以减少上气道水肿或黏膜出血。
3、麻醉前预处理:
(1)无人工气道:口鼻腔护理,推荐使用0.12%洗必泰(或无菌生理盐水);
(2)有人工气道:①检查气囊,维持囊压在25~30 cmH2O;②吸痰管先清除气管导管内分泌物,再清除口鼻腔分泌物;③口鼻腔护理,推荐使用0.12%洗必泰[16]。
4、麻醉、镇静镇痛:
(1)HFNC及普通氧疗:雾化+局部麻醉。①雾化:将2%的盐酸利多卡因5 ml加入雾化面罩中雾化;②局部麻醉:首选盐酸利多卡因和盐酸丁卡因,ICU中常用喷雾联合经鼻滴注法。喷雾法:7.5 ml生理盐水配50 mg注射用盐酸丁卡因加入喉头喷雾器内,行分段黏膜表面喷雾麻醉,先咽部后鼻腔,间隔4~5 min,重复3次。经鼻滴注法:麻醉起效后,经鼻腔滴入2%盐酸利多卡因(3~5 ml,可分次),借助患者深吸气将药物吸入气管达到麻醉的效果。
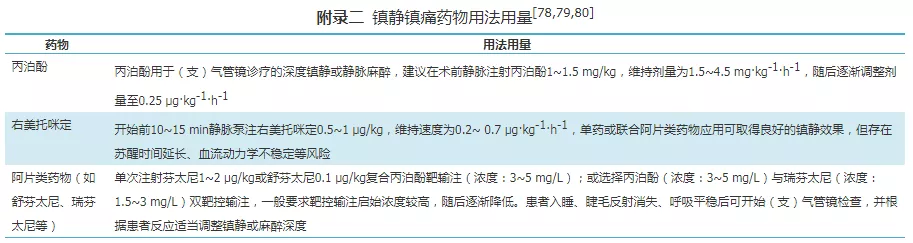
(2)无创正压通气:雾化+局部麻醉/镇静。①雾化:将2%的盐酸利多卡因5 ml加入T管雾化器/震动筛孔雾化器中雾化;②局部麻醉:同HFNC及普通氧疗;③镇静镇痛:无人工气道患者行支气管镜检查时,应用镇静药物需进行评估(RASS评分在0~-3分,警惕镇痛镇静药物对呼吸、循环的抑制作用。镇静药物推荐短效类镇静剂(如右美托咪定,丙泊酚等),个别患者可以联合应用阿片类药物(如舒芬太尼、瑞芬太尼等),以提高患者舒适度[19,20](镇静药物使用方法见附录二)。
(3)有创正压通气(气管插管/气管切开):雾化+镇静镇痛。①雾化:同无创正压通气的雾化,注意雾化器应连接在呼吸机管路的吸气端,也可使用呼吸机雾化功能进行雾化。②镇静镇痛:在保证患者血流动力学稳定的情况下,首先给予镇痛,药效达到最大后镇静,以避免镇静过量并提高患者耐受度;若患者配合不佳,或者新型冠状病毒等具有高危传播风险感染患者,有创机械通气患者可联合肌肉松弛药(详见附录二)。
(四)注意事项
1、支气管镜检查前高浓度氧疗:
为预防检查过程中出现严重低氧,在支气管镜检查期和恢复期应给予最高浓度氧气15 min。
2、低氧血症高危风险患者建议在现有呼吸支持条件下检查:
未进行有创正压通气的严重低氧血症或行支气管镜检查前持续无创机械通气的患者,可在检查时使用HFNC或带有支气管镜插入口的口鼻面罩/HE全脸罩(图1)进行无创正压通气保证氧气供给[21]。
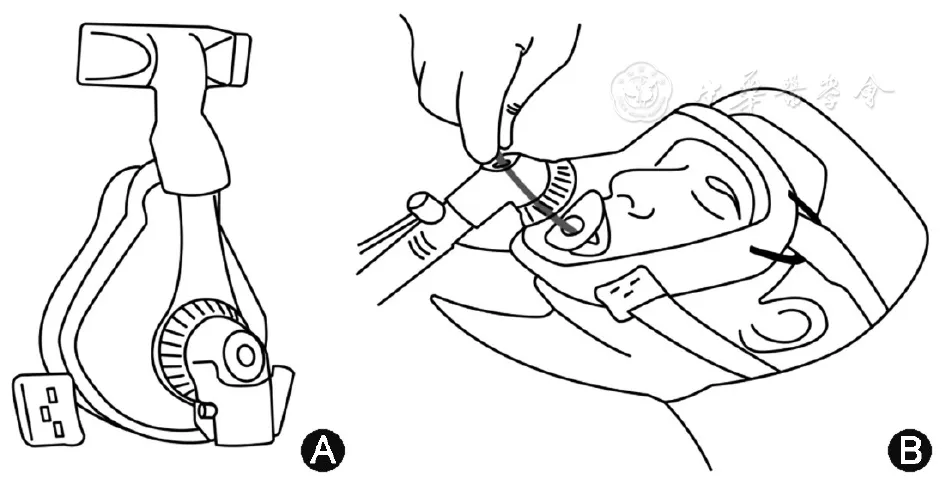
【图1】带有支气管镜插入口的口鼻面罩(图A)和全脸罩(图B)
3、HFNC:
初始参数设置:流速≥60 L/min、给予最高浓度氧,并根据具体情况进行调节,维持SpO2≥90%[22,23]。
4、无创呼吸机设置:
术中呼吸机模式根据临床情况选择,参数设置:FiO2为0.5~1.0,呼气末正压(EPAP)为5 cmH2O,吸气末正压(IPAP)不超过30 cmH2O,呼气潮气量为8~10 ml/kg,维持SpO2≥90%[24,25]。
5、有创呼吸机设置:
进行支气管镜检查时,需调整FiO2为1.0,PEEP为0~2 cmH2O(ARDS患者可适当增加),支持压/控制压可进行适当调整以保证通气量,深镇静时调整为控制通气模式[20]。检查结束后,应调回原有参数设置,ARDS患者可通过呼吸力学监测重新进行PEEP滴定,以减少肺泡塌陷。
6、支气管镜外径选择:
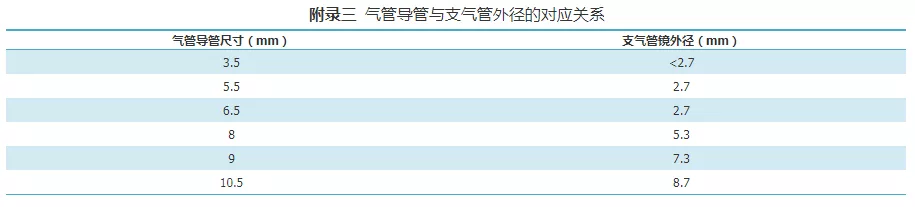
有人工气道患者应根据患者气管/支气管病变情况、气管导管内径、气道支持装置(ET或喉罩)的通道内径仔细选择支气管镜的外径(详见附录三)[26]。
(五)通用流程见图2。
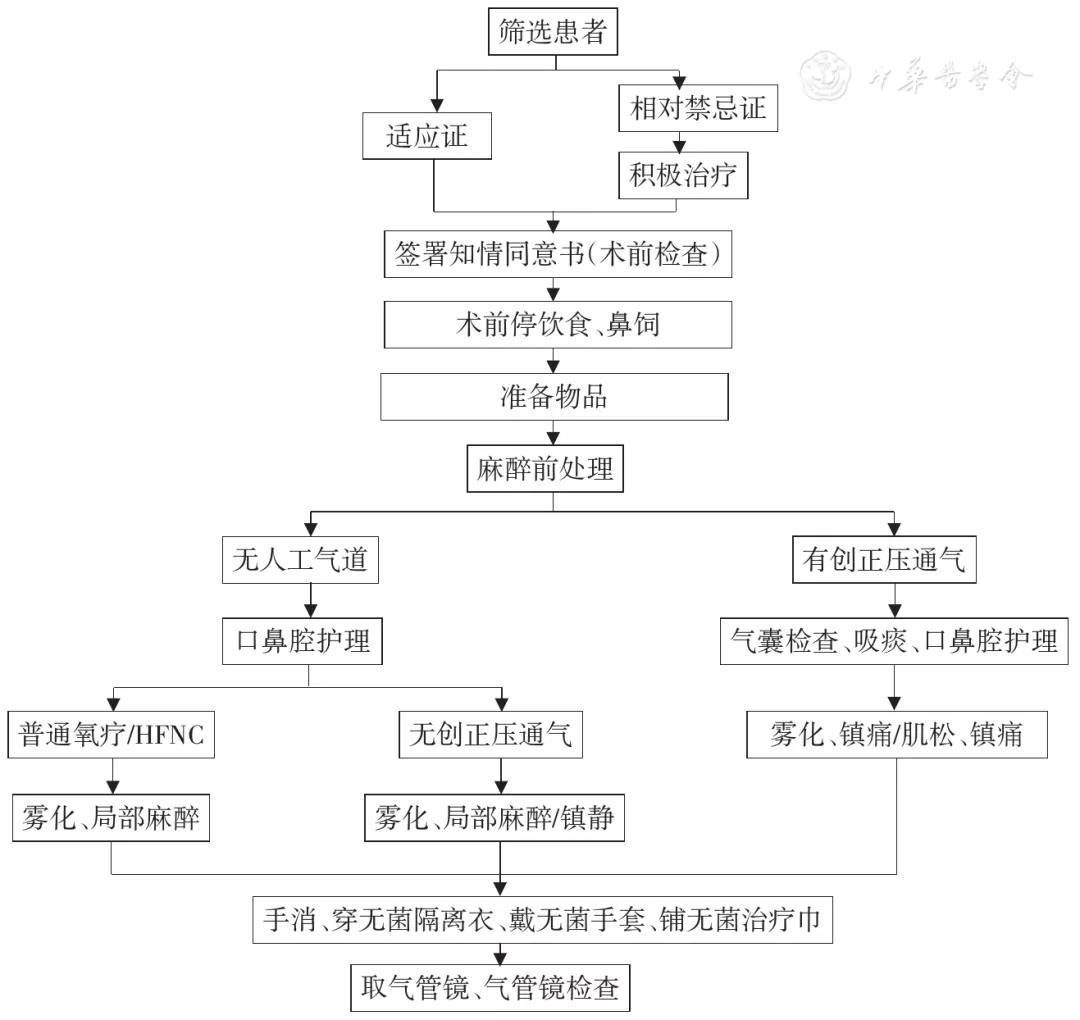
【图2】支气管镜操作前准备流程图
三、支气管肺泡灌洗的操作流程
(一)支气管镜进入流程进入方式分为经鼻、口或人工气道进入
1、经鼻:
润滑液擦拭支气管镜插入部分(推荐使用利多卡因凝胶[27]),选择合适鼻道插入,使镜体保持「中位」,鼻甲肥大者先滴入麻黄素或改经口进入,避免损伤鼻黏膜。进入鼻腔后避免负压吸引,当镜前端至声门时给予注入2%盐酸利多卡因1~2 ml局部表面麻醉。当支气管镜镜前端至隆突上,给予2%盐酸利多卡因1~2 ml气道局部麻醉,到达目标肺段后,注入2%盐酸利多卡因1~2 ml局部麻醉后,对目标肺段进行灌洗[28](进入气道后避免使用过多额外利多卡因,建议控制在5 mg/kg范围,总剂量不超过512 mg[29])。
2、经口:
经口操作前带咬嘴或牙垫(有义齿应取出),避免损坏支气管镜。
3、无创正压通气下经鼻、口:
使用配备有插入硅胶隔膜的口鼻面罩者经鼻或经口进入,使用鼻罩者,经口进入(带咬嘴或牙垫)。必要时轻度镇静,通气模式根据临床情况选择[25,30],可选间歇正压通气/双水平正压通气/持续气道正压通气,吸氧浓度(FiO2)为0.5~1.0(BAL前FiO2设为1.0,预氧合5~15 min),调整呼吸机参数(参考第二部分),使SpO2维持在90%以上[31,32]。进入后操作同前。
4、气管插管:
建议支气管镜外径与气管插管内径有至少1.5~2 mm差值[33],支气管镜插入部分充分润滑。患者给予镇静处理,必要时加用肌肉松弛药物,需持续有创机械通气处理,呼吸机设为控制模式(优先选择容量控制通气模式[34]),FiO2设定为1.0(灌洗前FiO2设为1.0,预氧合5~15 min),慢呼吸频率(10~12次/min),对于非重度ARDS或氧合较好者,将PEEP设置为0 cmH2O;对于重度ARDS,肺泡萎陷风险高者,PEEP设置为原有水平50%左右,以维持有效目标氧合,通过带硅胶隔膜的T型接头经气管插管进入,余操作同前,操作结束后FiO2设为1.0继续维持10 min[24,35,36]。经气切套管时,支气管镜经气切套管进入,后续操作同前。
(二)灌洗操作
1、部位选择:
通过胸部影像学检查确定病变部位,选择病变最显著部位或进展最迅速部位进行灌洗[36,37,38]。(1)局限性病变:选择病变部位,新出现或逐渐进展的浸润性病灶;(2)弥漫性病变:选择非下垂部位,推荐最佳部位为右肺中叶或左肺上叶舌段,BALF可获得最佳回收率。
2、灌洗液选择:
支气管镜顶端嵌顿于目标肺段或亚段支气管开口位置进行肺泡灌洗[39],常用的灌洗液选择0.9%无菌生理盐水,操作前加热至37 ℃(也可使用室温无菌生理盐水),用注射器经支气管镜操作孔分次快速注入,每次注入20~50 ml,常规灌洗3~5次,总量控制在60~120 ml[3,40]。
3、负压吸引:
负压管连接回收容器,进入灌洗部位前避免负压吸引,负压管连接回收容器,生理盐水注入目标肺段后,立即给予适当负压25~100 mmHg吸引回收BALF[41],可采用「点吸」法吸引,减少支气管管腔塌陷,增加回收量,总回收率应>30%[2],灌洗时间控制在5 min以内为宜[38]。
4、BALF收集:
为避免灌洗液细胞黏附造成损失,建议选用有机硅涂层玻璃或聚丙烯容器收集[42]。第1管BALF可能混有非病变处病原菌,影响检测结果,建议单独处理作为临床参考依据,第2管送检病原微生物检验,第3管送检细胞计数及分类,其余根据临床需要进行送检[3,42,43]。
(三)注意事项
1、对于初次检查或病情稳定者,先对各主要叶段支气管进行快速检查,再进入目标肺段进行灌洗操作;而病变位置明确或病情危重者,直接进入目标肺段进行灌洗[28]。尽量减少在未到达目标肺段前进行吸引,避免非病变部位的气道分泌物造成污染。
2、支气管镜进入目标肺段灌洗时嵌顿要适度,若嵌顿不佳,可造成灌洗液外溢至其他部位,BALF回收量减少;若嵌顿过度,可造成气道黏膜损伤及负压回收时气管塌陷不能顺利回收,影响回收率。
3、为避免口咽部和气管支气管非病变处病原菌对BALF的污染[44],有条件可行保护性肺泡灌洗(图3)。保护性肺泡灌洗操作如下:当支气管镜送达目标支气管段开口后,经操作孔道插入专用保护性带气囊双管腔导管,导管前端予可溶性管塞封堵(常用聚乙二醇,防污效果好,且易被肺部吸收),伸入目标亚段,向气囊管腔注入1.5~2 ml的气体使其充盈,封堵目标段或亚段支气管管腔,实现最佳闭塞,再经保护性远端导管推注少量生理盐水,冲掉导管头部的可溶性管塞,用20 ml注射器每次注入37 ℃生理盐水10~20 ml进行保护性支气管肺泡灌洗,用注射器手工回收BALF[45]。
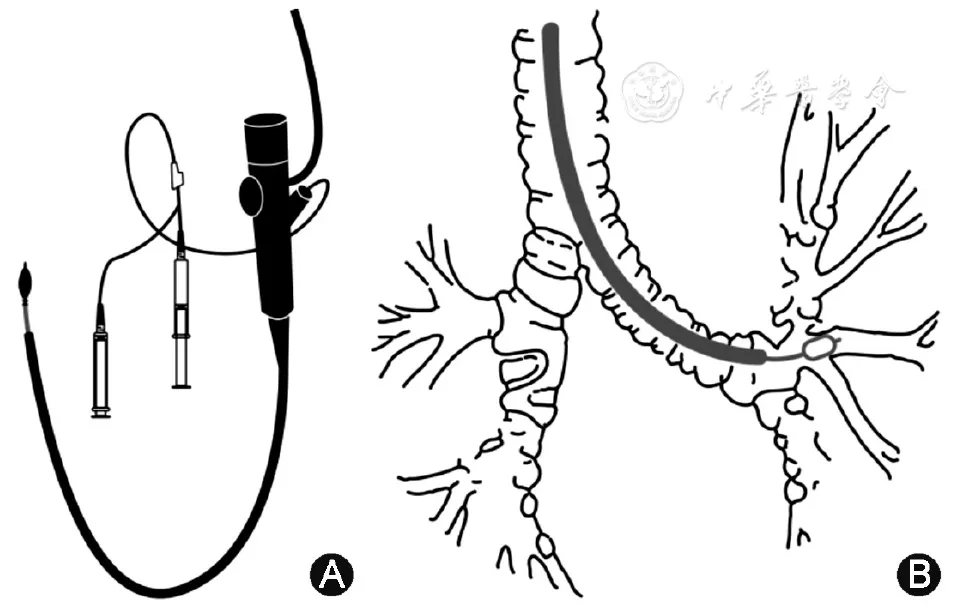
【图3】支气管镜及保护性远端导管(A),支气管镜前端在目标肺段,带气囊的导管楔入灌洗肺段(B)
4、操作过程严密监测患者生命体征、SpO2、呼吸机参数指标;动作轻柔,充分麻醉,避免剧烈咳嗽或负压过大损伤支气管引起黏膜出血,导致BALF红细胞过多对检测结果产生影响。负压吸引保持在100 mmHg以下,并避免出现明显的气道塌陷[41]。
四、支气管肺泡灌洗的并发症及处理
支气管肺泡灌洗并发症分为术中并发症和术后并发症,术中并发症主要包括低氧血症、出血、气道痉挛、喉头水肿、心脏及血流动力学并发症等,术后并发症常见为发热。
(一)术中并发症
1、低氧血症:
(1)面罩吸氧和高流量氧疗患者:SpO2<90%时,保证FiO2为1.0,上调流速,以维持SpO2>90%,30 s后仍未达到目标氧饱和度者应退镜中止操作[22,23],待SpO2上升至90%或更换为无创正压通气条件下再行肺泡灌洗。
(2)无创正压通气患者:SpO2<90%时FiO2上调至1.0、EPAP上调2~4 cmH2O[30];若SpO2<80%超过1 min,退镜中止操作[46]。SpO2持续<85%需气管插管机械通气[25]。
(3)有创机械通气患者:SpO2<90%时,保证FiO2为1.0,增加PEEP[47];SpO2<80%超过1 min,退镜中止操作[46],但非绝对禁忌证。
2、出血:
(1)无人工气道患者:①少量出血(<30 ml):减小回抽负压(<100 mmHg,以调整到在吸引时管腔不塌陷为宜[2,3]),并调整支气管镜位置至管腔中央,减少黏膜损伤,出血多可自行停止;仍有出血可经支气管镜注入肾上腺素(浓度1∶10 000或1∶20 000,总剂量不超过0.6 mg[48])。②中等量出血(30~100 ml):经支气管镜局部注入4 ℃冰盐水(50 ml/次[49])+肾上腺素,必要时局部注入凝血酶(1 000 U/ml,5~10 ml)[50]。③大量出血(>100 ml):头低位并出血侧卧位,经支气管镜注入冰盐水、肾上腺素或凝血酶,快速吸引,清除血凝块,垂体后叶素雾化或静滴。若活动性出血未能停止或出现低氧血症,立即予双腔气管插管或健侧气管插管单侧肺通气。必要时球囊填塞止血、支气管动脉栓塞或外科手术治疗[50]。
(2)有人工气道患者[51]:①少量或中等量出血:处理同无人工气道患者。②大量出血:头低位,调整气管插管位置,行健侧肺通气。快速抽吸,清除凝血块,药物止血。出血仍未停止者球囊填塞止血、支气管肺动脉栓塞或手术治疗。
3、支气管痉挛:
(1)非有创机械通气患者:立即退镜,FiO2调至1.0,药物救治[39,52]:雾化吸入沙丁胺醇2.5 mg、异丙托溴铵0.5 mg、布地奈德1~2 mg等药物;未缓解者静脉给予甲泼尼龙40~80 mg,极重度哮喘发作患者甲泼尼龙剂量可增加至160~320 mg/d[53]。持续未缓解或SpO2持续<85%者需气管插管有创正压通气。
(2)有创机械通气患者:首选P-SIMV+PSV模式,参数[39,52]:FiO2为1.0,吸呼比≥1∶3,慢呼吸频率6~12次/min,小潮气量为6~10 ml/kg,PEEP为0 cmH2O,维持SpO2为90%~95%;支气管舒张剂用法同无人工气道患者。气道痉挛仍未缓解者给予适当镇静、肌肉松弛[39]。
4、喉痉挛及喉头水肿:
非有创机械通气患者:立即退镜中止操作,雾化吸入布地奈德或复方异丙托溴铵,未缓解者静脉给予糖皮质激素。若持续加重或出现低氧血症,予气管插管机械通气。气管插管困难者紧急行环甲膜穿刺或气管切开。
5、心血管并发症:
(1)非有创机械通气患者:退镜中止操作。心律失常(常见窦性心动过速、室上性心动过速、房颤、心动过缓):FiO2上调至1.0,3 min仍未好转者复查心电图针对性处理。低血压:补液,静脉予去甲肾上腺素(起始剂量<0.15 μg·kg-1·min-1)、多巴胺救治(起始剂量<5 μg·kg-1·min-1)[54],正在使用血管活性药物患者适当增加剂量。存在缺血性心脏病(如心肌梗死)基础疾病患者,适度镇静[47]。心跳骤停(极其罕见):心肺复苏,紧急气管插管。紧急呼叫专科处理。
(2)有创机械通气患者:退镜中止操作,心律失常处理同非有创机械通气患者。低血压:停用镇静剂,降低PEEP,补液、静脉给予去甲肾上腺素或多巴胺[24,25]。心肌缺血加重者,降低平均气道压和PEEP[24,25],应用硝酸酯类药物扩张冠状动脉。
(二)术后并发症
主要为发热,常见原因为肺炎和血流感染[47],亦可见于吸收热。完善床旁X线胸片、血细菌真菌培养、血常规、CRP、PCT检查。如X线胸片发现灌洗部位新发炎症改变或原有感染范围扩大,提示可能有新的感染,根据BALF快速病原学检查结果调整抗感染方案。血培养阳性提示为血流感染,根据BALF病原学及血培养结果调整抗感染方案。
五、支气管肺泡灌洗液的标本评价
(一)BALF离心和涂片
标本获取后需立即观察灌洗液的性状和量,如含有黏液成分的标本,可用无菌纱布过滤或使用0.1%二硫苏糖醇进行溶解[2]。溶解方法:一般选择0.5 ml的0.1%二硫苏糖醇与2 ml的BALF混合(配制比例约为1∶4),灌洗液黏液成分较多,可适当提高比例。溶液混合后,于37 ℃放置5~10 min,一般可以完全溶解。溶解液30 min内完成离心及制片。灌洗液标本中细胞及微生物含量少,如需观察细胞、细菌形态及含量可应用离心机进行1 600 g离心10 min(g=r×11.18×10-6×rpm2)后弃上清液,留取0.3 ml的BALF,用移液枪混匀。选取20 μl滴注在载玻片的中央,以画圈的方式涂出面积大小约1 cm2的标本涂片2张。标本涂完后宜放置于室温,自然干燥[55]。涂片应在生物安全柜内操作[56]。涂膜要厚薄适宜,且分布均匀(图4)。
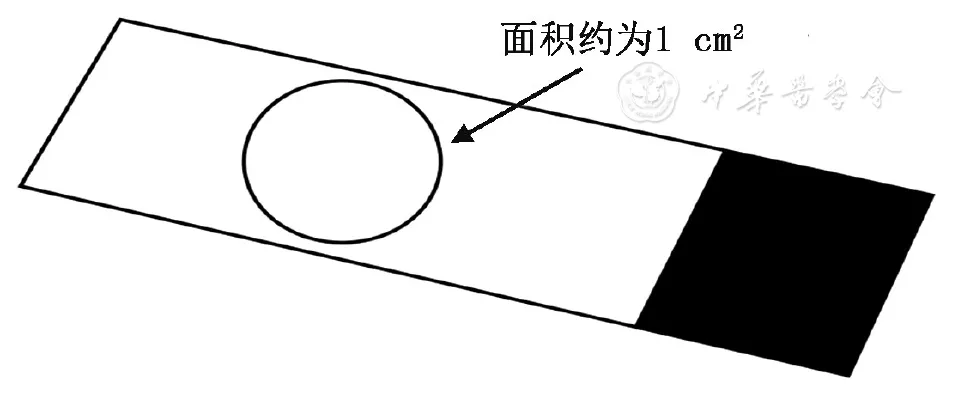
【图4】BALF标本载玻片示意图
(二)染色
1、常用染色方法包括迪夫快速染色(Diff-quick stain),革兰染色(Gram stain);特殊染色包括六胺银染色(Hexamine silver staining)、墨汁染色(India ink staining)等。
(1)迪夫快速染色:①迪夫A(Diff quik A)溶液,主要成分为曙红、甲醇;②迪夫B(Diff quik B)溶液,主要成分为亚甲蓝;③磷酸盐缓冲液,主要成分为磷酸盐。分别把迪夫A溶液、迪夫B溶液、磷酸盐缓冲溶液适量倒于带盖的染缸中;把干燥后的玻片浸泡在迪夫A溶液中20~30 s;于磷酸盐缓冲溶液中洗掉迪夫A溶液,稍甩干缓冲液;再把涂片浸泡于迪夫B溶液中20~30 s;水洗、干燥、镜检。
(2)革兰染色:革兰染色一般包括初染、媒染、脱色、复染等4个步骤,具体操作方法是:①涂片、干燥同上,固定方法:常用高温进行固定。即手持载玻片一端,标本面朝上,将涂有标本的载玻片快速来回通过酒精灯外焰3~4次,共约3~4 s,冷却后进行染色。要求玻片温度不超过60 ℃,以玻片背面触及手背皮肤不觉过烫为宜;也可选择丙酮固定。②草酸铵结晶紫染1 min后自来水冲洗;③加碘液覆盖涂面染约1 min后自来水冲洗;④加95%酒精数滴,并轻轻摇动进行脱色,30 s后自来水冲洗;⑤蕃红染色液(稀)染30 s后,自来水冲洗。干燥,镜检。
(三)标本评价
1、合格BALF标本为低倍镜下鳞状上皮细胞占全部细胞(不包括红细胞)的比例<1%,柱状上皮细胞<5%时,红细胞<10%(除外创伤/出血因素);若标本质量不合格,需在报告单中注明[3,55]。鳞状上皮细胞比例大于5%,表明标本包含上呼吸道成分,不建议送检二代测序,常规培养仍可送检(结果仅供参考)。
2、健康非吸烟者的BALF细胞构成的参考值范围为:巨噬细胞>85%,淋巴细胞10%~15%,中性粒细胞≤3%,嗜酸粒细胞≤1%,鳞状上皮细胞或纤毛柱状上皮细胞均≤5%[2]。健康吸烟者的BALF中细胞总数明显增高,一般为不吸烟者的3~5倍,增多的细胞主要为肺泡巨噬细胞和中性粒细胞[42,57]。
(四)标本快速现场评价
1、细胞学评价可使用迪夫快速染色,优点包括不需要立即固定,细胞损失少。染色过程简单、快速,且更容易识别细胞质和内含物[58](图1)。
(1)淋巴细胞>15%:提示结节病、非特异性间质性肺炎、过敏性肺炎、药物性肺炎、胶原血管病、放射性肺炎、隐源性机化性肺炎、淋巴增殖性病变等。其中当淋巴细胞计数>25%时提示肉芽肿性疾病(结节病、过敏性肺炎或慢性铍病)、非特异性间质性肺炎、药物反应、淋巴间质性肺炎、隐源性机化性肺炎或淋巴瘤,当淋巴细胞计数>50%时强烈提示过敏性肺炎或富细胞型非特异性间质性肺炎。
(2)中性粒细胞>3%:提示胶原血管病、特发性肺纤维化、吸入性肺炎、细菌或真菌感染、支气管炎、石棉肺、急性呼吸窘迫综合征(ARDS)、弥漫性肺泡损伤等。其中当中性粒细胞计数>50%时常强烈提示急性肺损伤、吸入性肺炎或化脓性感染。
(3)嗜酸粒细胞>1%:提示嗜酸粒细胞肺炎、药物性肺炎、骨髓移植、哮喘、支气管炎、变应性肉芽肿性血管炎、过敏性支气管肺曲霉菌病、感染(细菌、真菌、蠕虫、肺孢子虫)、霍奇金病。另外,嗜酸粒细胞计数是否>25%可鉴别急性或慢性嗜酸粒细胞肺炎。
(4)当肥大细胞>1%、淋巴细胞>50%和中性粒细胞>3%时,强烈提示急性过敏性肺炎[3]。
(5)如见中性粒细胞或巨噬细胞吞噬病原微生物现象,需报告吞噬细胞所占同种细胞百分比,吞噬比例大于5%提示感染,吞噬病原菌为致病菌。
2、微生物学评价可使用革兰染色或迪夫快速染色(图5)。有经验的医师可辨别出常见的真菌和部分细菌。如念珠菌,曲霉,毛霉,隐球菌,金黄色葡萄球菌,肺炎链球菌,肺炎克雷伯菌,铜绿假单胞菌和鲍曼不动杆菌等,若结合特殊染色识别率更高。

【图5】BALF标本快速现场评价方法。图A和图C为迪夫快速染色(低倍放大),图B和图D为革兰染色(高倍放大),箭头为中性粒细胞吞噬现象
3、采用二步法观察涂片:先用低倍镜(40或100倍)扫描全片,观察是否存在可疑细胞、粗大菌丝,再用高倍镜(400或1 000倍)作细胞分类、鉴定细胞性质、观察微生物形态、判断微生物数量及有无中性粒细胞吞噬现象(图5A和图5D)。
(五)BALF淀粉酶
BALF淀粉酶浓度随误吸危险因素的数量增加而增加,BALF淀粉酶浓度超过125.9 U/L可以高度怀疑发生误吸,且浓度高于125 U/L患者的细菌性肺炎患病率明显增加。BAL淀粉酶有一个相对较长的检测窗口,即误吸后72 h以内仍可检测到升高的淀粉酶[59]。
六、BALF的保存及送检
对于ICU患者的BALF标本,建议使用有机硅涂层玻璃或聚丙烯或其他用于悬浮组织培养的塑料无菌容器收集。送检量一般需要≥5 ml,建议10~20 ml[2]。新冠肺炎等烈性呼吸道传染病患者BALF标本要严格按照生物安全有关要求对样品进行包装盒运送,需要时,运送箱的表面可用有效氯500~1 000 mg/L的含氯消毒剂擦拭或者喷洒至表面湿润进行消毒,消毒15 min。
(一)涂片及培养
1、普通细菌、真菌涂片及培养的BALF标本:无菌容器,标本>1 ml,室温保存≤2 h,超过2 h,4 ℃保存≤24 h。如转运时间≥2 h,宜使用转运培养基或在冷藏条件下转运[60]。
2、对周围环境或对低温敏感的细菌(如流感嗜血杆菌和肺炎链球菌等)的标本:采集后不宜冷藏,应立即送检。
3、如怀疑厌氧菌感染,可以考虑床旁采样。如不能床旁采样可常温下转运,宜在采集后30 min内送至实验室,转运过程中标本尽可能与空气隔绝。
4、病毒培养:室温保存≤2 h,4 ℃保存≤5 d。超过5 d,需-70 ℃保存[61]。
5、寄生虫:镜检虫卵,新鲜标本4 ℃保存≤1 h[61]。
(二)抗原抗体检验[61]
1、病毒快速抗原及直接荧光抗体检验:室温保存≤2 h,4 ℃保存≤5 d。超过5 d,需-70 ℃保存。
2、真菌(1-3)-β-D-葡聚糖(G试验):室温保存≤2 h,4 ℃保存≤5 d。超过5 d,需-70 ℃保存。
3、曲霉半乳甘露聚糖抗原(galactomannan,GM)检测:室温保存≤4 h,4 ℃保存≤24 h。超过24 h,宜在-20 ℃条件下,可存放11个月[3,61,62]。
4、组织胞浆菌抗原室温保存≤2 h,4 ℃保存≤72 h。
5、皮炎芽生菌抗原4 ℃保存≤2~14 d。
6、肺孢子菌直接荧光抗体检测室温保存≤2 h,4 ℃保存≤7 d。
(三)分子诊断
[如核酸扩增检测、聚合酶链反应技术、宏基因组新一代测序技术(metagenomics next-generation sequencing,mNGS)等]
1、标本采集:无需任何预处理、新鲜合格的BALF收集于干燥无菌、无DNA/RNA酶的冻存管中,送检量不少于3 ml。
2、标本保存:细菌真菌等分子诊断检测,若不能及时进行冻存,4 ℃保存≤24 h。如进行核糖核苷酸(RNA)建库测序,样本需在-70 ℃以下保存,且不应超过6个月;如进行脱氧核糖核苷酸(DNA)建库测序,样本在-20 ℃保存≤1周,-70 ℃以下可长期保存。病毒核酸检验,室温保存≤30 min,4 ℃保存≤4 h,超过4 h需-70℃保存。
3、标本转运:宜在-70 ℃或更低温度下转运。标本需采用干冰(干冰温度为-78.5 ℃)在医用冷藏加厚泡沫箱里进行密封运输,且需保证标本在送至检测单位时仍有干冰覆盖(防止优势菌群的生长或者RNA病毒的降解)。在运送过程中宜保存在适当的病毒转运液或其他相应的缓冲液中[63]。
4、储存样本必须避免反复冻融。
(四)BALF细胞计数和分类、T淋巴细胞亚群、细胞学检测
室温保存≤30 min。如果标本在30~60 min后到达实验室,建议4 ℃(冰上)保存运输。如果标本超过60 min后到达实验室,建议先250~300 g离心10 min(保持细胞完整性),然后悬浮于营养液,4 ℃保存≤24 h。BALF标本不应冷冻或干冰运输。超过24 h的标本不再适合细胞计数及分类[2]。
七、BALF分类计数
(一)送检的量
用无菌容器收集BALF标本,送检量为10~20 ml(至少5 ml)[2,3],贴好标本信息。
(二)操作流程
1、标本送至实验室后,需立即处理。先观察灌洗液的性状、颜色和总量,并记录。如果含有黏液成分的标本,可用无菌纱布过滤或使用0.1%的二硫苏糖醇进行溶解,并记录处理后的总量[2]。
2、将上述回收灌洗液在4 ℃下,以250~300 g离心10 min,细胞沉淀重悬于3~5 ml细胞培养基,如MEM 125 mmol/L HEPES或RPMI1640 125 mmol/L HEPES,制成细胞悬液(也可用生理盐水或不含Ca2+离子和Mg2+离子的Hank′s液重悬)[2,55,64]。上清液在-70 ℃储存,用做可溶性成分的检测。
3、在计数板上计数BALF中细胞总数,一般以1×10^6/ml表示。如果细胞数过高时,再用细胞重悬液稀释,调整细胞数为5×10^6/ml,并同时将试管浸入碎冰块中备用[55]。
4、采用细胞离心涂片装置,加入备用细胞悬液(细胞浓度为5×10^6/ml)100 μl,在4 ℃下以(250~300)×g离心10 min,通过离心作用将一定数量的BALF细胞直接平铺于载玻片上。取下载玻片立即冷风吹干,一般用瑞氏-姬姆萨复合染色法(Wright-Giemsa staining)或苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色[2,41,55,64,65]。
5、先在低倍光学显微镜(<40倍)下观察整张片子的情况,然后在高倍光学显微镜下(≥40倍)计数至少400个细胞,进行细胞分类计数[2,3]。支气管灌洗液中常见细胞形态见图6。
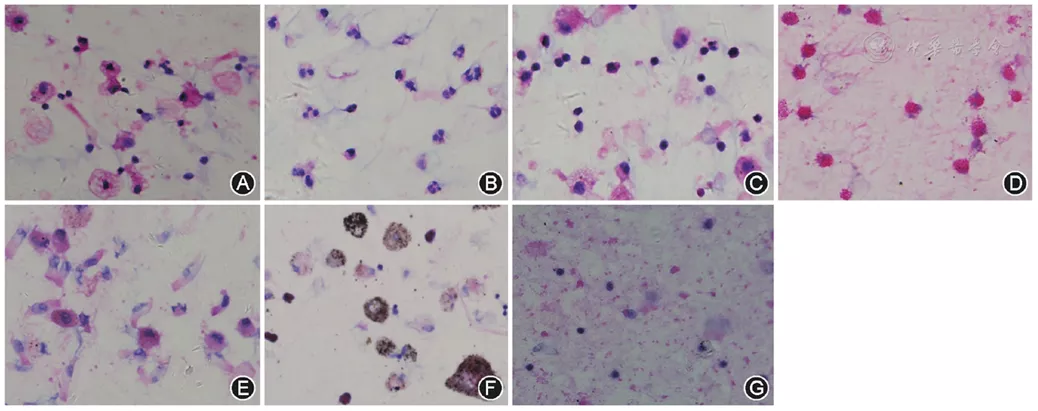
【图6】常见支气管灌洗液中各类细胞的形态(HE 高倍放大)。图A~G分别为肺泡巨噬细胞、中性粒细胞、淋巴细胞、嗜酸粒细胞、不合格标本、尘细胞、肺泡蛋白沉积症患者灌洗液
(三)注意事项
1、标本采集后,需立即送检。室温1 h内送至实验室,如超1 h,需(250~300)×g离心10 min后,在细胞培养基中重新悬浮,并在4 ℃下保存,可保留24 h。如没有离心机,可将细胞培养基直接添加到灌洗样本中,在4 ℃下可保留12 h。标本不能冻存[2]。
2、第1管回吸收液不建议做常规细胞学分析。
八、BALF的微生物检验
(一)显微镜检查
1、革兰染色:
用于分辨革兰阳性和阴性细菌,阳性菌染色为蓝紫色,阴性细菌染色为红色。同时观察白细胞情况,如果见到吞噬菌现象,须报告吞噬细菌的种类及吞噬细菌的中性粒细胞占或全部中性粒细胞的比例。
2、抗酸染色和弱抗酸染色:
用于检测分枝杆菌,弱抗酸染色主要用于检测奴卡菌。两者染色均为红色,背景及非抗酸菌染为蓝色。
3、荧光染色:
利用荧光染料及荧光标记抗体特异性结合不同种类病原体的特性来检测病原微生物,如真菌、军团菌、肺孢子菌及呼吸道感染病毒,特异度强、敏感度高。
4、瑞氏染色:
细菌染成蓝色,组织细胞的细胞质呈红色,细胞核呈蓝色,嗜酸颗粒染成橘红色。
5、六胺银染色:
常用于肺孢子菌的检测,也可用于隐球菌,念珠菌和丝状真菌的检测。真菌孢子和菌丝被染成黑褐色。
6、墨汁染色:
主要用于隐球菌的检测。低倍镜下观察,黑色背景中可见隐球菌宽厚透亮的荚膜。
7、异染颗粒染色:
用于白喉棒状杆菌染色,异染颗粒可明显地被显示出来。
8、芽孢染色石碳酸复红染色:
芽孢呈红色,菌体呈蓝色。
(二)培养
1、一般培养:
涡旋震荡BALF标本1 min,BALF标本(1 500~1 800)×g离心15~20 min。细菌培养接种于血平板及麦康凯(或中国蓝)平板,置普通培养箱35~37 ℃培养,巧克力平板,置于5% CO2培养箱35~37 ℃培养。真菌培养接种于沙保弱培养基(或显色培养基)于25 ℃培养。普通细菌培养至少2 d,念珠菌培养5 d,对于慢生长细菌及双相真菌或部分丝状真菌需适当延长培养时间。
2、结核分枝杆菌培养:
灌洗液3 000 g离心15 min,灌洗液离心后取适量沉渣,加入溴化麝香草酚蓝指示剂(bromthymol blue indicator,BTB)1~2滴,用2%~4%氢氧化钠中和,接种于改良罗氏培养基,或BD公司结核分枝杆菌液体培养基。置于35~37 ℃培养,第1周观察2次,以后每周1次,直至6周,方可出阴性报告。阳性者观察菌落出现时间与形态,并进一步鉴定。
3、军团菌培养:
灌洗液离心,经加热或酸处理后,接种于缓冲炭酵母提取物琼脂基础(buffered charcoal yeast extract agar,BCYE)培养基、血平板和巧克力平板,置于5% CO2孵箱培养。若BCYE培养基24 h内有细菌生长,此菌不是军团菌,若48 h后生长,而血平板和巧克力平板不生长,此菌可能是军团菌,应进一步鉴定。
(三)核酸检测及抗原检测
1、核酸检测(包括全基因组测序等方法):可用于几乎所有病原菌的检测。
2、抗原检测半乳甘露聚糖试验(GM试验)主要用于曲霉的检测[66]。军团菌、肺炎链球菌、新型隐球菌、肺孢子菌、病毒、寄生虫等多种致病因子均可使用特异抗原检测方法[61,67,68,69,70]。
九、BALF的核酸检测
(一)宏基因组下一代测序技术(metagenomics next-generation sequencing,mNGS)
1、基本要求:
根据患者的临床特征,在样本送检时医生需选择出相应的测序模式(表1)。为保证检测的准确性及时效性,临床医生应尽量将样本送往通量高、运行快速、测序准确性高的测序平台。ICU送检的每个测试的有效测序数据量要求:建议不低于10 mol/L检出序列数(reads),检出序列数越大,敏感度可能越高。

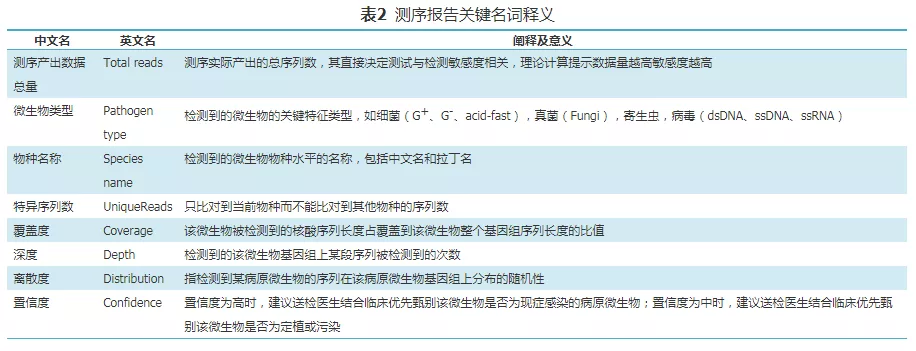
2、测序报告临床解读:
(1)报告数据的基本解读:测序报告中需含有表2中所列的8个主要关键数据,在解读报告时,临床医生需了解报告中这8个关键名词含义并充分掌握这些概念,除了上述8个主要关键数据,推荐在测序报告中列出检出病原微生物的种属情况。在检测平台的背景数据库扣除背景菌、定植菌、污染菌后,某一/某些病原体的检出序列数占测序实际产出序列总数的比例越高,且病原体的测序深度、覆盖度、离散度越大,则该病原体被检出的可信度越高,最后还要结合临床特征综合判断[75,76,77]。
(2)对于报告中所列病原体的临床考虑,临床医生需合理的参照以下原则对测序报告进行临床判读:①如果检测报告中所示的检出序列数较高、基因组覆盖度高的某一(或某些)微生物是呼吸系统社区感染的常见病原体或者其他不常见的致病病原体,则应优先考虑这类病原体为致病病原。②如果检测报告中所示的检出序列数较高、基因组覆盖度高的某一(或某些)微生物是呼吸科ICU常见的条件致病病原体或者是呼吸道常见的定植菌(需要医生通过临床病原数据的积累进行判断),则应先不考虑此类病原体为致病病原。③如果检测报告中所示的病原体特异序列数较低,但属于罕见病原体(如诺卡菌)或者胞内菌(如结核)等类型的病原体时,也应考虑其为致病病原,可结合临床症状来进行判读。④如果医生高度怀疑的病原体未在检测报告中显示时,医生可要求对测序平台的原始数据库进行重新分析和溯源查询,所以要求测序平台对临床样本检测的原始数据及信息分析数据的保存时间不少于2个月。
(二)其他核酸检测
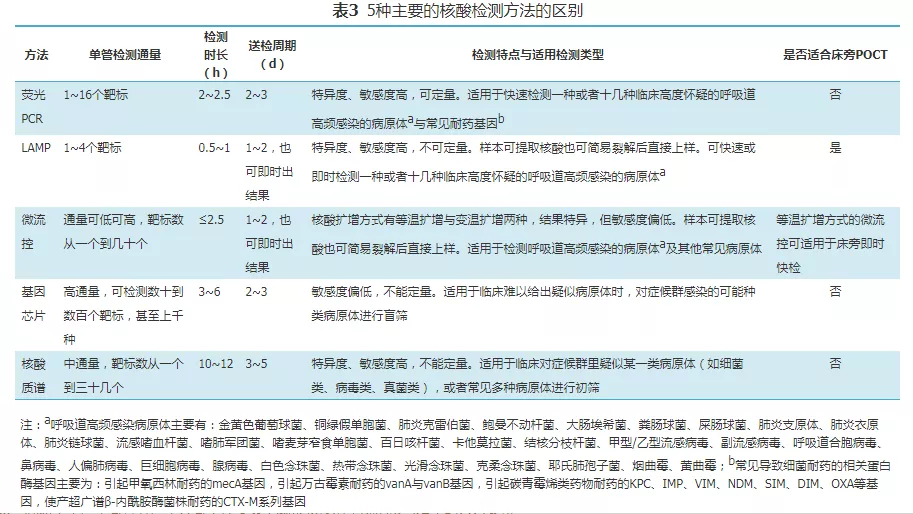
现行主要的核酸检测方法有5种:实时荧光定量聚合酶链式反应(荧光定量PCR)、环介导等温扩增(LAMP)、微流控技术、基因芯片、核酸质谱(PCR-Massarray)。医生可基于临床诊断,并依据上述5种主要方法在临床应用上的区别(表3),选择合适的核酸检测方法,对BALF样本进行呼吸道病原体的核酸检测。
作者:中华医学会呼吸病学分会呼吸危重症医学学组 中国医师协会呼吸医师分会危重症医学工作委员会;通信作者:解立新 Email:xielx301@126.com,詹庆元 Email:zhanqy0915@163.com
专家组成员(按姓氏笔画排序):王导新、孙兵、孙武装、孙耕耘、李丹、李国强、李爱民、李琦、李燕明、刘嘉琳、沈定霞、张波、罗红、周庆涛、柏长青、赵洪文、郭强、徐思成、崔俊昌、崔恩海、阎锡新、韩志海、谢菲、解立新、詹庆元、潘频华、磨国鑫
执笔人(按姓氏笔画排序):马秀清、王凯飞、王华贵、王江、王军、付晗、刘利成、肖坤、谷红俊、苏宪玲、陈杰、陈俊峰、陈荣、杨庆云、赵瑛、夏涵、段智梅、徐建桥、谢社玲
志谢:感谢中华医学会检验医学分会主任委员王成彬教授对本规范撰写给予的大力支持
* 参考文献(略)
文章来源:中华结核和呼吸杂志2020,43(9):744-756
(DOI:10.3760/cma.j.cn112147-20200506-00566)


