今天我与大家分享的内容是《从COVID-19再看感染中的免疫失衡》,在2016年发布的Sepsis 3.0中,Sepsis有了新的定义和诊断标准,大家对其诊断效果存在诸多质疑,但我个人认为Sepsis3.0中的非常大的一点改变是「我们对Sepsis的认识」,它认为「免疫失衡」是Sepsis的核心,我觉得这是非常重要的、理念性的改变。
我们不能单纯从「病原微生物」来看待感染。COVID-19是今年最重要的一件公共卫生事件。作为病毒感染,它与细菌感染在免疫方面的影响有所差异,但也存在一定共性,今天就和大家简单地分享我们目前对COVID-19免疫过程的一些了解。
一、「与感染性疾病斗争」贯穿了人类生存史的全过程
影响人类进程非常重要的三大问题:一是战争,二是饥荒,第三就是感染性疾病,我们曾称为瘟疫。经过了百万年的人类发展,这三个问题都没有得到彻底的解决。随着抗菌药物、抗病毒药物的研发和相关技术进步,人们一度认为自己在感染性疾病中已经取得了非常重要的胜利,但COVID-19的出现对人类敲响了警钟——具有传染性的感染性疾病不仅对医学、公共卫生造成了影响,还对我们的社会、政治、经济造成全方位的影响,乃至影响人类的进程和世界的格局。

其实,这种新发的、突发的呼吸道传染性疾病一直在给我们敲警钟。同是冠状病毒的SARS、MERS;还有流感病毒这一类,H5N1,H1N1,H7N9禽流感等等,我们真的要加强认识。我们发现COVID-19只有9个多月,但是它已经席卷全球,目前全球感染人数超过了3000万,死亡的人数达到80万,单病原的感染性疾病的死亡达到了80万,预计在今年年底会引起百万以上人的死亡。
二、感染中的免疫反应是一把双刃剑
为什么这么讲?人体的免疫系统发现外来入侵的病原,首先要和这个病原做斗争,就会触发免疫反应来杀灭病毒,保护我们的人体;同时,免疫反应也会造成免疫损伤,所以它本身是一把双刃剑。
1、COVID-19的治疗策略
第8版新冠肺炎诊疗指南在不久前颁布,在治疗策略部分,大家都比较熟悉一般治疗及脏器支持和抗病毒治疗,而其余的治疗——恢复者血浆、免疫球蛋白、白介素-6受体的拮抗剂如托珠单抗,还有糖皮质激素,它们针对的都不是病毒本身,其本质是针对免疫炎症反应的治疗。那么,免疫反应在感染中扮演怎样的角色?免疫失衡的概念又是什么?
2、脓毒症概念和诊断标准的演变

先简单的回顾一下。刚才已经提到Sepsis3.0了,为什么说Sepsis3.0是一个理念性的改变呢?我们在最初认识sepsis的时候,认为它是一个炎症反应综合征(SIRS)。在这个过程中逐渐发现在炎症反应过程中,除了免疫增强,还有免疫抑制的问题,是总体稳态的失衡。
所以在2016年,Sepsis3.0就把Sepsis定义为「继发于宿主对感染的反应失调而产生危及生命的器官功能障碍」,用一个序贯的脏器功能评分,也就是SOFA评分来诊断它,这是一个理念性的更新。
3、免疫失衡概念的提出——Sepsis3.0: 免疫失衡
其实在100多年前,加拿大的内科医生奥斯勒就提到了大部分死于感染的病人,都是死于宿主对感染的反应,而并非感染本身。他深邃的洞察力为感染的免疫反应开启了新的一页,具有里程碑意义。

这是Sepsis3.0关于sepsis的定义,并提出了免疫失衡的概念。该定义提出sepsis是「宿主对感染的反应失调而导致的危及生命的器官功能障碍」,强调脓毒症不仅是炎症反应(SIRS),而是免疫稳态的失衡。而对临床治疗来说,其实是用尽一切办法恢复免疫稳态。
4、脓毒症中的几个重要概念
1)SIRS(systemic inflammatory response syndrome,SIRS):1985年,Goris和Bone等提出了SIRS概念,脓毒症是失控的、持久的,并由感染因素诱发的SIRS,过度炎症反应导致了远隔器官的损害和患者死亡。
2)CARS(Compensatory anti-inflammatory response syndrome,CARS): 1996年,Bone提出,脓毒症免疫反应的存在不一致性,促炎抗炎同时存在。
-机体并非处于一成不变的过度炎症反应状态,特别是病程后期存在显著的免疫抑制。
-脓毒症患者病程后期,CRP、IL-1β等促炎介质持续表达,但IL-10等抑炎介质表达亦升高,T 淋巴细胞、树突状细胞凋亡增加,人白细胞DR抗原(human leukocyte antigen DR,HLA-DR)和共刺激分子的表达下降。
-CARS的诊断标准是单核细胞HLA-DR表达率<30%。
3)PICS(Persistent InflammationImmunosuppression Catabolism Syndrome):2012年提出,免疫抑制是脓毒症患者死亡的主要原因。
-这部分患者具有MODS、住院时间长、反复发生院内感染、同时这一部分患者往往表现以肌肉为主的蛋白丢失为主的严重营养不良和虚弱,临床上曾经以「免疫麻痹」、「ICU获得性肌无力」、「慢性危重症」等来描述这些临床症候群。
-系统概括了这些经历早期复苏和器官功能支持后存活患者的系列临床症候群:持续的炎症反应和免疫抑制,以肌肉分解为特征的营养不良和肌无力。
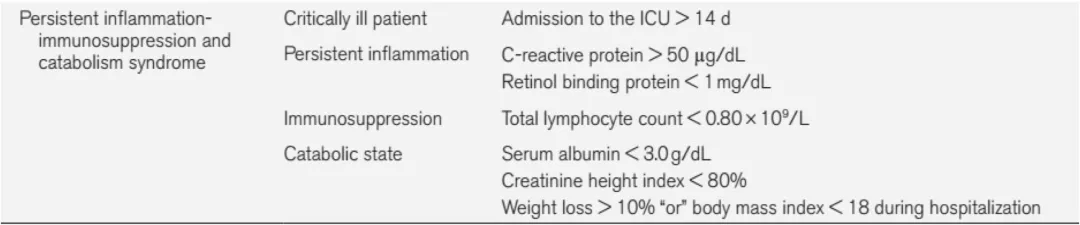
5、免疫失衡——脓毒症的关键所在
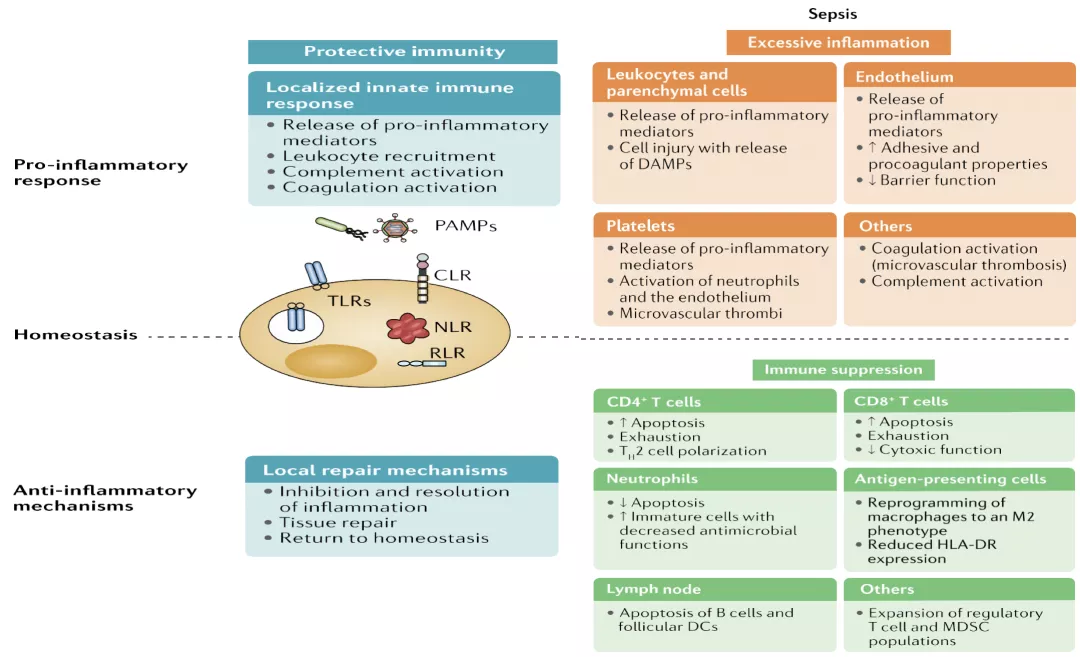
上图中横轴是免疫稳态,一直存在促炎、抑炎的过程。保护性免疫包括炎症因子的释放、补体的激活、白细胞的募集,局部组织的修复;同时,在Sepsis的过程中,也有促炎、抑炎的过程,促炎的过程包括白细胞、组织细胞、内皮系统、血小板系统的激活,抑炎的过程中包括了CD4+T细胞、CD8+T细胞、中性粒细胞、抗原递呈细胞等,以功能减退、丧失和凋亡为主的抑制性表现。
6、免疫失衡的特点:免疫抑制、免疫麻痹、免疫衰老
提到免疫抑制,很多死亡的患者都是因为免疫抑制(或免疫瘫痪)状态,这里又有几个比较重要的概念。
免疫抑制(Immunosuppression):
mHLA-DR表达量降低
IL-10、IL-6比值持续升高
外周血淋巴细胞计数持续减少
CD4+/CD8+T细胞水平降低
免疫麻痹(Immunoparalysis )是免疫抑制状态的加深:
单核细胞表明HLA-DR阳性率<30%
产生促炎因子的能力下降:全血500pg/ml内毒素刺激后产生的TNFα<200-300pgml
CD4+/CD8+ T细胞<1.7
另外提一个概念:免疫衰老(Immunosenescence):

COVID-19重型和危重型的高危人群就包括老年人或有基础疾病的人,老年人的免疫状态和年轻人不同,他们本身就存在增龄相关的免疫衰老,在这种情况下再受到外界的打击,受到的免疫抑制情况就会更为严重。
三、COVID-19感染中的免疫失衡
1、冠状病毒引起的宿主免疫反应
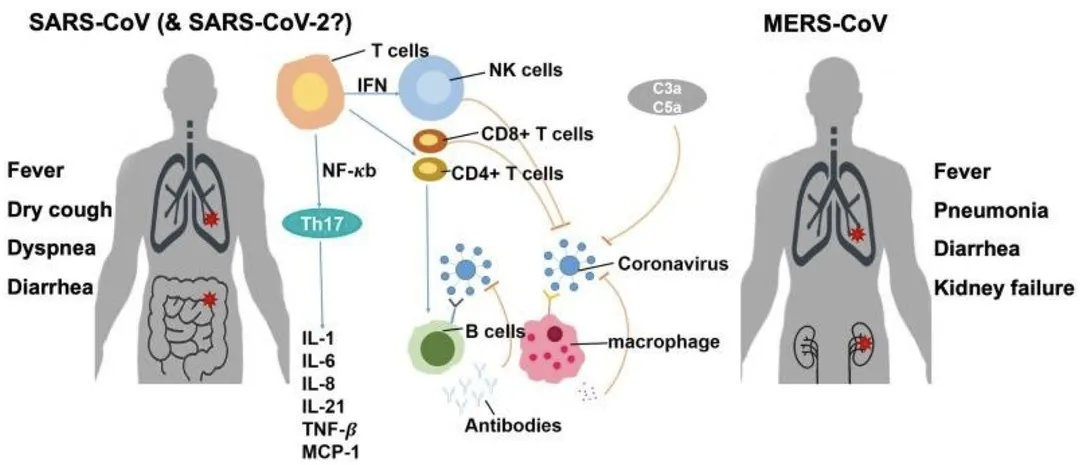
冠状病毒入侵后激活固有免疫反应和适应性免疫反应;免疫反应是为了抵御、清除病毒,但过度的免疫反应可引起脏器功能损伤,甚至宿主死亡。T淋巴细胞在机体对抗病毒的适应性免疫反应中起到重要的作用;但冠状病毒可抑制T淋巴细胞功能。
2、SARS-CoV-2感染引起的髓系免疫细胞激活
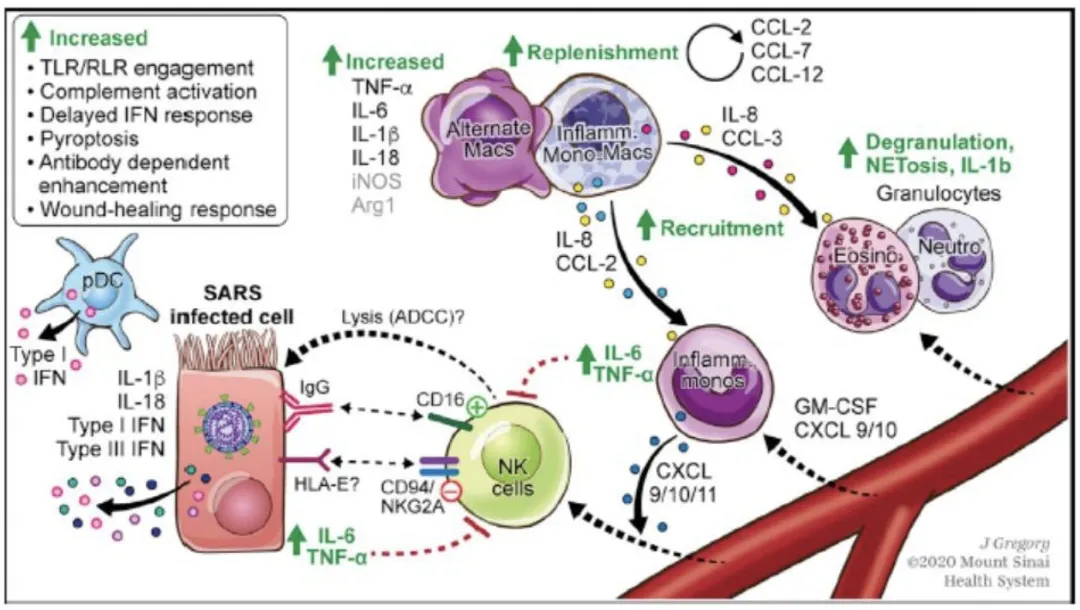
SARS-CoV-2感染肺上皮细胞后释放炎症因子(如IL-6, IL-1b, and IFN等),可继续趋化循环中的炎症细胞(包括单核巨噬细胞、粒细胞、淋巴细胞等),放大炎症反应瀑布,引起免疫失衡,进一步加重病情。
3、SARS-CoV-2感染引起T淋巴细胞耗竭,功能异常
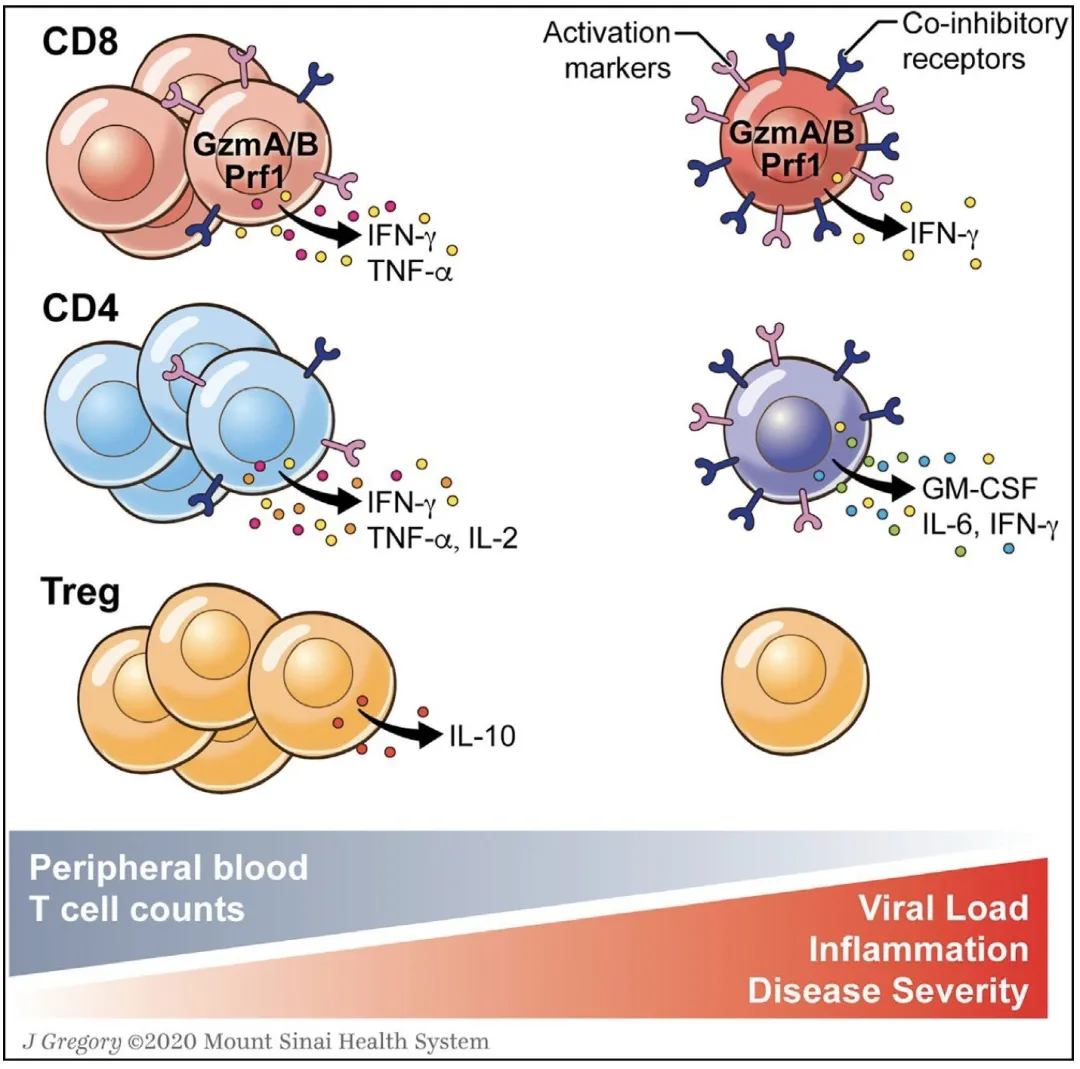
T淋巴细胞在病毒感染时发挥重要作用。许多研究发现在中重度COVID-19病例中存在低淋巴细胞血症,尤其是CD8+ T细胞降低程度似乎和疾病严重度和病死率相关,随着病毒载量、炎症反应和疾病严重度增加,T淋巴细胞的数量和功能表型均会发生变化,持续性COVID-19患者中T淋巴细胞趋向于耗竭的表型,表现为抑制标志物表达上调及T淋巴细胞的多功能性和细胞毒性降低。
在严重疾病中,也已经报道了CD4 T细胞产生特定的炎症细胞因子。在未来研究中,我们需要评估外周血和组织中病毒特异性T细胞的反应。另外,需要更大和更明确的具有纵向数据的患者队列来定义疾病严重程度与T细胞表型之间的关系。

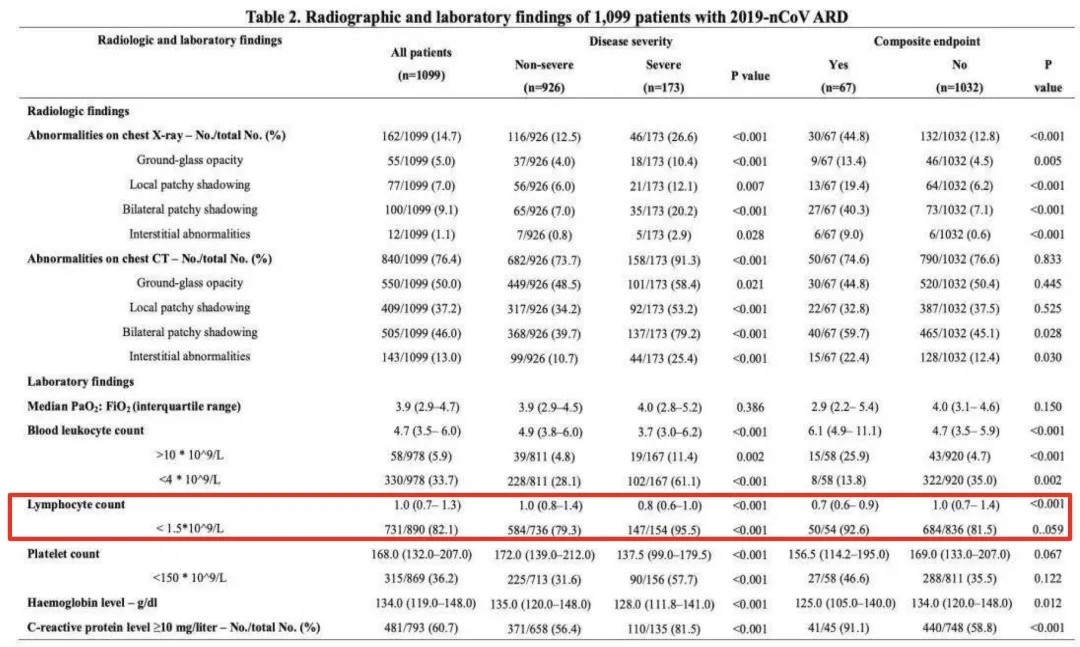
这是钟南山院士团队的一篇文章,收集了中国30个省份522家医院中共1099例确诊COVID-19病例,结果提示大部分患者在就诊时外周血淋巴细胞降低(83.2%),CRP升高(60.7%);且在病情危重的患者中指标异常更加明显。
4、COVID-19的血液指标和免疫学标志物变化
这是在2020年6月的时发表的一篇文章,文章回顾性分析了中国584例COVID-19患者资料,探索免疫学标志物与疾病严重度和预后的关系。
结果:COVID-19患者淋巴细胞、嗜酸性粒细胞、血小板明显下降,中性粒细胞、IL-6、PCT、CRP、D二聚体等明显上升;免疫指标的异常变化趋势在重症患者中更加明显,且与预后相关。
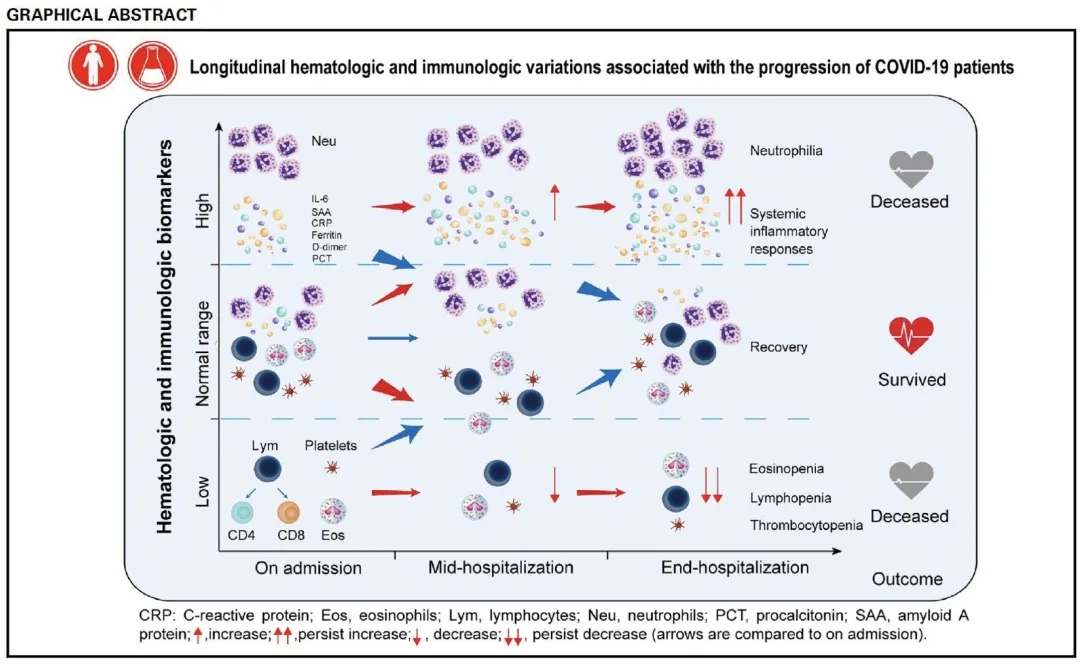
中间的这一带是免疫正常的状态,上面一带以促炎因素为主,下面一带以抑炎状态为主(入院时以免疫抑制为主)。从最终结果来看,无论是哪种状态,如果最终能回归稳态,这部分的患者更容易存活下来。反之,「火烧得太大」和「火已经熄灭」都提示患者预后不佳。
三、有的放矢——免疫治疗在COVID-19诊治中的初探索
1、我们现在了解到的、与疾病严重程度和患者预后有相关的一些的免疫相关标志物:
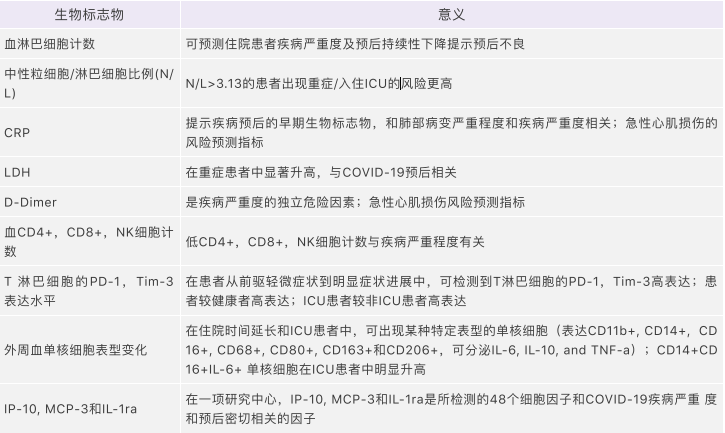

表:COVID-19的免疫学生物标志物
2、COVID-19抗病毒和免疫治疗的潜在靶点
这张幻灯显示的是COVID-19治疗的潜在靶点,A图是抗病毒,B图、C图和D图都可能是免疫治疗的潜在靶点。
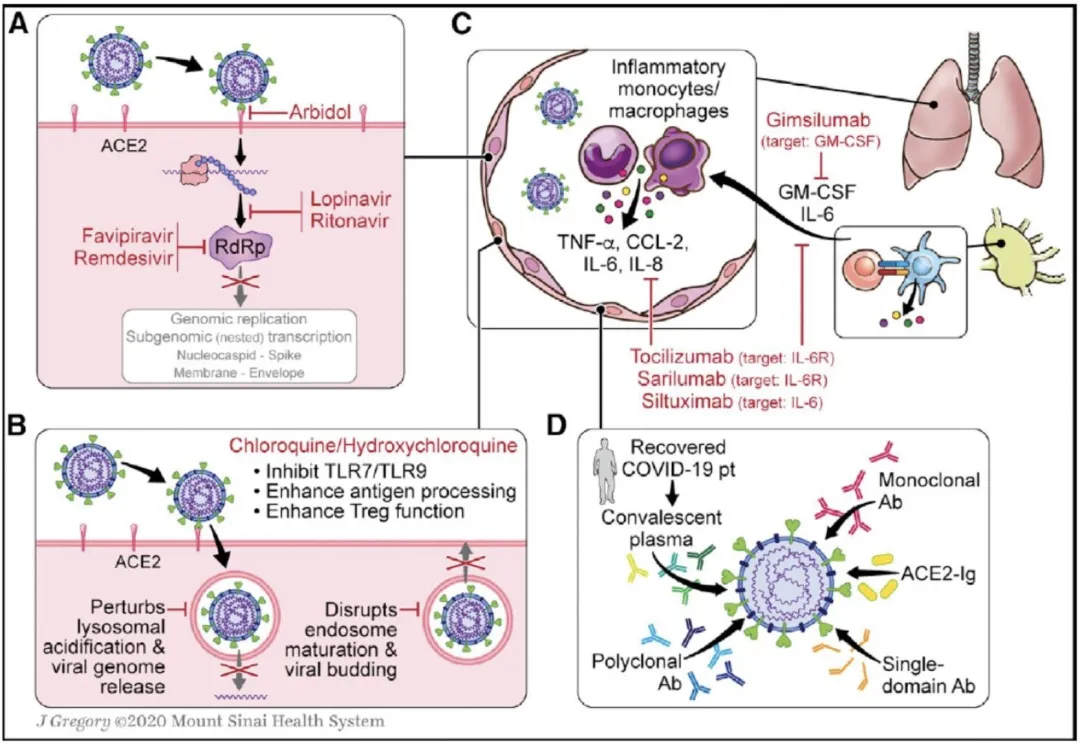
B图中是指氯喹、羟氯喹可提高抗原呈递功能、提高Treg T细胞功能,但目前在COVID-19中应用的有益证据不足。C图为针对炎症风暴中主要的细胞因子的靶向治疗(IL-6、IL-8、GM-CSF等),D图中为康复期血浆、抗体等。
3、免疫治疗在COVID-19中的应用
1)激素
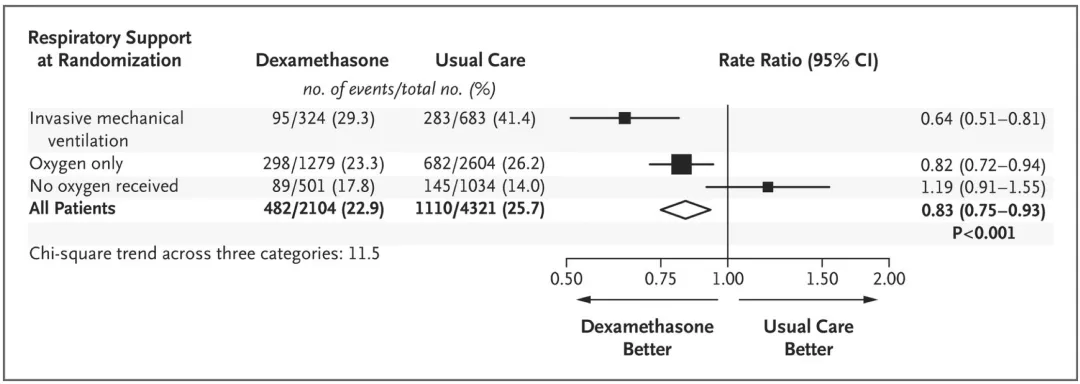
这是《新英格兰医学杂志》发的文章,是开放标签、随机对照试验:地塞米松(6mg/d x 10d, 口服或静脉)VS 常规照护。结果:共纳入地塞米松组2104例,对照组4321例;主要终点:地塞米松组28天病死率低于对照组( 22.9% VS 25.7%;年龄矫正RR 0.83; 95% CI 0.75 to 0.93; P<0.001)。
两组间差异和患者入组时的呼吸支持状态明显相关:入组时需要机械通气或氧疗的患者,地塞米松可降低28天病死率。
2)羟氯喹

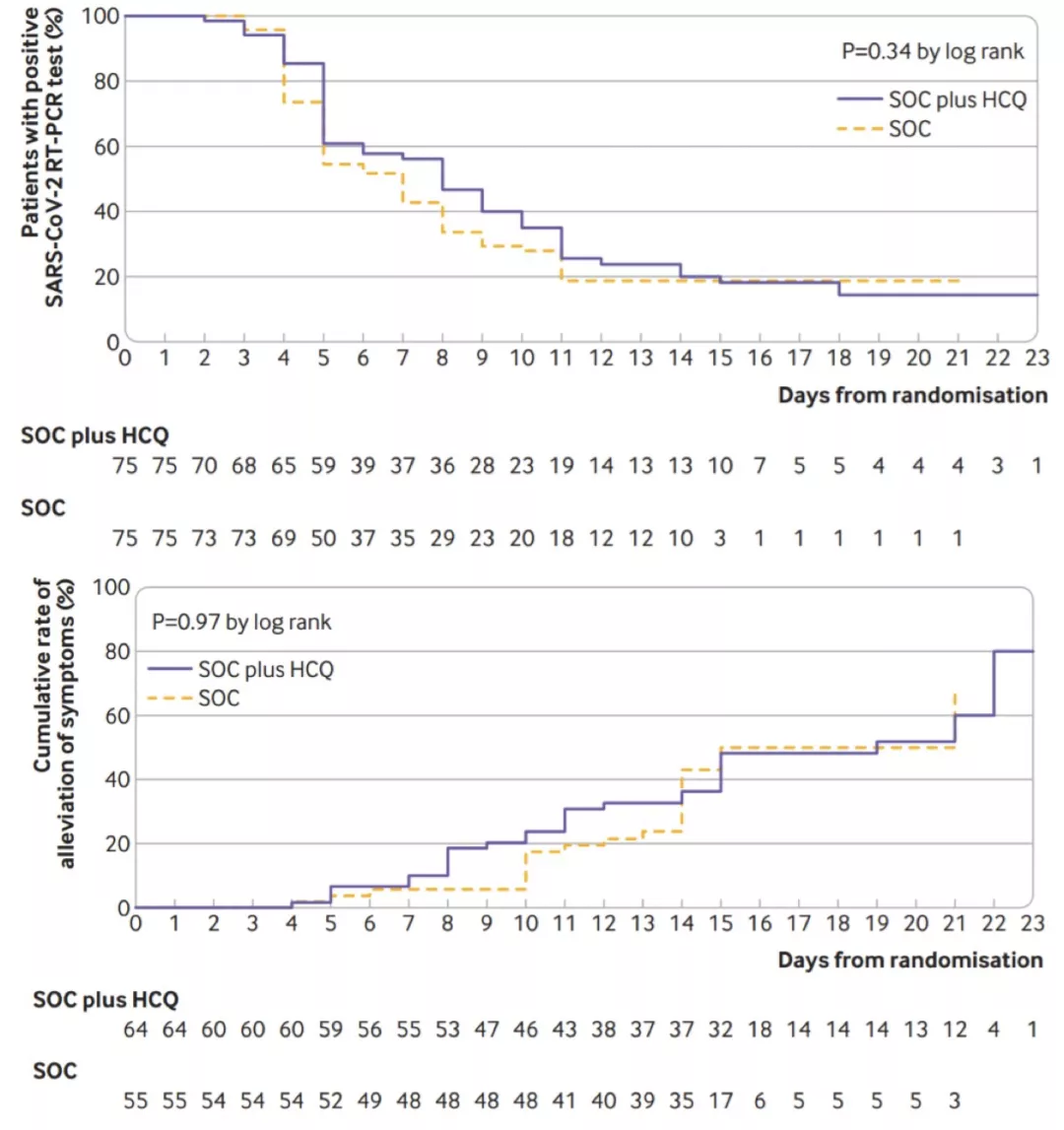
这个研究发表在BMJ,也是一个开放标签的随机对照试验,分成两组——标准照护 VS 标准照护+羟氯喹(1200mg Qd*3d,续贯800mg Qd,轻中度疗程2周,重度疗程3周),结果:共150例COVID-19患者,每组各75例,148例轻-中度,2例重度。
两组间28天核酸转阴率和主要症状缓解率无显著差异;羟氯喹组不良反应率高于标准照护组。
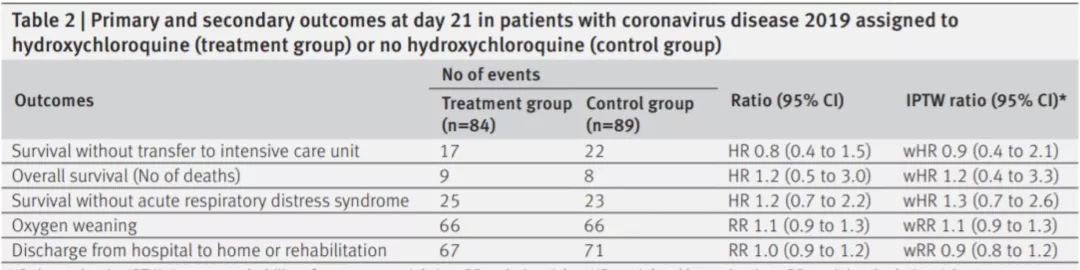
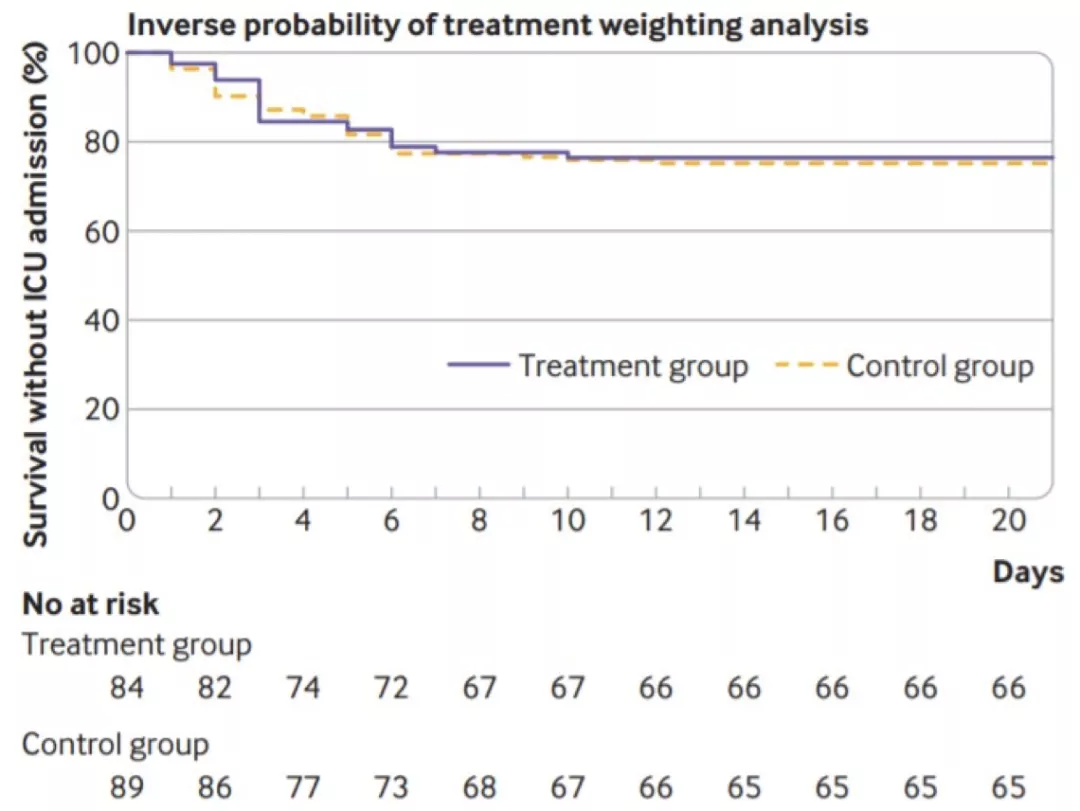
这也是关于羟氯喹的研究,是观察性对照研究:需要氧疗但不需入住ICU的COVID-19患者——标准照护 VS 标准照护+羟氯喹(入院48h内予600mg Qd),结果:共173例COVID-19患者,其中标准照护组89例,标准照护+ 羟氯喹组84组。两组间21天的生存率、氧疗降级情况、康复率无显著差异。
所以,我国的第8版指南中不推荐羟氯喹治疗COVID-19。
3)IL-6单抗
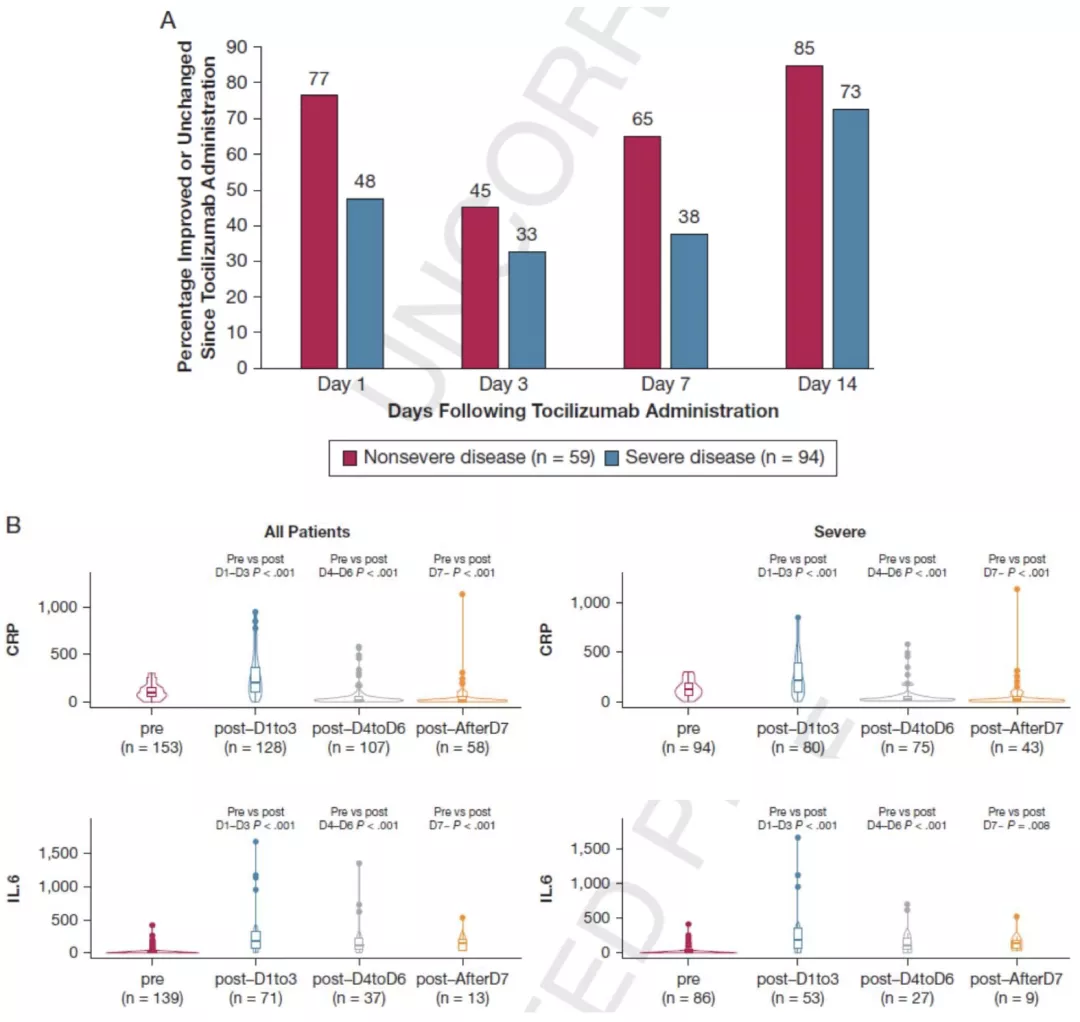
一项观察性研究:纳入COVID-19重症患者:需要吸氧≥3Lmin以维持SpO2 93%;需要机械通气;Tocilizumab(TCZ) 8 mg/kg iv. 总量不超过800 mg。
结果:239例COVID-19患者应用TCZ后14天内,氧合改善或稳定的患者比例初期下降后上升,在重症病例中更加显著。部分炎症指标(如高敏CRP、IL-6)及体温也在应用TCZ 14天后有所改善。应用TCZ的生存率存在种族差异性(黑人及西班牙人种生存率高于白人)

这篇研究也很有意思,它入组的病人很少,回顾性评估了15例COVID-19患者中应用Tocilizumab(TCZ)的治疗过程。TCZ治疗可迅速改善所有患者的CRP,但对于临床结局为死亡或疾病加重的患者(1、2、3、7、15号),CRP水平下降不理想。
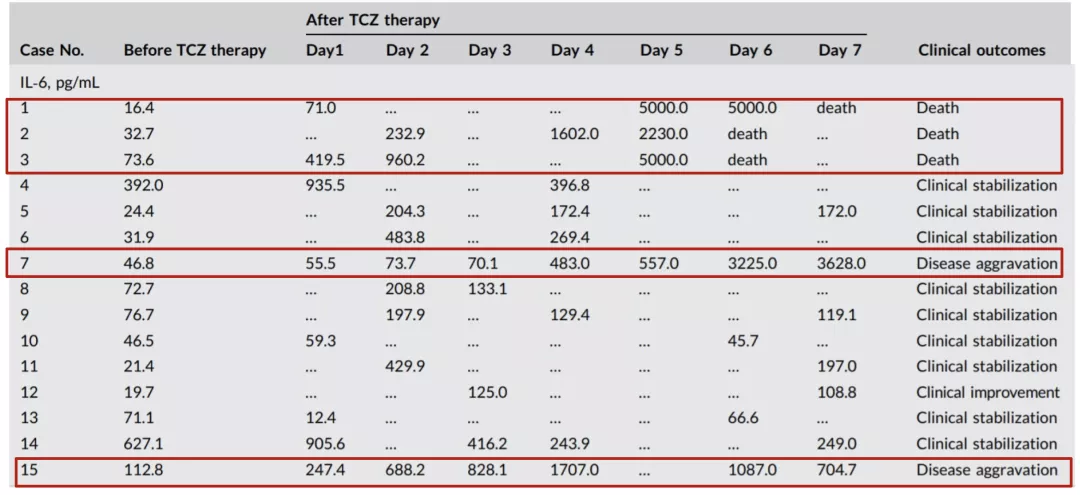
TCZ治疗后血清IL-6水平倾向于先升高后降低,但在治疗失败的患者中(1、2、3、7、15号)IL-6持续且显著增加或下降不理想,为何会有这种差异?
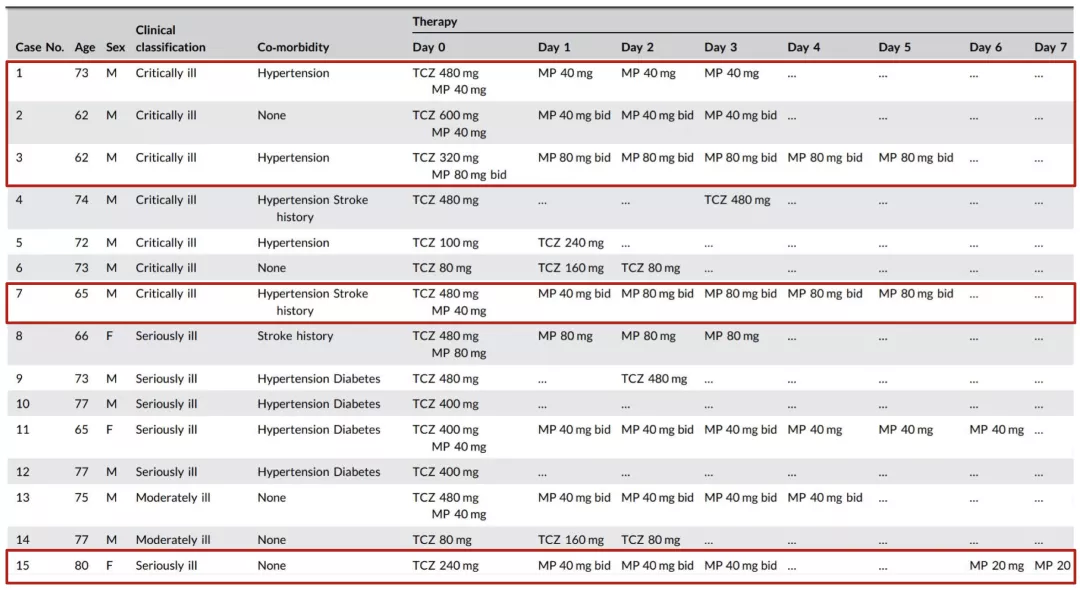
临床结局不良的患者总体而言病情较重;且在治疗过程中均仅应用1次TCZ;对于具有细胞因子风暴风险的COVID-19患者,TCZ似乎是一种有效的治疗选择。对于IL-6升高的危重患者,可考虑重复剂量的TCZ。
IL-6单抗治疗COVID-19的可能机制:
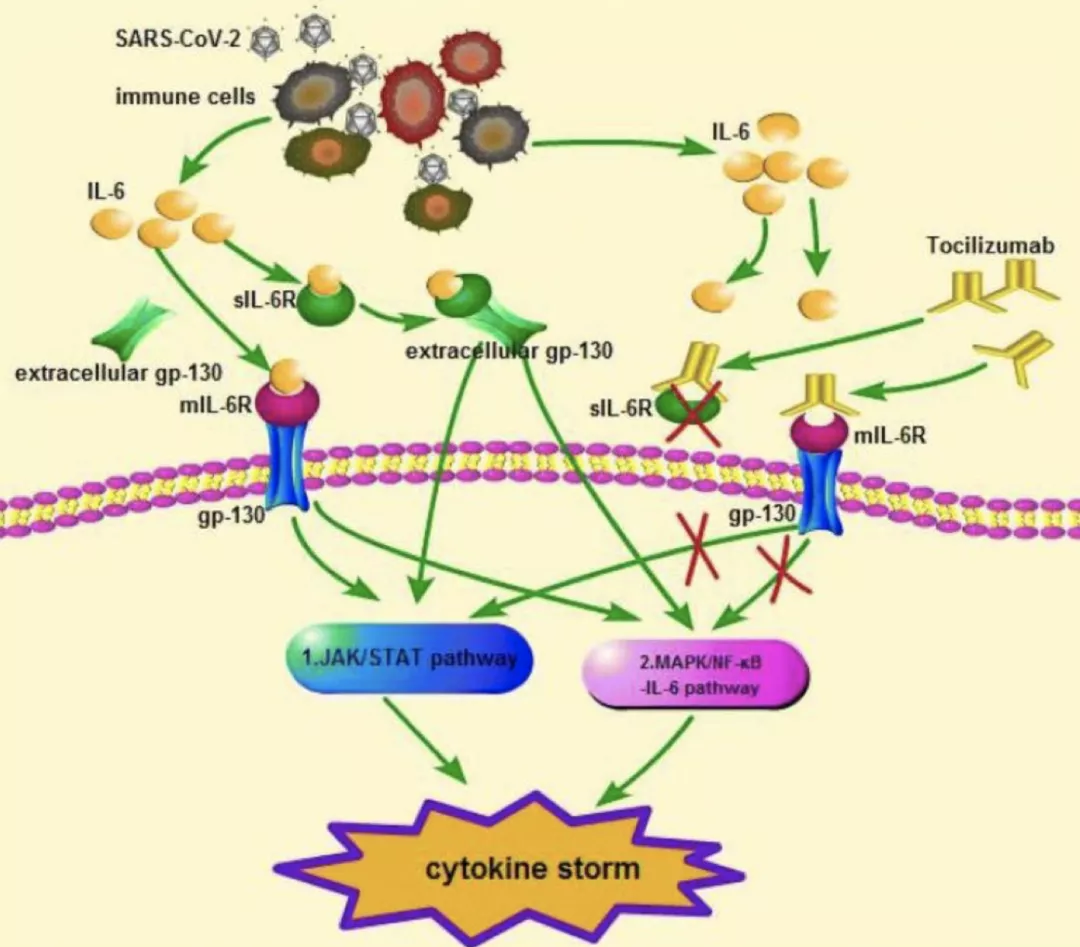
正常情况下,人体中IL-6的水平非常低,在感染时会迅速合成以增强人体的防御功能。但IL-6过表达也会诱发细胞因子风暴,引起组织损伤;IL-6与其受体IL-6R结合形成复合物,进而与信号转导糖蛋白130(gp-130)结合,触发下游信号转导和基因表达,包括JAK-STAT通路(经典通路)和Ras/MAPK/NF-κB信号通路。
许多研究观察到COVID-19患者血IL-6表达明显升高,且和疾病严重度及不良预后相关。人源化抗IL-6R单克隆抗体Tocilizumab可以与mIL-6R和 sIL-6R结合,抑制经典信号和反信号。这可能是其在COVID-19中治疗细胞因子风暴的潜在机制。
但其确切机制及疗效尚未明确,目前已有许多临床试验评估IL-6/IL-6R阻断治疗对COVID-19的临床疗效。
4)GM-CSF单抗
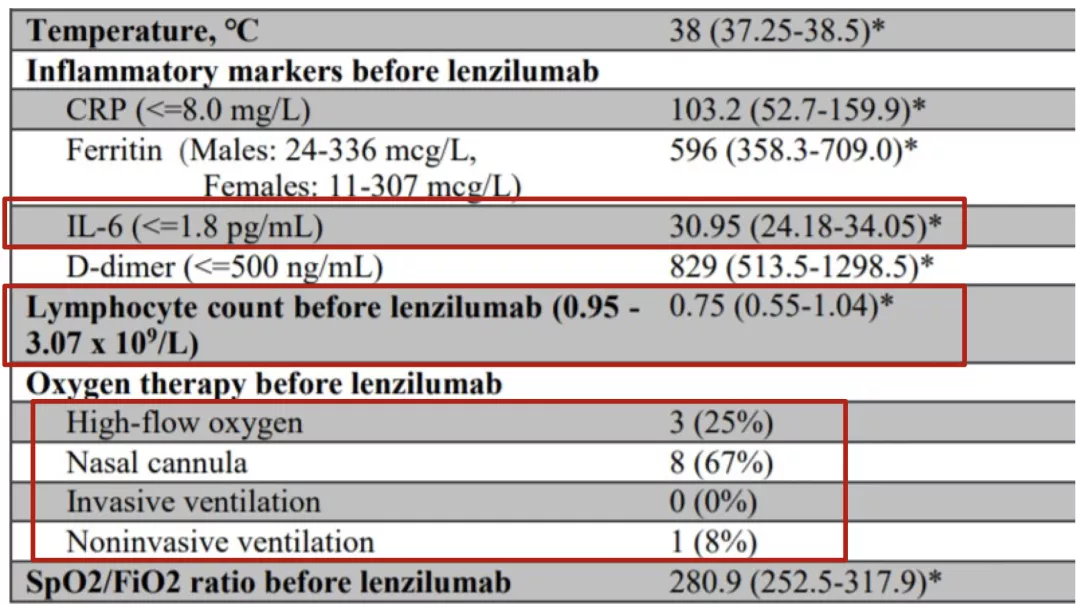
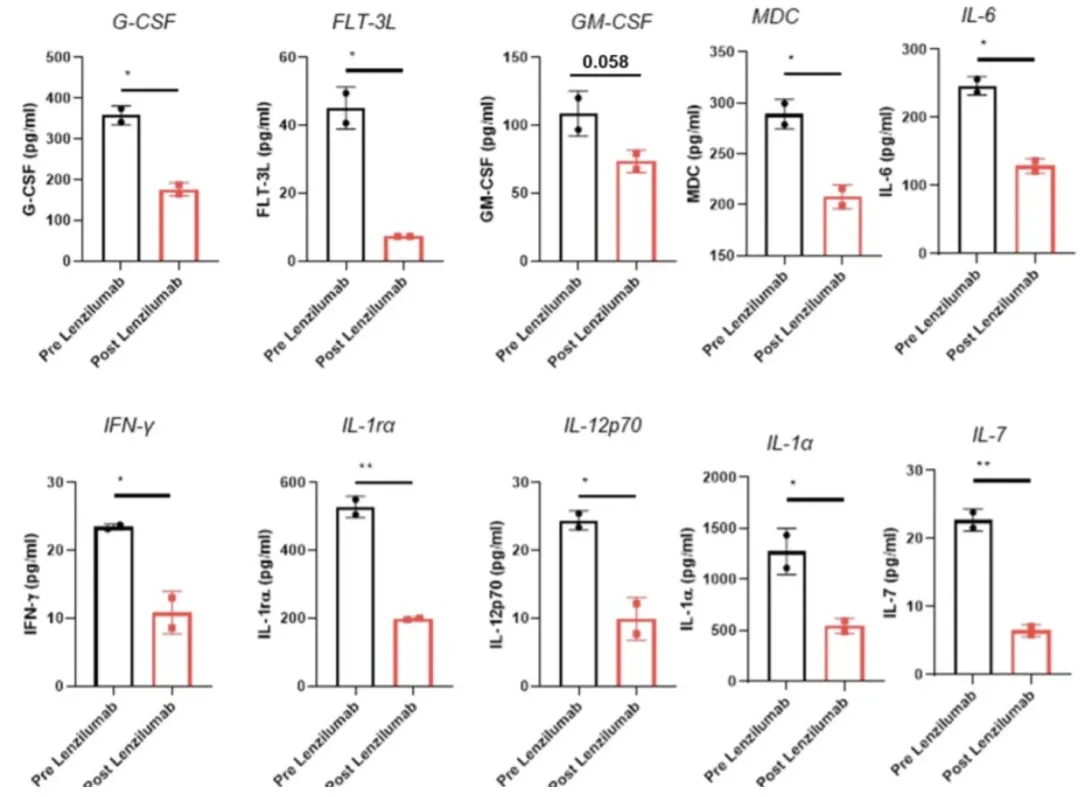
再给大家举一个例子,这项研究纳入12例因COVID-19肺炎住院,合并不良预后危险因素的患者;所有患者纳入时均需要不同程度的氧疗支持;有免疫失衡、过度炎症反应的表现。予GM-CSF单抗lenzilumab 600 mg Q8h *3次(总计1800mg)静脉输注,结果提示GM-CSF单抗lenzilumab 可改善重症COVID-19肺炎患者的炎症风暴。
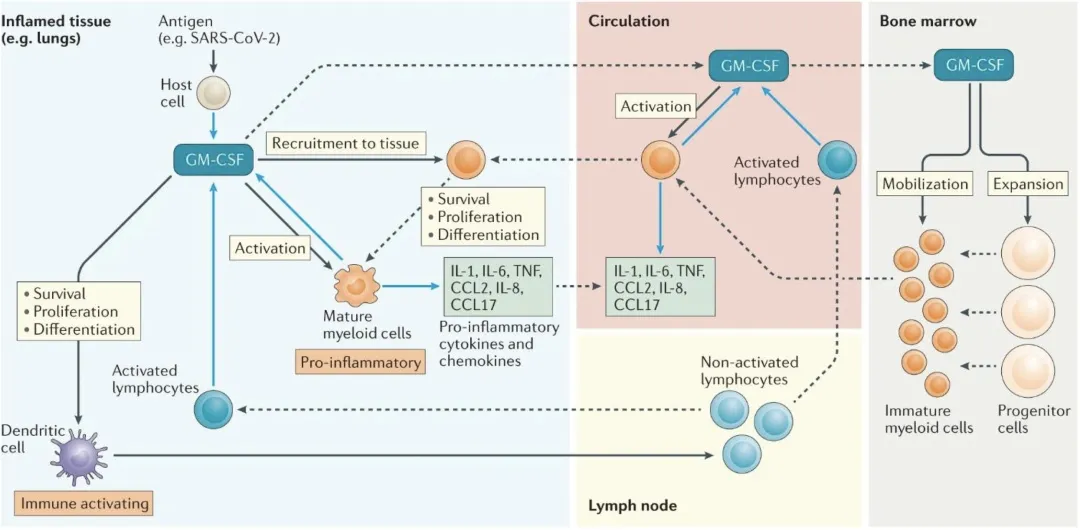
但GM-CSF在机体对抗病原的过程中的远比我们想象的复杂,在不同阶段、不同状态下的作用不同。也许有时是保护作用,但有的时候是免疫损伤作用,所以在使用过程中进行评估是非常重要的。
5)康复期血浆

这项荟萃分析纳入了5篇研究,其中4项研究来自中国研究,1项来自韩国。
结果:恢复期血浆可以降低危重患者病死率;在接受恢复期血浆治疗后,几乎所有患者中均观察到中和抗体滴度增加及病毒核酸转阴;恢复期血浆可改善临床症状;恢复期血浆安全性较好;但目前仍缺乏设计良好的大型多中心临床试验研究以验证恢复期血浆COVID-19患者的疗效。
总结与思考
人体与病原体的斗争必将持续存在于人类的进化进程中,对于新发传染病给人类所带来的挑战必须时刻保持警惕。
感染给人体带来的损伤不仅来自于病原体的直接攻击,其核心是人体免疫功能失衡、炎症风暴所引起的脏器功能损伤和免疫抑制,同样需要引起临床更大的重视。经过近10年对脓毒症免疫状态的研究,目前对脓毒症机体免疫功能紊乱的确切发生机制有一定认识,但仍未明确其发生发展的关键点,仍缺乏能广泛应用于临床、指导治疗的脓毒症免疫功能评价系统;单一免疫标志物难以完全反应脓毒症患者免疫抑制状态的全貌,需要联合临床动态监测。恢复免疫稳态、调节免疫失衡是未来治疗脓毒症的重要方向。
参考文献
[1] 国家卫生健康委. "新型冠状病毒感染的肺炎诊疗方案"(试行第八版)
[2] Gentile LF,et al.J Trauma Acute Care Surg.2012 Jun:72(6):1491-501
[3] Bone RC.Ann Intern Med.1991,115:457-469
[4] Bone RC.Crit Care Med,1996,24:1125-1126
[5] Bone RC,et al.Chest,1997, 112:235-243
[6] Nat Rev Immunol 2017 Jul;17 (7):407-420
[7] Crit Care, 2013, 17(5): R223
[8] Crit Care, 2011, 15(5): R220
[9] 危重症免疫功能监测研究进展. 2019
[10] Intensive care med(2010)36: 1810-1812
[11] Intensive Care Med, 2011, 37(3): 525-532
[12] An Acad Bras Cienc (2017) 89 (1)
[13] Int J Biol Sci. 2020; 16(10): 1753–1766
[14] Immunity 52, June 16, 2020
[15] February 28,2020, NEJM.
[16] Lancet. 2020 Aug 1;396(10247):320-332.
[17] Lancet Respir Med. 2020 Apr;8(4):420-422
[18] J Allergy Clin Immunol. 2020 Jul;146(1):89-100
[19] N Engl J Med. 2020 Jul 17
[20] BMJ. 2020 May 14;369:m1844.
[21] Chest. 2020 Jun 15
[22] Clin Drug Investig. 2020 Apr
[23] medRxiv. 2020 Jun 14
[24] Nat Rev Immunol. 2020 Aug;20(8):507-514.
[25] J Med Virol. 2020 May 1
专家介绍

李燕明
北京医院呼吸与危重症医学科副主任主持工作,感染科主任;主要研究领域:呼吸系感染,呼吸危重症;牵头承担国家传染病重大专项课题、国自然面上项目;作为分中心负责人参与卫计委行业专项、国家科技支撑计划等多项研究。中华医学会呼吸病学分会危重症学组委员;中国康复协会呼吸病学分会副主任委员,青年委员会主任委员;北京医学会呼吸病学分会常委、危重症学组成员;国家呼吸专科质量控制中心副主任;中华预防医学会呼吸病预防与控制专业委员会委员;中国装备委员会呼吸装备分会常务委员;Allergy中文版主编。
本文由《呼吸界》编辑 Jerry 整理、排版,感谢李燕明教授的审阅修改!


