
从中国慢阻肺病的流行病学可见,慢阻肺病的防控不容乐观,医生时常觉得“病人越看越多”,主要原因是对于慢阻肺的诊疗一直在进步,医生和患者对于慢阻肺的了解进一步加深,国家也在大力关注和推进慢阻肺疾病的诊疗和防治,但对于慢阻肺疾病的规范化诊疗还存在一定问题,面临多种挑战:如何更早的发现患者,如何对于患者进行更好的评估,制定合适的治疗方案,如何科学管理患者还需要全体呼吸科医生共同努力。今天与大家分享在过去一年中慢阻肺领域相关研究的进展,主要围绕以下三个方面:一、病因及患病前阶段探索,二、诊断与评估进展,三、慢阻肺治疗方案进展。
一、慢阻肺病病因及患病前阶段探索
肺功能演变轨迹
肺功能是慢阻肺患者最重要的指标之一,观察患者肺功能的演变轨迹需要建立长期队列,GOLD 2024中描绘了生命进程中的FEV1轨迹,对1946年出生的人群开始随访,随访70年后描绘出肺功能的发展轨迹,从轨迹中能看到两种类型,一种是儿时肺部发育良好,到成年后受到吸烟、烟草烟雾、职业粉尘以及室外空气污染等危险因素的暴露,导致肺功能加速下降,最终可能会发展成为慢阻肺病;另一种是婴儿在母体子宫内接受到不良因素影响,或者早产,出生体重过低,儿时生长发育时期肺部反复感染等,这些因素都会影响肺部发育,之后也无法追赶正常的肺发育速度,提早到达肺功能顶峰,而后肺功能开始下降,可能会出现气流受限,最终发展成为慢阻肺病,因此呼吸科医生需要与儿科、妇产科“联动”,从母亲怀孕时就开始追踪并随访,尽可能的对于个人的生长发育保持密切关注,从而预判未来肺功能发展的走向。
另外一项研究则调查了从出生到60岁的FEV 1 /FVC和FVC及其组合的不同演变轨迹,确定了4种终生肺功能演变的表型及其占比,包括阻塞型(25.8%)、限制型(10.5%)、混合型(3.5%)以及参照组(60.2%),分组的依据为FEV1/FVC和FVC——如果FEV1/FVC降低,但FVC不低,则认为是阻塞型;如果FEV1/FVC不低,但FVC降低,则是限制型;如果FEV1/FVC和FVC均降低为混合型。随访发现,不同表型在儿童期呼吸道症状表现、成年期慢性呼吸系统疾病以及合并症患病情况存在差异,其中“混合型”的个体患慢阻肺病的风险最高,其次是阻塞型。结合以上肺功能演变的表型和成年临床结局息息相关,是否可为提早干预提供参考,后续期待更多研究证明。
慢阻肺前期的探索
从GOLD 2001到2006有一个概念为“GOLD 0级”,指存在危险因素、有或者没有临床症状,但是肺功能在吸入支气管舒张剂后的一秒率正常,还达不到持续气流受限。随着研究的持续,在GOLD 2007年之后就取消“GOLD 0 级”的说法,原因发现这部分人群后来并未全部发展为持续的气流受限。在GOLD 2022中提到了“慢阻肺前期”(pre-COPD),其概念为“出现慢性呼吸道症状伴或不伴可检测的肺部结构和(或)功能改变,但未达到慢阻肺诊断标准[吸入支气管舒张剂后FEV1/FVC<0.70],在后续随访中更易进展为慢阻肺的人群”。“慢阻肺前期”相对于GOLD 0级被赋予了更多的内涵,包含患者可能存在危险因素、临床症状,这些临床症状可能表现为慢性支气管炎、咳嗽咳痰以及活动性呼吸困难,即慢性支气管炎或者肺气肿等。
根据慢阻肺前期的特征,目前将其分为五种类型,1、非阻塞性慢性支气管炎型(NOCB);2、肺气肿型,虽然无持续气流受限,但胸部CT扫描显示已经有肺气肿、气道壁增厚;3、一秒量受损一秒率尚存(PRISm)型,即吸入支气管舒张剂后FEV1<80%预计值,且FEV1/FVC≥70%;4、一氧化碳弥散量(DLCO)下降型;5、FEV1快速下降型。
目前临床中也正在积极探索慢阻肺前期人群的识别方法,除了慢性呼吸道症状和急性呼吸道事件,还需要关注呼吸生理学、结构(通过胸部影像学改变来判断)两个维度,前者包括小气道功能障碍但无气流受限、可逆性气流受限、支气管舒张试验阳性,后者包括肺气肿、气体陷闭、气道壁增厚等。
我们近期在《柳叶刀》子刊发表了一篇文章,利用中国慢阻肺监测数据对2014年-2015年中国≥40岁无气流受限人群进行随访,通过问卷调查及肺功能检查,分析7个慢阻肺前期潜在指标与慢阻肺发生的关系,尤其关注那些患者在基线时没有发生气流受限,但在随访之后发生气流受限,希望由此能够找到提示慢阻肺前期有力指标,研究发现,PRISm、低PEF、sSAD、低MMEF、低FEF50和低FEF75者发生慢阻肺的风险显著升高,慢性支气管炎、sSAD/低MMEF的这组人群可以被定义为“慢阻肺前期”。
新术语:PRISm
2023 GOLD首次提出了“PRISm”新术语,指患者表现为吸入支气管扩张剂后FEV1/FVC ≥ 0.7,但FEV1和/或FVC< 80%预计值,这实际上是呼吸生理方面肺功能的诊断,既往可能诊断为非特异性肺功能异常,作为临床医生,需要分析出现这种肺功能表现所可能代表的疾病状态。
GOLD 2024对PRISm相关内容进行拓展,20%的PRISm患者可发展为阻塞性通气功能障碍。基线FEV1%和FEV1/FVC较低、较高年龄、正在吸烟、女性和肺功能复查中用力呼气时间加长是预测PRISm发展为慢阻肺最重要的预测因素。
一项由王辰院士牵头,挖掘中国早期慢阻肺的特征的研究,数据来自中国成人肺部健康调查(CPH),将不同定义下的早期慢阻肺分为PRISm、慢阻肺前期、年轻慢阻肺和轻度慢阻肺,定义遵循GOLD2022中的指南和相关文献,其中,PRISm人群指支气管舒张后肺功能FEV1/FVC≥0.70且FEV1和/或FVC<80%预计值,且不合并哮喘;慢阻肺前期人群指有呼吸道症状(慢性咳嗽、咳痰、呼吸困难和/或急性加重)和小气道功能障碍,且未被诊断为慢阻肺病和哮喘;年轻慢阻肺人群指20-50岁且支气管舒张后肺功能FEV1/FVC<0.70,且不合并哮喘;轻度慢阻肺人群指支气管舒张后肺功能FEV1/FVC<0.70且FEV1≥80%预计值,且不合并哮喘,数据结果显示发现PRISm、COPD前期、年轻期和轻度COPD的年龄标准化患病率分别为5.5%(95%可信区间,4.3-6.9)、7.2%6(5.9-8.8)、1.1%6(0.7-1.8)和3.1%6(2.5-3.8)。
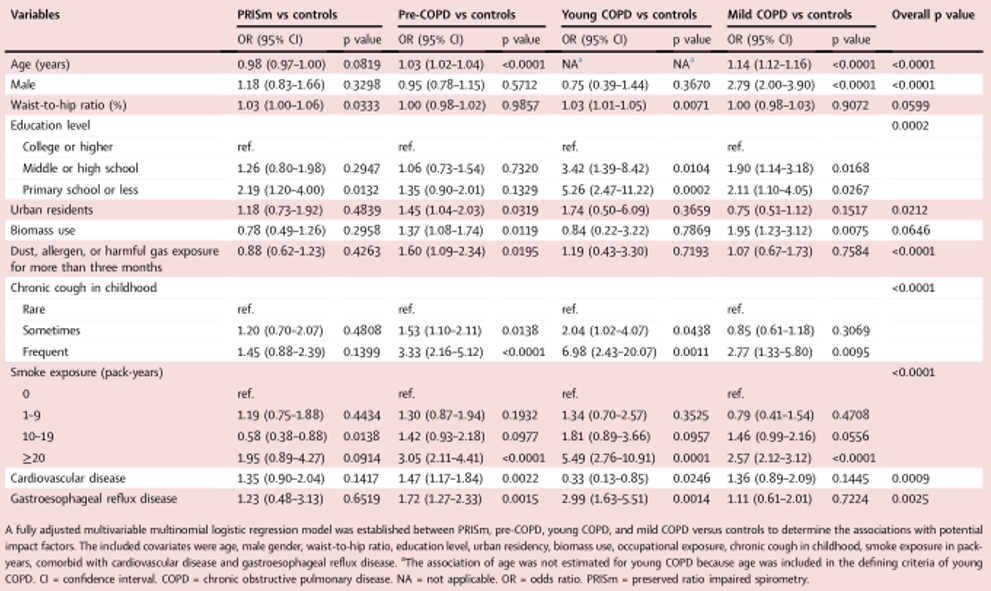
图:不同定义下的早期慢阻肺患病相关因素
二、诊断与评估进展
在诊断方面,慢阻肺诊断金标准是吸入支气管舒张剂之后的FEV1/FVC<0.7,需要特别关注如何在临床推进慢性气道疾病的早期筛查和“诊断”,哪些工具能够帮助我们尽可能的实现不漏诊,不错诊?同时在“评估”方面也有一些研究进展,能否给我们带来对于患者的全面评估,从而给予最合适的治疗方案。由于慢阻肺存在异质性,并不能够将其视为均一疾病,因此需要个体化对待。
1、诊断:
现有慢阻肺诊断标准未充分考虑慢阻肺病理、生理过程的异质性,导致可能出现“需要早期干预的年轻患者诊断不足”、或“不需要治疗的老年患者中出现过度诊断”。
我们一直希望能够建立多维风险因素的预测模型来助力慢阻肺早期诊断,北京大学李立明教授牵头,开发了一种慢阻肺预测模型,通过纳入年龄、吸烟状况、慢阻肺家庭史、BMI、咳痰等14个预测因子,可从一般人群中筛查慢阻肺患者。该模型预测慢阻肺的AUC为0.72,敏感性为70.13%,特异性62.25%。如果缺少肺功能相关检测设备,也可以基于临床特征来筛选慢阻肺高危人群。
既往研究显示CT检查也可用于识别吸烟者中的慢阻肺患者,肺功能检查需要患者配合,而CT相对更简便,可以检查气体陷闭、肺实质破坏等。GOLD2024中也提到,需要从肺癌筛查人群中去筛查慢阻肺,如在CT上发现了其他影像异常,例如重点提及的间质性肺异常,我们也需要进行肺功能检测,研究显示肺癌筛查中,CT显示肺气肿、气体潴留和BMI、以及吸烟状态均为慢阻肺的独立预测因子。同时在2022年柳叶刀委员会发表文章《迈向消除慢阻肺之路》,其中特别提到诊断流程,基于医疗机构的实际情况以及临床医生对于疾病的认识来关注危险因素和临床症状、选择相应的辅助检查,包括肺功能检测、影像检测帮助诊断。
2、评估
诊断之后涉及到全面的个体化评估,包括症状(CAT或mMRC)、肺功能、急性加重史、合并症,以及EOS计数等,除此之外还有一些潜在的生物标志物能够帮助我们判断患者的情况。
合并支气管扩张症
支气管扩张症是慢阻肺最常见的合并症之一,慢阻肺患者合并支气管扩张症的比例可能高达69%。
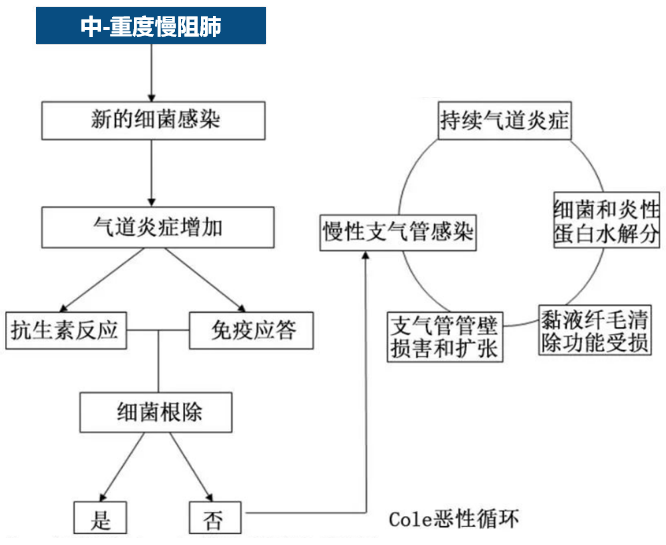
此类人群由于反反复复感染,在影像上经常会出现在下肺、柱状的支气管扩张,这与典型支气管扩张症的影像并不完全一致,有些患者既有慢阻肺、也有典型支气管扩张的临床表现和影像特征,称之为慢阻肺支气管扩张症的重叠。
有研究根据微生物组和蛋白质组学,可将慢阻肺、支气管扩张症及慢阻肺-支气管扩张症重叠分为5种内型,中性粒细胞炎症、革兰阴性菌感染是慢阻肺合并支气管扩张症的主要特征,这种特征也可用来指导临床方案的决策。
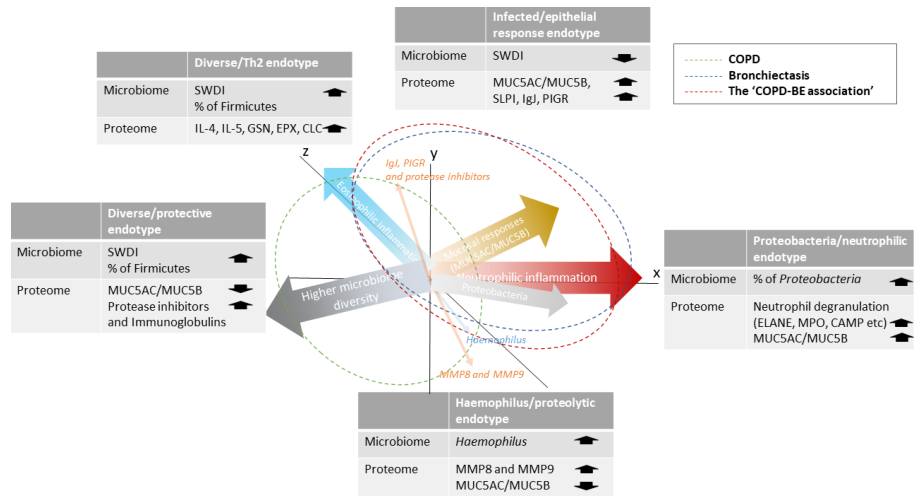
合并感染
目前,对慢性气道疾病如慢阻肺、哮喘、支扩的研究基本趋同,都属于慢性气道疾病大类,其发病机制、治疗方式具有一定共通性,因此我们强调“可治疗的特质”,慢阻肺合并感染应作为一种潜在可治疗特质,得到临床重视。
原因在于,慢性支气管感染在慢阻肺患者中非常普遍,尤其是在严重气流受限和支气管扩张的患者中;慢阻肺可能会导致慢性炎症反应,这与慢阻肺急性加重频率升高和严重程度增加、肺功能衰退加速、肺炎发病率升高、心血管事件、生活质量下降和死亡率升高等有关;在稳定期治疗主要需关注吸入激素的选择,ICS治疗会增加慢阻肺患者发生肺炎的风险,尤其对于合并支气管扩张、有反复感染或者活动性结核的患者,需要特别慎重对待吸入激素造成的不良反应;患者的慢性支气管感染还可能会导致支气管壁的不可逆破坏和支气管腔扩张,影响患者临床表现、预后和治疗。
另外还需要关注曲霉感染,在慢阻肺患者中也较为常见,包括曲霉属真菌定植(13%-29%慢阻肺患者的痰液检出,危险因素包括前一年急性加重、假单胞菌感染和ICS使用及剂量)、慢性肺曲霉病(高达33%-47%的慢性肺曲霉病患者伴有慢阻肺、增加死亡率)、侵袭性肺曲霉病(慢阻肺住院患者的风险升高,危险因素包括慢性心力衰竭、抗生素和糖皮质激素治疗史)、曲霉属真菌敏化患病率可达7.9%-15%)。
病毒、细菌等导致的感染是导致慢阻肺急性加重的最常见病因,研究显示,78%的 AECOPD 患者有明确的病毒或细菌感染依据,一项对慢阻肺急性加重住院患者研究显示,肺炎支原体、肺炎衣原体和嗜肺军团菌的血清学阳性率分别为20.69%、29.66%和10.34%,因此在慢阻肺管理过程中,尤其是发生急性加重时,需要分析是感染原因还是非感染原因所引起的,明确感染致病菌,给予治疗。
合并心血管疾病
慢阻肺患者面临更高的主要心血管事件风险,与无慢阻肺人群相比,慢阻肺患者主要心血管事件风险显著升高25%,然而,患者本身并不了解和关注其合并症,心外科、胸外科等医院外科科室对慢阻肺并不够了解和重视,应加强呼吸科医生与其他科室交流和合作。如若患者早年慢阻肺控制不佳,患者则会发生严重的右心衰,还可能导致左心功能障碍,容易导致急性心脑血管事件增加,因此需要特别关注慢阻肺心肺的相互影响。
慢阻肺合并心血管疾病患病率高达50%左右,一旦合并心血管疾病,慢阻肺患者住院和死亡风险将显著升高,因此在临床上需要关注慢阻肺患者合并心血管疾病,并加强与心内科、心外科合作。
EOS
嗜酸性粒细胞(EOS)的评估也需要重视,在GOLD2024中,已经将EOS指标纳入初始治疗评估体系中,用于指导慢阻肺治疗方案。原因在于EOS与慢阻肺及其预后具有相关性:血EOS水平升高与<65岁人群中慢阻肺风险增加显著相关,慢阻肺稳定期血EOS水平较高预示FEV1下降幅度较大,血EOS水平也可预测ICS治疗反应。但也存在不统一的声音,需要更多临床研究来证实,但GOLD2024纳入其中,也证明其确实有循证医学证据,可作为生物标志物之一进行指导。
其他潜在标志物
目前也存在其他生物标志物的研究和探索,例如反映炎症指标的,除了血常规之外,c反应蛋白、纤维蛋白原、白细胞介素、肿瘤坏死因子等都能反映炎症类型,可以在临床上进行这方面的探索。
目前关注通过CT发现的“气道黏液栓”,存在气道黏液栓显著增加了慢阻肺患者的死亡风险。对于有粘液栓的患者,我们需要更加关注其临床治疗,在咳嗽/咳痰的慢阻肺患者中,36%患者通过CT检查发现气道黏液栓,“沉默的气道黏液栓”与慢阻肺患者更差的预后相关。
三、慢阻肺治疗方案进展
在初始治疗和随访治疗中,支扩剂作为慢阻肺治疗的基石没有变化,双支扩剂在GOLD2024更新中是慢阻肺全程管理中的主流方案。
在治疗方面,有研究显示,对于启动时机也会影响患者的结局,如若患者能够在确诊后及时使用支扩剂进行治疗比延迟治疗(确诊大于30天后治疗)相比,未来首次急性加重时间明显延长。因此对患者的起始治疗,需要尽早启动治疗,以降低未来急性加重的发生。
而在真实世界研究中提到,对于慢阻肺患者在EOS≤300个/ul人群中,双支扩剂和固定三联制剂患者急性加重水平相当,但三联方案重症肺炎发生风险明显高于双支扩剂。因此需要关注ICS的不良反应,对于嗜酸性粒细胞高的慢阻肺患者,需要评估其获益和风险。
除此之外,一些生物制剂在同步在做临床研究,期待未来可用在慢阻肺治疗中。
其他非药物治疗,例如戒烟,与持续吸烟者相比,确诊慢阻肺后两年内戒烟的患者全因死亡和心血管死亡风险分别显著下降17%和44%;还有呼吸康复训练:呼吸康复在慢性呼吸系统疾病管理中的发展时间已久,呼吸康复最早应用于慢阻肺患者,随着循证证据的丰富,其适应症逐步扩大,非慢阻肺呼吸系统疾病患者也可从中获益,也有研究显示,居家康复训练相较于常规护理可显著改善患者运动能力和健康相关生活质量,且改善作用与中心康复训练相似。
整体来讲,围绕慢阻肺诊疗,因为有了武器,所以有了信心,源源不断的药物治疗方案可以供医生和患者可以更好的进行慢阻肺管理,但对于慢阻肺探索依旧向前不停,个体化评估,个体化治疗仍存在存在未被满足的需求,那么对于疾病的探索,对于治疗方案的选择,对于患者如何更科学的管理,仍需各位同道一并努力,最终达到消灭慢阻肺的目的。
参考文献
[1] GBD 2019 Chronic Respiratory Diseases Collaborators. EClinicalMedicine. 2023 May;59:101936.
[2] Li M, et al. BMJ Open Respir Res. 2023 Jul;10(1)e001698.
[3] Stolz D, et al. Lancet. 2022 Sep 17;400(10356):921-972.
[4] GOLD 2024
[5] Dharmage SC, et al. Lancet Respir Med. 2023 Mar;11(3):273-282.
[6] GOLD 2022
[7]韩姚嫔, 等. 中华预防医学杂志,2023,57(8):1164-1170.
[8]吴繁, 等. 中华结核和呼吸杂志,2023,46(10):1028-1034.
[9] Divo MJ, et al. Eur Respir J. 2023 Sep 28;62(3):2300806.
[10] Fan J,et al. Lancet Reg Health West Pac. 2023 Dec 18;44:100984.
[11] Global Strategy for the Diagnosis, Management, and Prevention of COPD: 2024 Report.
[12] Wan ES, et al. Respir Res. 2014 Aug 6;15(1):89.
[13] Lu J, et al. Respir Res. 2022 Nov 11;23(1):309.
[14] Lei J, et al. Lancet Reg Health West Pac. 2024 Feb 6;45:101021.
[15] Lin CH, et al. Int J Chron Obstruct Pulmon Dis. 2023 Jul 19;18:1511-1524.
[16] Zhang B, et al. Chin Med J (Engl). 2023 Mar 20;136(6):676-682.
[17] Mets OM, et al. JAMA. 2011 Oct 26;306(16):1775-81.
[18] Tanday S. Lancet Respir Med. 2015 Aug;3(8):605.
[19] https://www.nature.com/articles/d41586-020-01373-x
[20] Polverino E, et al. Eur Respir J. 2018 Sep 15;52(3):1800328.
[21]戴中上, 等. 结核与肺部疾病杂志,2023,4(6):499-505.
[22] Huang JT, et al. Am J Respir Crit Care Med. 2022 Aug 15;206(4):417-426.
[23]周倩宜. 中国综合临床,2014,30(1):101-103.
[24]王佳美, 等.中国呼吸与危重监护杂志,2024,23(01):53-59.
[25] Martínez-García MÁ, et al. Chest. 2022 Nov;162(5):970-972.
[26] Tiew PY, et al. Mycopathologia. 2021 Oct;186(5):623-638.
[27]慢性阻塞性肺疾病急性加重诊治专家组. 国际呼吸杂志,2023,43(2):132-149.
[28] Duus LS, et al. Int J Cardiovasc Imaging. 2023 Dec 1.
[29] Maclagan LC, et al. Eur Respir J 2023; 62(2):2202364.
[30]中华医学会呼吸病学分会慢性阻塞性肺疾病学组, 等. 中华结核和呼吸杂志,2022,45(12):1180-1191.
[31] Giezeman M, et al. Int J Chron Obstruct Pulmon Dis. 2023 Jan 9;18:11-21.
[32] Han Z, et al. Comput Biol Med. 2022 Dec;151(Pt A):106187.
[33] Ferrari M, et al. J Bras Pneumol. 2022 Dec 2;48(6):e20220183.
[34] Kiani A, et al. Can Respir J. 2023 Apr 26;2023:8678702.
[35] Pu J, et al. Int J Chron Obstruct Pulmon Dis. 2023 Feb 28;18:169-179.
[36] Hegewald MJ, et al. Int J Chron Obstruct Pulmon Dis. 2020 Oct 23;15:2629-2641.
[37] Hu HS, et al. Front Immunol. 2023 Nov 15;14:1230766.
[38] Alexander G, et al. Rethinking Blood Eosinophils for Assessing ICS Response in COPD: A Post-Hoc Analysis from FLAME.(Preprint). https://www.medrxiv.org/content/10.1101/2023.10.06.23296651v1.
[39] Lan CC, et al. Respirology. 2023 Dec;28(12):1136-1146.
[40] Diaz AA, et al. JAMA. 2023 Jun 6;329(21):1832-1839.
[41] Mettler SK, et al. Chest. 2023 Nov 25:S0012-3692(23)05825-7.
[42] Yamada H, et al. Respir Res. 2022 Sep 19;23(1):255.
[43] Suissa S. Eur Respir J. 2023 Sep 9;62(3):2300883.
[44] Buhl R, et al. Adv Ther. 2023;40(7)3263-3278.
[45] Ritchie AI, et al. Chest. 2023 Oct;164(4):875-884.
[46] Bhatt SP, et al. N Engl J Med. 2023 Jul 20;389(3):205-214.
[47] Yousuf AJ, et al. Lancet Respir Med. 2022 May;10(5):469-477.
[48] Doo JH, et al. BMC Pulm Med. 2023 Jul 3;23(1):237.
[49]中国老年医学会呼吸病学分会, 等. 中华结核和呼吸杂志,2022,45(8):753-761.
[50] Uzzaman MN, et al. Eur Respir Rev. 2022 Sep 20;31(165):220076.
[51] Casaburi R. Respir Care. 2008 Sep;53(9):1185-9.
[52] Hodgkin JE, et al. Am Rev Respir Dis. 1981 Nov;124(5):663-6.
[53] Spruit MA, et al. Am J Respir Crit Care Med. 2013 Oct 15;188(8):e13-64.
[54] Holland AE, et al. Ann Am Thorac Soc. 2021 May;18(5):e12-e29.
专家介绍

陈亚红
主任医师、教授、博士生导师,博士后合作导师;北京大学第三医院呼吸与危重症医学科副主任,北京大学医学部慢性气道疾病中心副主任,科研伦理综合办公室主任;专业特长:呼吸系统常见病及疑难危重症疾病;研究方向:气道慢性炎症疾病;中华医学会呼吸病学分会肺功能学组副组长;中国康复医学会呼吸康复专业委员会常委;北京慢性病防治与健康教育研究会呼吸病学专业委员会主任委员;中国抗癌协会肿瘤呼吸病学专业委员会常委;中华医学会呼吸病学分会慢阻肺学组委员;中国医师协会呼吸病分会慢阻肺工作委员会委员;中国基层呼吸疾病防治联盟副主席;中华结核和呼吸杂志、中华健康管理学杂志等编委、中华医学杂志英文版通讯编委;承担多项国家级和省部级科研基金,获得北京市科技新星计划支持和教育部新世纪优秀人才支持计划。研究结果获得北京市科技进步三等奖和中华医学科技奖三等奖。
本文由《呼吸界》编辑 Jerry 整理、排版,感谢陈亚红教授的审阅修改!
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


