
今天与大家分享的题目是《儿童呼吸道感染后持续咳嗽的诊治》。我将分三部分与大家一起讨论:一、儿童感染后持续咳嗽:医疗和家庭的双重困扰;二、感染后持续咳嗽由何而起?免疫、气道炎症,气道上皮损伤和咳嗽高敏感性;三、儿童感染后持续咳嗽的治疗困境,需要规范病因诊断及针对病因进行治疗。
儿童感染后持续咳嗽:医疗和家庭的双重困扰
咳嗽是儿童上呼吸道感染后第二常见症状,超过8成儿童在上呼吸道感染后出现咳嗽。同时,咳嗽通常是呼吸道感染后最晚消失的症状。[2]
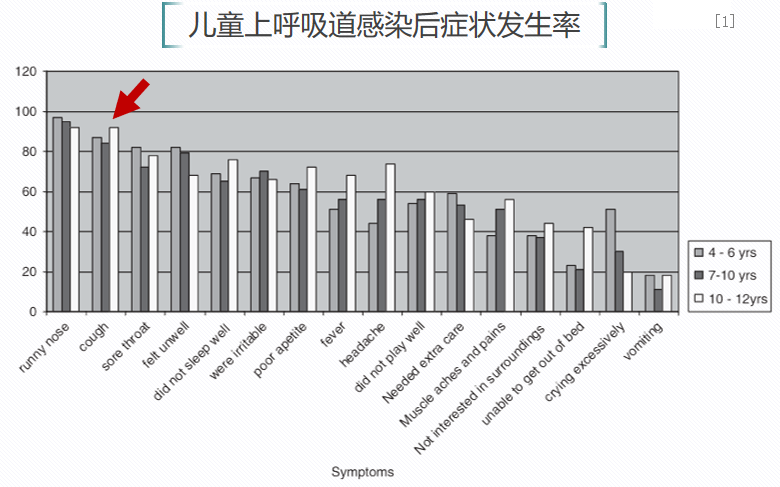
一项前瞻性研究,通过父母记录日记的方式分析学龄儿童上呼吸道感染的症状和病程。共收集20所小学223份日记,其中发生上呼吸道感染儿童共计146例。提示:如果小孩得了上呼吸道感染,会出现一系列症状,包括流鼻涕、咳嗽、发热、咽痛等等。从数据中可以看到,学龄儿童如果得了上呼吸道感染,80%以上都会出现咳嗽。[1]

一项荟萃分析,检索至2022年5月27日,报告COVID-19长期影响的研究,随访时间为感染后3-12个月,纳入17项研究,共124,568名儿童/青少年,结果发现:存在持续咳嗽(4%)、肺功能异常(24%)等症状。Meta分析显示:17项研究中15项研究报告儿童/青少年新冠感染后3-12个月,咳嗽仍可存在。以上研究数据提示我们,咳嗽是呼吸道感染最常见症状之一,也是最晚消失的症状。[2、3]
最常见病因:病毒、细菌、不典型病原等引起的气管炎、支气管炎、毛细支气管炎、肺炎等急性呼吸道感染;其次病因:哮喘、支气管扩张症、上呼吸道咳嗽综合征(UACS) 等基础疾病的恶化;其他:如先天性心肺发育异常等可因呼吸道感染诱发出现急性咳嗽咳痰。[4、5]
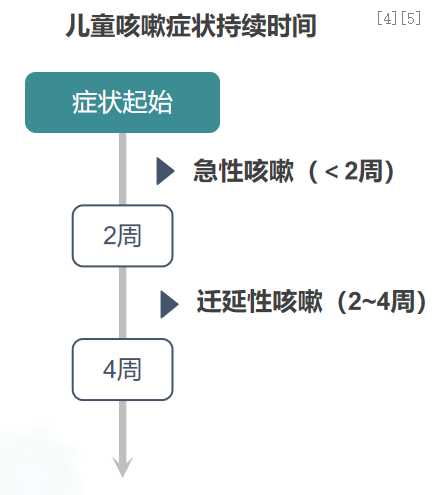
针对感染后咳嗽及其不同类型如何进行辨别与区分呢?感染后咳嗽可根据持续时间划分为急性咳嗽、迁延性咳嗽和慢性咳嗽。例如,感染病程中咳嗽持续不超过2周的,称为急性咳嗽;急性感染后咳嗽症状反复出现,持续4周以上的,称为慢性咳嗽;而持续时间在2周至4周之间的,称为迁延性咳嗽。有人或许会疑惑,为何有些感染者仅表现为咳嗽,而另一些则发展为迁延性或慢性咳嗽呢?
针对急性咳嗽,多数情况下,其源于细菌、病毒或非典型病原体(如支原体)等感染引发的急性炎症过程。大多数患者在两周内症状可逐渐缓解,约有80%的患者的咳嗽症状在10天内逐步消失。若咳嗽持续不断,我们需要深入思考其严重性,并关注患者是否存在基础性疾病,如哮喘、上气道咳嗽综合征或其他慢性呼吸道疾病等。这些疾病可能导致患者在急性呼吸道感染后病情持续不愈。同时,我们还应留意是否存在慢性疾病,如支扩、囊性纤维化、纤毛不动或免疫功能缺陷等,乃至先心病或使用免疫抑制剂的患儿等。在急性感染期,这些患者的病情可能出现迁延。因此,这是一个系统的评估过程。
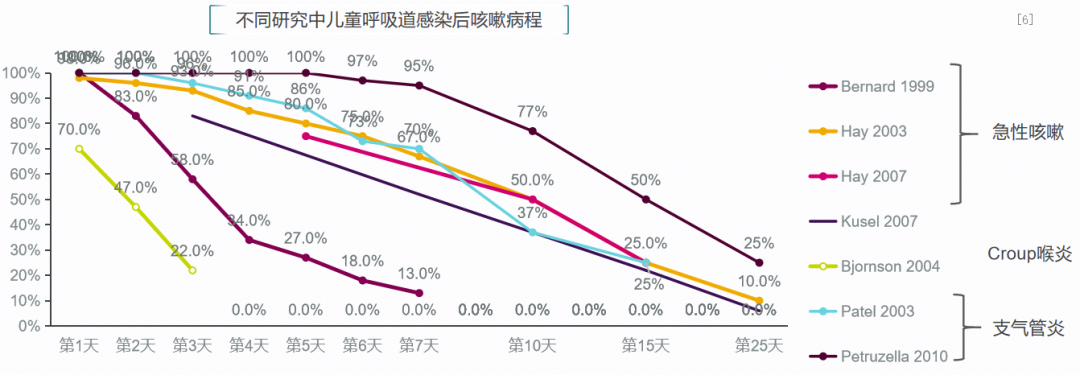
这项系统评价纳入了23项随机对照研究和25项观察性研究,分析儿童急性呼吸道感染发生时各项症状的持续时间。从不同研究数据显示,儿童急性呼吸道感染后,咳嗽症状多在2-3周内消失;报告有症状儿童比例的五项研究结果汇总,50%的儿童在10天时咳嗽得到缓解,90%的在25天时缓解。[6]
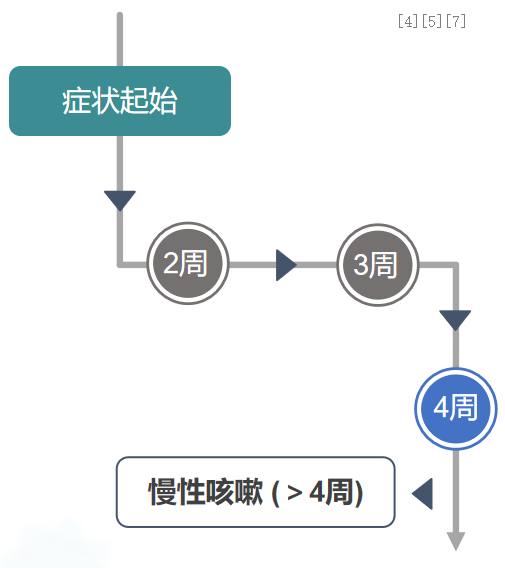
为何患儿会出现迁延性咳嗽?部分患儿甚至在25天后仍超过4周(28天)?这实则已步入慢性咳嗽的范畴。我们将肺部无病灶且出现持续咳嗽的患者纳入慢性咳嗽的诊断与鉴别诊断之列。
陆权教授曾召集了国内20多家、总共纳入4400多名反复咳嗽超4周的患儿进行病因分析,得出结论:中国儿童最常见病因:咳嗽变异性哮喘(CVA)、上气道咳嗽综合(UACS)和感染后咳嗽(PIC)(1B)。进而再根据病因是否明确分类,分为特异性慢性咳嗽:可识别出潜在病因(通常是肺部来源),儿童慢性咳嗽大部分可识别出病因;非特异性慢性咳嗽:指咳嗽为主要或唯一表现,经适当检查与评估后,仍然无法明确病因。再根据咳嗽性质分类,分为无痰:干性咳嗽,常见于哮喘、CVA、百日咳、PIC等;有痰或明显痰鸣音:湿性咳嗽,常见于上气道咳嗽综合征(UACS)、哮喘合并感染、迁延性细菌性支气管炎(PBB)与慢性化脓性肺病(CSLD)、支气管扩张(BE)等。[4、5、7]
因此,针对持续性咳嗽且病情拖延不愈的患者,务必确保诊断和鉴别诊断的准确性。例如,当面临慢性咳嗽的患儿,咳嗽持续时间超过4周时,需深入分析为何会出现如此长时间的咳嗽?呼吸道感染是其中一个诱发因素。若患儿存在轻微咳嗽变异性哮喘或哮喘,近期某次感染后引发持续咳嗽,支气管激发试验结果显示气道高反应性,应注意病毒感染可能导致气道敏感性增加。感染会使机体咳嗽受体的敏感阈值降低,进而引发一系列症状。关键在于从病史中进行区分。
我国儿童慢性咳嗽的许多病因可源自呼吸道感染,主要包括以下四个方面[4、7-9]:
1、感染后咳嗽(PIC)。通常患者会描述,在某次感染后,他们出现了反复咳嗽。过去,我们可能了解到的病因是感染所致,但并未进行全面病原学分析。自新冠疫情以来,我们对患者在感染期间,尤其是急性感染阶段,已开始进行病原学筛查,包括鼻咽拭子检测甲型、乙型流感病毒以及呼吸道常见病毒和新冠病毒等。在这种情况下,我们发现部分患者在感染甲流、乙流或二次感染后,出现了反复咳嗽的症状。我们将这种现象称为感染后咳嗽。PIC中国儿童慢性咳嗽病因构成比的第3位,占21.72%,高发年龄段为1-3岁和3-6岁儿童;引发PIC的常见病原体:呼吸道病毒 (如鼻病毒、新冠病毒、流感病毒、呼吸道合胞病毒、副流感病毒等)、肺炎支原体、肺炎衣原体、卡他莫拉菌和百日咳杆菌等。
2、上气道咳嗽综合征(UACS)。UACS在我国儿童慢性咳嗽病因中位列第二,占比达到24.71%,主要影响3至6岁的儿童。在1岁以上儿童慢性湿性咳嗽中,UACS则是首要原因。其主要包括变应性鼻炎、鼻-鼻窦炎、腺样体肥大等病症。引发UACS的可能因素与感染和炎性反应有关。这些数据提示,上气道咳嗽综合征可能涉及多种病因,如变应性鼻炎、鼻-鼻窦炎、腺样体肥大,包括慢性扁桃体炎、充血性鼻炎等。部分病症可能与感染及感染后引发的气道炎症相关。在进行病因分析时,需关注呼吸道感染以及感染后气道炎症的可能性。
3、咳嗽变异性哮喘(CVA)或哮喘伴感染。CVA作为我国儿童慢性咳嗽的首要病因,其所占比例为41.95%,尤其在3-6岁的儿童中发病率较高。然而,近年来CVA在我国儿童慢性咳嗽中的占比有所下降。引发CVA的原因包括感冒等呼吸道感染,这类感染容易诱发CVA,也可能导致CVA病情加重。
4、迁延性细菌性支气管炎(PBB)。PBB是引起5岁以下儿童慢性湿性咳嗽的重要病因,常见病原体包括未分型流感嗜血杆菌、肺炎链球菌及卡他莫拉菌等。在此情况下,应着重排查迁延性湿性咳嗽,如细菌性支气管炎或慢性细菌化脓性支气管炎。针对有痰的咳嗽,需深入寻找病因,若患者无既往病史,则可能是本次细菌感染所致,如流感嗜血杆菌、肺炎链球菌、卡他莫拉菌等引发的急性化脓性细菌性鼻窦炎,进而导致鼻后滴流综合征和肺部支气管炎。同时,需关注患者是否存在基础疾病,如囊性纤维化、运动功能障碍、支气管扩张等,并予以相应的诊断和鉴别诊断。
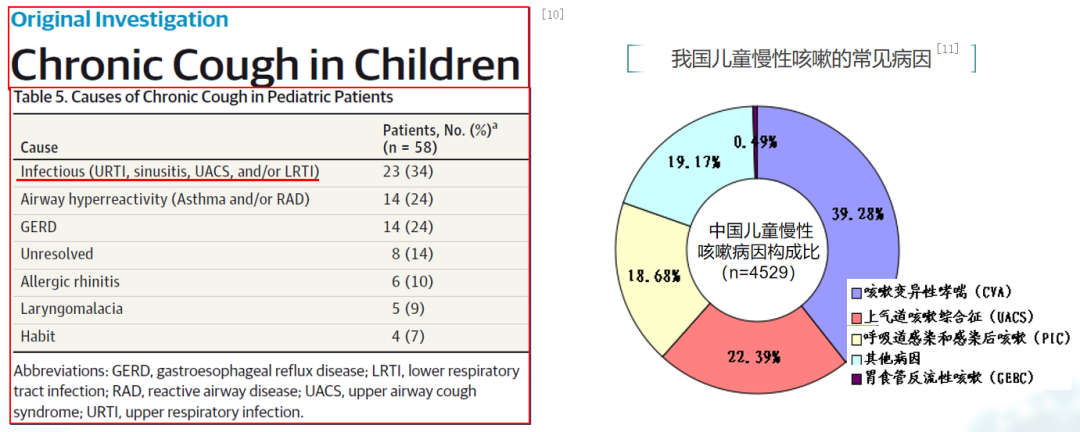
左图是一项回顾性分析,纳入了2009-2013年某诊所就诊的58例慢性咳嗽儿童患者。医疗信息被调取以分析常见病因、治疗方案及疗效。其中提到的感染后咳嗽相关病因包括鼻窦炎、上气道咳嗽综合征、下呼吸道感染等,表明感染是触发感染后咳嗽的因素之一。[10]
如右图所示,一项全国范围内的调研纳入了29家医院的4529例慢性咳嗽患儿,旨在分析慢性咳嗽的病因构成。研究结果显示,感染后咳嗽位列第三,占比为18.68%。此外,尚有一部分病例(占比19.17%)咳嗽原因无法明确。[11]
儿童在经历呼吸道感染后,常常会出现感染后咳嗽(post-infectious cough,PIC)。如何对其进行定义呢?首先需观察患者在急性上呼吸道感染(URI)后,咳嗽持续时间是否超过4周,并具有一定的自限性。若在急性URI后,咳嗽持续时间超过8周,则可能为PIC,但在8周内患者仍可能再次发生URI。非PIC的情况则需在PIC症状背后寻找其他病因。可能的病原体包括病毒(V)、肺炎支原体(Mp)、肺炎衣原体(Cp)、百日咳杆菌以及结核杆菌等。从发病机制来看,PIC的可能原因包括上皮细胞坏死、脱落,一过性气道炎症/气道高反应性(AHR),以及咳嗽反射敏感性增高。在临床诊断时,需关注患者的病史(如是否有明确的呼吸道感染史)、咳嗽特点(如干咳或湿咳),并进行相关检查,多数情况下检查结果会呈正常。针对PIC的治疗措施包括抗感染治疗、支气管舒张治疗以及抗气道炎症治疗等。[12、13]
呼吸道感染,其中包括病毒、肺炎支原体、肺炎衣原体、卡他莫拉菌以及百日咳杆菌等多种病原体,均与病原体诱导性咳嗽(PIC)有关。鼻病毒、冠状病毒、流感病毒、呼吸道合胞病毒、副流感病毒等病毒,以及肺炎支原体、肺炎衣原体、百日咳杆菌等病原体,均可引发上呼吸道感染,进而导致长期咳嗽,甚至可能持续八周以上。在所有引发PIC的病毒中,鼻病毒(感冒)占据30%-50%的比例;冠状病毒占比10%-15%;流感病毒占比5%-15%;呼吸道合胞病毒占比5%;副流感病毒占比5%;腺病毒占比小于5%;偏肺病毒占比不明。此外,百日咳杆菌、肺炎支原体、肺炎衣原体等病原体感染后,长期持续咳嗽的情况较为常见。在婴儿和易感患儿中,流感嗜血杆菌、肺炎链球菌、卡他莫拉菌等病原体导致的PIC较为常见。[13-15]
咳嗽变异性哮喘(CVA)或哮喘合并呼吸道感染可能导致感染后咳嗽持续不断。一方面,哮喘患者更易遭受呼吸道感染,而在感染后易于出现咳嗽。哮喘患者是呼吸道感染的高危人群。临床数据表明,相较于正常人群,哮喘患者更容易遭遇呼吸道感染;同时,呼吸道感染也是哮喘发生、发展及急性加重的重要诱因。呼吸道合胞病毒、鼻病毒、肺炎支原体等病原体是导致哮喘反复发作和难以控制的常见因素;咳嗽则是哮喘的典型症状之一。哮喘患者在遭遇呼吸道感染后,咳嗽阈值降低,因而更易出现咳嗽。另一原因是咳嗽变异性哮喘(CVA)。CVA是一种以咳嗽为主要或唯一症状的不典型哮喘。研究认为,CVA可视作典型哮喘的早期阶段,约有30%的CVA病例最终可能发展为典型哮喘;相较于典型哮喘,CVA具有更高的咳嗽敏感性,伴随更多的喉部症状和较轻的气流阻塞特征。[7、16-21]
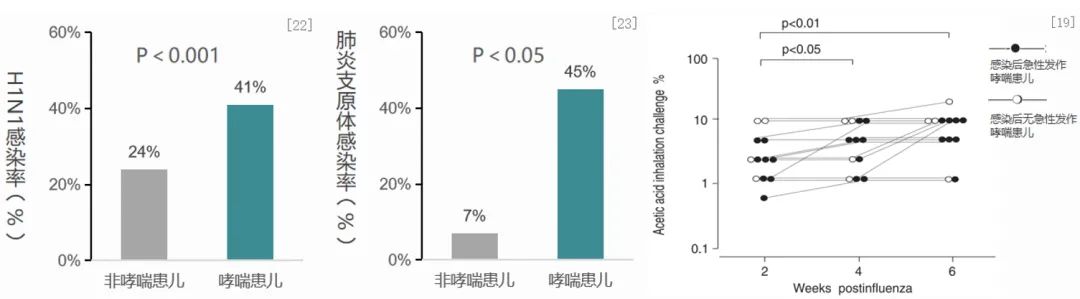
哮喘患儿较非哮喘患儿更易出现呼吸道感染。左图展示了一项前瞻性研究,共纳入180名4-12岁儿童(其中包括95名哮喘患者和66名非哮喘患者),连续8周进行病毒诊断,以评估哮喘与非哮喘儿童在病毒高峰季节的H1N1感染状况。另一项研究(中图)针对152名支气管哮喘患儿和100名上呼吸道感染患儿进行肺炎支原体抗体(MP-Ab)阳性检测,探讨儿童哮喘与MP的关系。右图展示了一项前瞻性、非对照研究,纳入12名甲流H1N1感染的哮喘患儿,在H1N1感染后2、4和6周分别接受乙酸(AA)吸入测试,以评估H1N1流感病毒感染对哮喘儿童咳嗽阈值的影响。研究结果显示,相较于非哮喘儿童,哮喘患儿H1N1病毒和肺炎支原体的感染率显著提高;哮喘儿童在H1N1病毒感染后,咳嗽阈值可降低,从而增强咳嗽反应。综上,哮喘患儿呼吸道感染发生率较高,且感染后咳嗽阈值降低。[19、22、23]
上气道咳嗽综合征(Upper Airway Cough Syndrome,UACS)并非一种特定疾病,而是由多种上呼吸道疾病引发的慢性咳嗽综合征。病因方面,各类鼻炎(包括变应性与非变应性)、鼻窦炎、慢性咽炎、慢性扁桃体炎、鼻息肉、腺样体肥大等均属于上气道疾病,UACS的病因则涵盖了变应性鼻炎、鼻-鼻窦炎、慢性咽扁桃体炎、腺样体肥大等上气道疾病,病变范围涉及鼻、咽、喉。咳嗽的发生可能与感染和炎性反应有关。UACS是儿童湿性咳嗽的主要原因之一。临床表现包括咳嗽持续时间超过4周,伴有白色泡沫稀痰或黄绿色脓痰;咳嗽在晨起、夜间或体位变化时加剧;伴有鼻塞、流涕、喷嚏、鼻痒、咽干、头痛等症状,以及咽后异物感和反复清咽等。需要注意的是,UACS通常并非诊断终点,而需进一步明确原发疾病(病因)。儿童普通感冒时常伴发病毒性鼻窦炎,症状包括流涕、咳嗽等,若持续时间超过4周,则可能发展为慢性咳嗽。[7-9]
迁延性细菌性支气管炎(简称PBB)是一种由细菌引发的慢性支气管内膜感染性疾病,过去曾被称为化脓性支气管炎、迁延性支气管炎以及支气管扩张症(BE)前期等。常见病原体包括未分型流感嗜血杆菌、肺炎链球菌等呼吸道常见细菌。本病的发病机制与细菌在气道内形成生物被膜、气道黏液纤毛清除功能受损、全身免疫功能缺陷以及气道畸形(如气道软化)等因素紧密相关。PBB是导致5岁以下儿童慢性湿性咳嗽的重要病因。临床表现主要为持续超过4周的湿性(有痰)咳嗽;下呼吸道感染证据包括痰或支气管肺泡灌洗液(BALF)细菌培养阳性,菌落计数≥104 cfu/mL;经过2周以上的抗菌药物治疗,咳嗽可明显好转。需要注意的是,为确保PBB的确诊,抗菌药物治疗需持续4周以上,方能显著缓解咳嗽症状。若难治性PBB持续不愈,可进展为慢性化脓性肺疾病(CSLD),后者进一步恶化可能导致BE。目前认为,PBB、CSLD、BE症可能为同一疾病在不同发展阶段的表现。[7-9]
持续咳嗽对患儿身心健康造成严重负面影响。在一项前瞻性队列研究中,研究者纳入了839名小于15岁、因急性呼吸系统感染导致咳嗽就诊的儿童,并对他们进行了28天的随访。若28天后仍咳嗽,则分析其病因。另一项研究纳入了130名患有慢性咳嗽(超过4周)的儿童(中位年龄10岁,范围8-12岁;其中65名为女孩),研究者开发了一套包含37项的儿童慢性咳嗽特异性生活质量(CC-QoL)问卷调查表,并与通用生活质量调查问卷(儿科生活质量量表4.0(PedsQL4.0)、斯宾塞儿童焦虑量表(SCAS)和咳嗽日记评分进行了比较,以验证CC-QoL问卷的统计特性。此外,还有一项叙述性文献综述,研究者对CINAHL、MEDLINE、英国护理索引、PsycINFO、Cochrane Wiley图书馆和ASSIA数据库进行了全面、系统的检索,采用Hawker等人的评估工具严格评估研究质量,探讨慢性非特异性咳嗽对儿童及其家庭的影响。通过CC-QoL评分表(儿童慢性咳嗽特异性生活质量问卷调查表),共包括37个项目,从多维度评估与儿童咳嗽相关的感受和行为,按照7级李克特量表评分(1=一直有,7=没有,分数越高生活品质越高)。[24-27]
研究表明,慢性咳嗽可引起多种严重并发症,如晕厥、心律失常、尿失禁、肋骨骨折等。在持续咳嗽(超过4周)的儿童中,超过三成患者患有新的严重慢性肺部疾病,如哮喘、支气管扩张、阻塞性睡眠呼吸暂停和气管支气管软化症等。慢性咳嗽患儿的生存质量(CC-QOL评分*)明显低于无症状患儿(p<0.001)。长期咳嗽令儿童感到烦恼、不适、尴尬和沮丧,影响他们的社交活动,降低睡眠质量,并导致胸痛和胃痛。由此说明,持续咳嗽会对患儿产生多种并发症和严重慢性肺部疾病,严重损害他们的生存质量。[24-27]
同时,持续咳嗽给患儿、家庭、社会以及医疗系统带来了沉重的疾病负担。在我国的研究中,我们发现慢性咳嗽患儿的咳嗽平均持续时间可达4.8年。研究显示,超过80%的患儿每年因咳嗽就诊次数超过5次,53%的患儿就诊次数超过10次,更有14%的患儿就诊次数甚至超过15次。对于患儿家庭而言,与孩子咳嗽停止的父母相比,那些在随访过程中仍咳嗽的患儿父母在抑郁、焦虑和压力评分上(p=0.004)显著较高。在医疗机构方面,咳嗽是18岁以下儿童和青少年在初级医疗机构就诊的最常见症状。在呼吸道感染流行季节,感染后的持续咳嗽使得原本已负担沉重的儿科呼吸病诊疗更加困难。[24、28、29]
持续咳嗽对患儿家庭和社会带来了沉重的经济负担。反复的检查、多种治疗或反复治疗、症状控制不佳导致的多次转诊,以及家长因陪同患儿就诊而产生的误工费和交通费等,都对家庭经济造成了压力。数据显示,我国2016年呼吸道用药零售药店市场规模达到516.2亿元,其中镇咳药和感冒药占比达到76.2%。此外,美国因咳嗽导致的年均经济损失高达90亿美元,英国则为9.79亿英镑。这些数据无疑凸显了持续咳嗽对社会经济造成的影响。[30、31]
感染后持续咳嗽由何而起?免疫、气道炎症,气道上皮损伤和咳嗽高敏感性
在这样的大背景下,我们更加需要深入了解感染后咳嗽的发病机制及其过程。为何部分患者病情持续时间较长?可能与免疫气道炎症、气道上皮损伤以及咳嗽高敏感性密切相关。
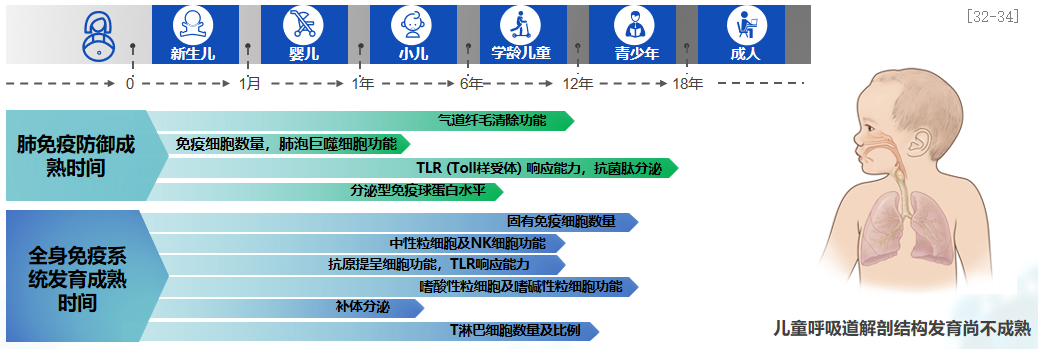
探讨一下为何儿童感染后咳嗽的发生率相较于成人更高?在成人慢性咳嗽的病因排列中,首位为上气道咳嗽综合征,其后是咳嗽变异性哮喘,紧接着是胃食道反应,感染后咳嗽则位列第四。然而,在儿童群体中,感染后咳嗽的排名上升至第三位,病因分布顺序因此有所不同。儿童的免疫系统正处于不断发育和完善的阶段,尤其是小儿肺免疫防御和全身免疫系统。婴幼儿的抵抗力较低,原因在于其肺免疫防御和全身免疫系统尚未完全发育。当婴幼儿的母体免疫水平下降时,他们容易发生呼吸道感染,这与婴幼儿免疫系统尚未正常建立有关。同时,儿童的呼吸道发育尚不成熟,气道相对狭窄,黏膜柔韧,感染时容易出现出血、水肿等现象。儿童屏障功能不成熟,纤毛运动较弱,因此在感染时,特别容易出现黏液高分泌,且分泌物易阻塞气道,导致重症感染。综上,儿童呼吸道发育不成熟,病原体易于侵入,屏障功能较差,因而易于发生感染。[32-34]
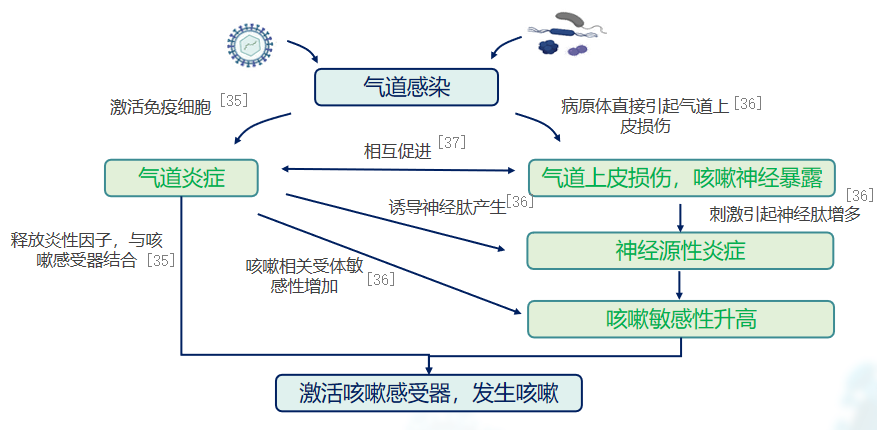
关于感染后引发慢性咳嗽的相关机制,目前各界普遍接受的见解包括四大学说。这些学说认为,在呼吸道感染发生后,多种因素共同作用导致持续咳嗽的发生与发展。其中包括气道炎症、气道上皮损伤、神经源性炎症以及咳嗽高敏感性,这些均是呼吸道感染后持续咳嗽的关键病理因素。[35-37]
感染会导致气道黏膜受损,进而引发非特异性气道炎症,这是咳嗽的主要原因。气道炎症反应会导致气道黏膜充血、水肿、黏液分泌增加等症状,进而刺激咳嗽中枢,引发持续性咳嗽。气道炎症反应涉及多种细胞和分子机制。感染后,气道内的免疫细胞(如巨噬细胞、淋巴细胞)会被激活,释放多种炎性细胞因子(如肿瘤坏死因子-α、白细胞介素-1、白细胞介素-8等)。这些炎性细胞因子进一步刺激气道上皮细胞和神经末梢,导致气道炎症反应和咳嗽。另外,气道炎症还会引发气道高反应性(BHR),这是哮喘和慢性咳嗽的重要特征。气道高反应性是指气道对各种刺激因素(如冷空气、过敏原、感染等)的反应过度,表现为气道收缩、黏膜水肿、咳嗽等症状。感染后咳嗽患者的气道高反应性可持续较长时间,这也是咳嗽症状难以缓解的原因之一。[35-37]
感染后咳嗽的病理机制还与气道神经源性炎症有关。气道神经末梢受到炎症刺激后,释放神经递质(如速激肽、前列腺素等),进而激活咳嗽反射中枢,导致持续咳嗽。同样道理,病毒激活神经源性炎症,导致咳嗽敏感性升高。[35-37]
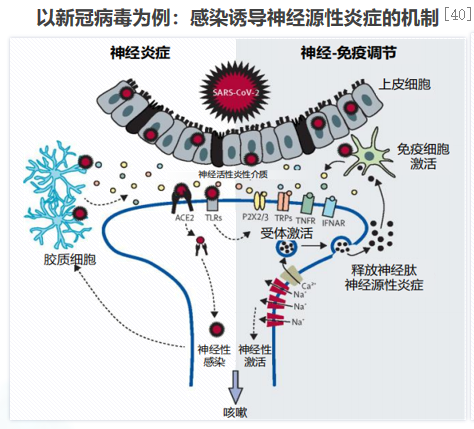
以新冠病毒为例,新冠病毒直接侵蚀迷走神经,感觉神经元亦存在ACE2受体(ACE2即血管紧张素转化酶2,新冠病毒主要依靠其表面的S蛋白上的受体结合域识别宿主细胞ACE2,并与之结合感染宿主细胞),因此新冠病毒可能侵袭迷走神经的感觉神经元与神经胶质细胞等,诱发神经肽与炎性介质释放,从而引起咳嗽;引起局部神经炎症,参与新冠病毒感染与识别的上皮细胞及炎症细胞(如巨噬细胞、中性粒细胞、淋巴细胞等)可以释放多种细胞因子与炎性介质;持续神经炎症导致咳嗽高敏感性,神经肽与神经炎性介质可进一步招募和激活免疫细胞,导致肺部与气道炎症,增强咳嗽敏感性。[40]
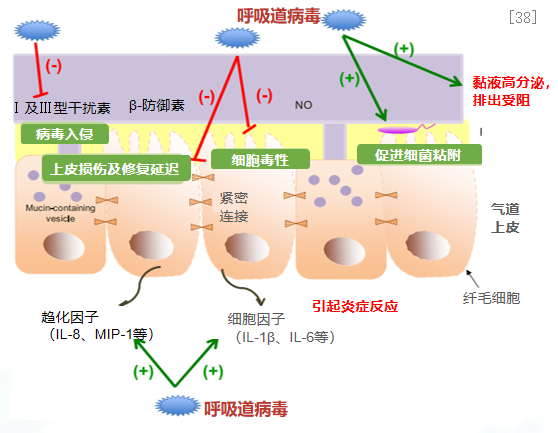
呼吸道病原体感染时,可直接损伤气道上皮细胞。1、完整性破坏:病毒导致上皮细胞凋亡,细胞间紧密连接遭到破坏;2、黏液高分泌,排出受阻:刺激黏液分泌,影响纤毛摆动,导致黏液聚集;3、影响气道免疫反应:减少干扰素的合成,诱导炎症趋化因子和细胞因子生成,抑制气道免疫反应,引发炎症反应;4、促进细菌定植:促进细菌粘附在气道上皮,帮助细菌突破上皮屏障。[38]
同样,气道上皮损伤也可导致病理变化:1、气道上皮损伤会引发炎症反应,导致淋巴细胞、巨噬细胞和中性粒细胞等炎症细胞浸润。这些炎症细胞释放多种炎性介质和细胞因子,进一步加重气道炎症。[38]
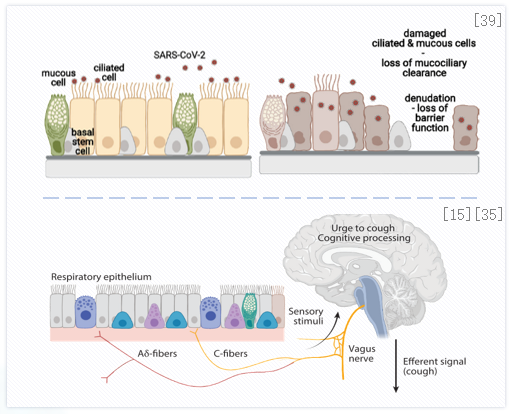
2、气道上皮损伤可导致外周咳嗽神经暴露。气道上皮损伤使黏膜下感觉神经末梢暴露,导致自主神经功能紊乱。肾上腺素能神经活性降低,磷酸腺苷水平降低,使气道反应性增加,容易发生咳嗽反射。以新冠病毒感染为例:新冠可感染表达ACE2的气道上皮纤毛细胞,随后复制并感染邻近细胞。受感染的气道上皮细胞脱落,导致气道上皮屏障严重受损。上皮屏障损伤后,直接暴露气道上皮下的咳嗽感受器,包括Aδ纤维和C纤维,引起咳嗽高敏感性。(注:Aδ-纤维快适应感受器(RAR)刺激阈值低,传导速度快,是诱发咳嗽的主要纤维;C纤维是无髓鞘的迷走传入神经,在整个呼吸道均匀分布。)[15、35、39]
3、气道上皮损伤可能导致气道壁结构发生变化,如气道平滑肌增厚、上皮细胞脱落等,从而导致气道重塑。气道重塑会使气道对各种刺激更为敏感,加剧咳嗽症状;[38]
4、气道上皮损伤会影响痰液的生成和清除,使痰液在气道内滞留,导致气道阻塞和咳嗽症状加重;[38]
5、感染后气道上皮损伤,可能导致免疫系统紊乱,使机体对病原体的清除能力降低,容易引发持续性咳嗽。[38]
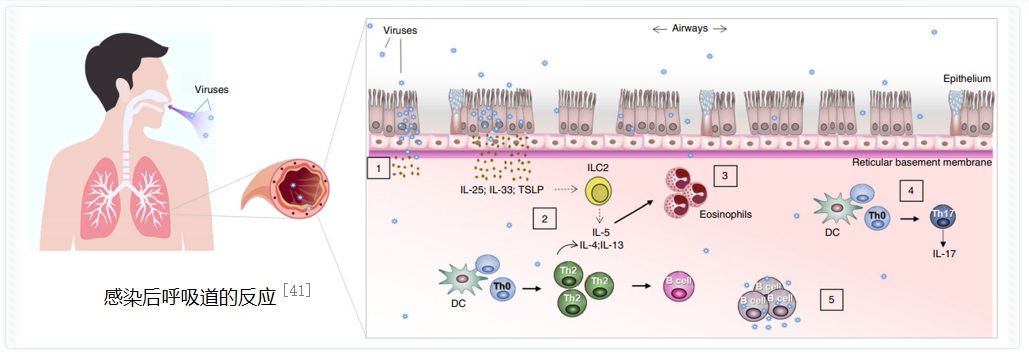
呼吸道病原体感染时,引发过度气道炎症反应。图中①病原体入侵并损伤气道上皮,破坏气道屏障完整性;② ③ 受感染的上皮细胞促进促炎症因子的产生,如IL-25、IL-33和胸腺基质淋巴细胞生成素(TSLP),诱导2组先天淋巴细胞(ILC2s)、树突状细胞(DCs)、Th2细胞激活,增强与哮喘相关的Th2型炎症反应;④呼吸道感染可导致IL-17表达上调(由Th17细胞分泌,与哮喘发生发展有关);⑤一些病毒可直接募集并感染免疫细胞,进而导致气道炎症加剧。[41]
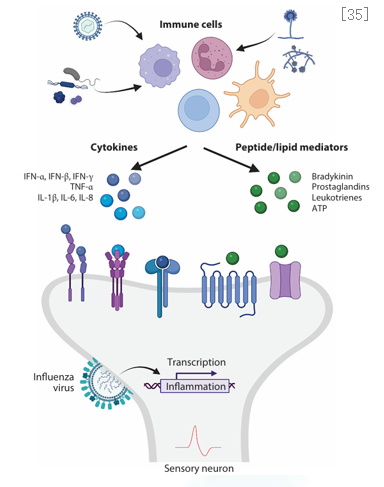
气道炎症产生的多种炎性因子/介质均可与咳嗽感受器结合激发咳嗽。气道炎症产生的多种炎性因子和介质可以通过与咳嗽感受器结合,激发咳嗽反应,这些炎性因子和介质在一定程度上起到了调节气道炎症和咳嗽症状的作用,但过度的炎症反应反而会导致咳嗽症状加重。炎性因子与细胞因子受体结合,刺激咳嗽产生;病原体激活免疫细胞,释放炎性因子以及肽类和脂类炎性介质;流感病毒可直接感染迷走神经,导致迷走神经炎症;肽类和脂类炎性介质可与感觉神经上的G蛋白偶联受体,离子通道结合,刺激咳嗽产生。[35]
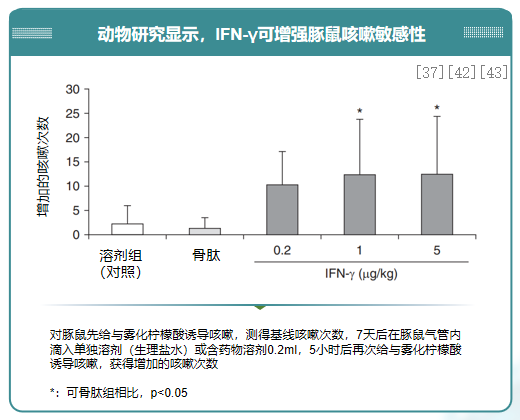
研究显示:病毒感染后产生炎性因子IFN-γ可引发咳嗽高敏感性。咳嗽感觉神经元经病毒侵袭后,可释放大量细胞因子,同时触发局部神经-免疫反应,进一步募集炎症细胞,释放更多细胞因子,包括IFN-γ。肺部聚集的T淋巴细胞可以释放IFN-γ等细胞因子,刺激IFN-γ诱导蛋白 10(IP-10)、IFN-γ 诱导单核细胞因子(MIG)的表达与分泌,进一步募集活化的T淋巴细胞,再分泌IFN-γ等细胞因子,形成炎症正反馈,引起持续性咳嗽。IFN-γ 可通过 JAK/STAT-PKA-AMPA 途径诱导迷走神经元Ca2+内流和膜电位去极化,使神经纤维的静息电位更加接近阈电位,从而增加气道的咳嗽敏感性。[37、42、43]
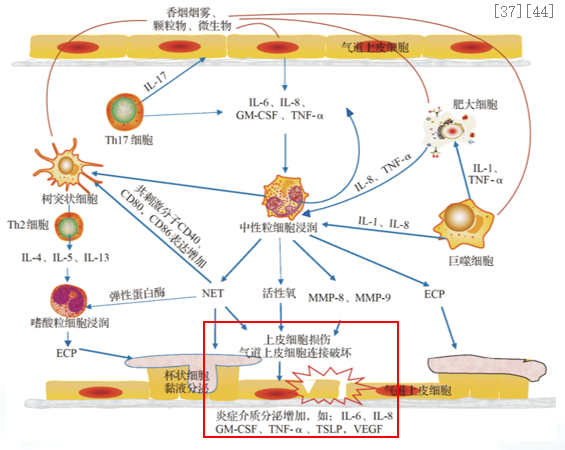
哮喘患儿呼吸道感染加剧气道上皮损伤和气道炎症,刺激咳嗽。哮喘患儿呼吸道感染后更易发咳嗽。各种微生物感染均可使哮喘气道的中性粒细胞增多,加剧气道上皮损伤并增加炎症介质分泌。气道上皮损伤和气道炎症又促进神经源性炎症,导致咳嗽敏感性升高,激活咳嗽感受器,刺激咳嗽发生发展。[37、44]
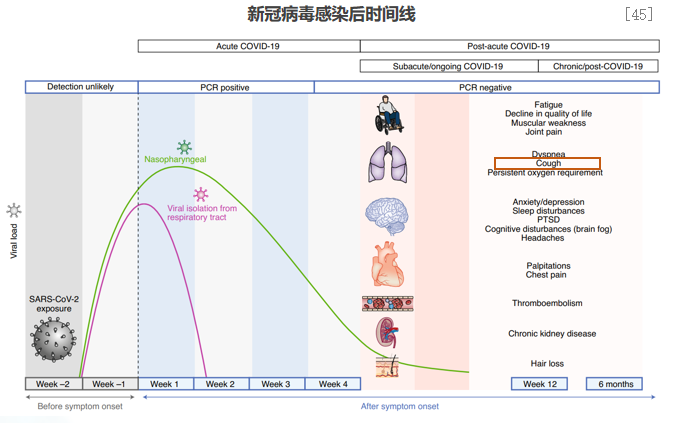
以新冠病毒感染为例,新冠病毒感染后,鼻咽部的病毒可长时间存在超过4周以上。病毒的存在,可持续性产生气道上皮损伤和气道炎症、持续刺激迷走神经产生神经源性炎症,从而产生咳嗽高敏感性。咳嗽症状可持续12周,甚至6个月以上。呼吸道病毒在人体长期留存,正是呼吸道感染后为何持续咳嗽的原因。[45]
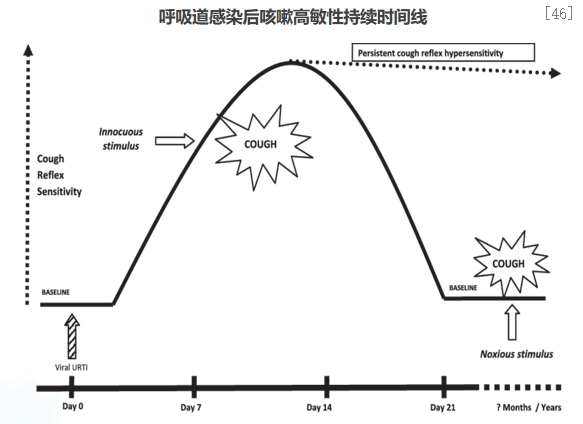
多种因素可导致咳嗽高敏感性持续存在。病毒感染后,咳嗽反射过度反应,咳嗽高敏感性会在一段时间内(2-3周)持续激活。在此期间内,多种无害刺激(如,气味、气溶胶、气温和环境变化等)也可以引起咳嗽。通常咳嗽高敏感性在持续3周后,多数患者中会发生下降,咳嗽反射反应恢复到基线状态。某些情况下,咳嗽高敏感性可持续很长时间,导致慢性咳嗽状态。包括:吸烟、哮喘、慢性阻塞性肺疾病(COPD)、胃食管返流(GORD)、血管紧张素转化酶抑制剂(ACEI)治疗、过敏等。因此,咳嗽高敏感性持续存在,也是呼吸道感染后为何持续咳嗽的原因。[46]
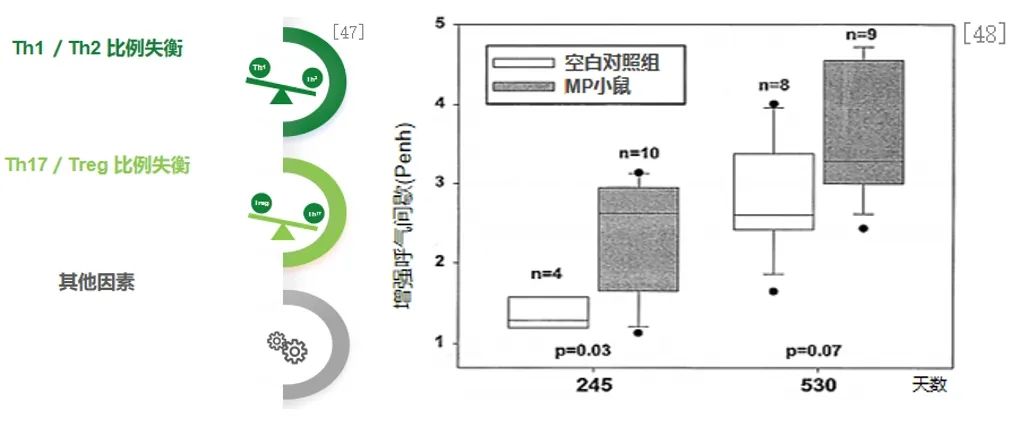
炎症长期存留,刺激气道高反应性同样也是呼吸道感染后为何持续咳嗽的原因。左图展示了MP感染引起儿童气道高反应的可能机制。MP感染导致Th1 /Th2 比例失衡,使Th2细胞因子(如IL-4、IL-5、IL-6等)占主导优势,这些细胞因子同时在支气管哮喘中也有所表达。MP感染后引起的Notch通路异常及Th17/Treg比例的失衡均可通过其特殊的途径引起气道高反应性,参与哮喘的发生与发展过程。MP感染后TNF-ɑ水平明显增加,加重气道高反应性。MPP患儿VEGF水平比不伴喘息症状者显著增加,VEGF在气道高反应性的发生过程至关重要。MPP发生后引起的ICAM-1表达量的增加也会引起气道高反应性。[47]
右图体积描记法结果显示:MP小鼠在第245天时,气道高反应性显著高于对照组(P=0.03),在 530 天时有气道高反应性增加的趋势 (P=0.07)。在BALB/c小鼠鼻腔接种MP一次,分别于接种后109、150、245、368和530天取样,530天后,78%的MP小鼠表现出异常的组织病理学,其特征是支气管周围和血管周围的单核细胞浸润。基础实验可能提示我们,对于某些患者或者是某些人群当中,有时候支原体感染的确可以在机体内长期存在,当机体免疫力降低、疲劳,亦可以再次诱发感染。[48]
儿童感染后持续咳嗽的治疗困境,需要规范病因诊断及针对病因进行治疗
儿童呼吸道感染后持续咳嗽的诊疗存在一定困境,儿童呼吸道感染后咳嗽的病因与成人不同,儿童处于动态的生长发育之中,免疫防御也未发展完全,容易发生呼吸道感染,且感染后引发咳嗽的病因也与成人不同,且可随年龄增长而有所变化。同时,儿童呼吸道感染后咳嗽的病因需要详细地评估:1、咳嗽是门诊常见主诉,其病因众多且涉及面广泛,同时是部分危重疾病的潜在信号,因此咳嗽的诊断是重大挑战;2、需要通过病史采集、体格检查、诊断性检查和治疗后随访等多种方法才能正确诊断,如果没有经过逐步地评估,容易导致误诊误治;3、呼吸道感染后咳嗽是滥用抗菌药物的重灾区。国内研究显示,91.58%的咳嗽患者曾使用过抗菌药物。[4、9、21、34]
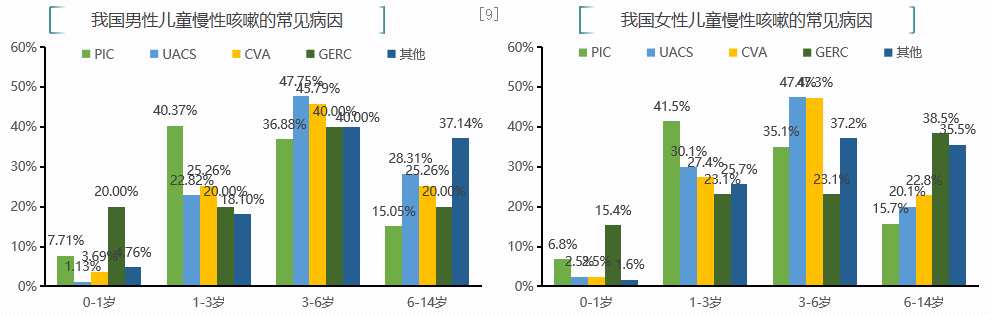
一项全国性调研,纳入全国29家医院4529例慢性咳嗽患儿,分析导致慢性咳嗽的病因构成。这项全国多中心调研显示,儿童慢性咳嗽常见病因依次为 CVA、 UACS 和PIC。因此,应重视不同年龄段儿童慢性咳嗽病因的差异:<6 岁儿童慢性咳嗽病因常见的是 PIC,≥6岁儿童的病因则以UACS和CVA为主,心因性咳嗽或多病因性咳嗽的比例随年龄增长逐渐增加。因此,儿童呼吸道感染后引发咳嗽的病因与成人不同,且可随年龄变化。[9]

同样这份研究显示,慢性咳嗽患儿PIC和CVA临床首诊时难以识别。值得注意的是,有时单纯依靠感冒或上呼吸道感染的病史和咳嗽症状诊断PIC可能会造成EB、CVA的漏诊,一些所谓“顽固性PIC”实际上有可能为EB、CVA和GERC。说明儿童呼吸道感染后咳嗽的误诊率高,不可简单归于PIC。[9、14]
因此,临床需强化儿童呼吸道感染后咳嗽的病因诊断和评估。儿童呼吸道感染后咳嗽应尽可能明确病因,以便针对病因进行治疗。病史采集:重视病史,包括耳鼻喉和消化系统检查;需要关注患儿年龄、咳嗽持续时间、痰量及痰液颜色、咳嗽诱发因素、咳嗽时相、咳嗽性质、伴随症状、用药史等;还需关注既往有无反复呼吸道感染、有无喘息病史、有无过敏性史等。体格检查:根据病史选择有关检查, 由简单到复杂, 先常见病, 后少见;检查范围包括体型、鼻、咽、喉、气管和肺部等;还需评估患儿生长发育情况。诊断性检查:根据病史选择有关检查, 由简单到复杂, 先常见病, 后少见病;推荐胸部X线、肺通气功能检查、支气管激发试验和诱导痰细胞学检查作为一线检查;食管反流监测、支气管镜、鼻咽镜等检查作为二线检查。经验性治疗及诊断性治疗:诊断和治疗应同步或顺序进行;检查条件不具备时,可以根据临床特征进行诊断性治疗;根据治疗反应确定咳嗽病因,治疗无效时应评估是否诊断错误,再选择有关检查。[7、21]
在确定咳嗽病因方面,诊断性检查发挥着关键作用。临床实践中,应根据病史、体格检查和病因分布特点,有针对性地选择相关检查,形成由简至繁、先鉴别重病、常见病,后再考虑罕见病的诊疗思维。胸部影像学检查方面,胸部X线片被推荐作为慢性咳嗽患儿的首选评估方法(1B);若胸部X线片无法明确病因,或慢性湿性咳嗽患儿出现特异体征(如杵状指/趾)或高度怀疑气道异物吸入,建议实施胸部CT检查(2B);肺通气检测方面,针对6岁及以上的慢性咳嗽患儿,建议常规开展肺通气功能检查(1B)。呼出气一氧化氮(FeNO)检测,针对疑似慢性咳嗽伴哮喘(CVA)的患儿,建议采用FeNO检测辅助诊断(2C);过敏原检查方面,不推荐慢性咳嗽患儿常规进行过敏原检查;针对怀疑与过敏相关的慢性咳嗽患儿,建议进行过敏原检查(1C);支气管镜检查方面,若非侵入性常规检查无法明确慢性咳嗽病因,或高度怀疑气道发育异常、气道阻塞或异物等情况,建议根据病史及医生意见判断是否需进行支气管镜检查(2C)。[4、7]

经验性治疗与诊断性治疗有助于揭示咳嗽的病因。首先,应根据病史推测可能的慢性咳嗽病因,并实施相应的经验性治疗。当病史、体格检查和诊断性检查无法明确咳嗽病因,或基层检查条件不足时,可根据患儿的临床特征实施诊断性治疗,并根据治疗反应确定咳嗽病因。治疗有效性是明确病因的基础。若治疗有效,表明原诊断成立。若治疗部分有效但未完全缓解,应评估影响疗效的因素,以及是否存在其他慢性咳嗽的混合病因,如上气道咳嗽综合症(UACS)伴胃食管反流性咳嗽(GERC)、咳嗽变异性哮喘(CVA)或嗜酸性支气管炎(EB),GERC伴EB或CVA等。若治疗无效,应评估是否诊断错误、治疗强度和时间是否充足,以及是否存在影响疗效的因素,然后选择相关检查以鉴别诊断病因。针对多次经验性治疗无效的患儿,应及时转诊并进行进一步检查,以明确病因诊断。[4、31]
在儿童出现急性呼吸道感染并伴有咳嗽(持续时间≤4周)的情况下,需密切关注危险征象,并合理进行相应治疗。如何识别严重咳嗽及具有危险征象的病例呢?例如,急性喉炎(喉部梗阻)、肺炎(包括新型冠状病毒肺炎等)、哮喘发作、异物吸入等,需紧急处理,并及时转诊至相关科室进行治疗。同时,需牢记合理运用药物治疗的重要性。在急性咳嗽的治疗中,抗菌药物、祛痰药、镇咳药、支气管舒张剂等并不推荐常规使用。然而,在特定情况下,如下述情况可考虑使用:当急性咳嗽病程延长或症状加重,怀疑合并细菌感染时,可经验性采用抗菌药物治疗。对于湿性咳嗽或痰液阻塞的患儿,可根据实际情况考虑使用祛痰药。对于变应性鼻炎引起的上气道咳嗽综合症(UACS)患儿,可应用抗组胺药及减充血剂进行治疗。疑似咳嗽变异性哮喘(CVA)的患儿,可进行诊断性治疗(1B);确诊CVA患儿,应采用吸入性糖皮质激素(ICS)或ICS与长效β2受体激动剂(LABA)的联合治疗,严重者可加用白三烯受体拮抗剂。[4、31]
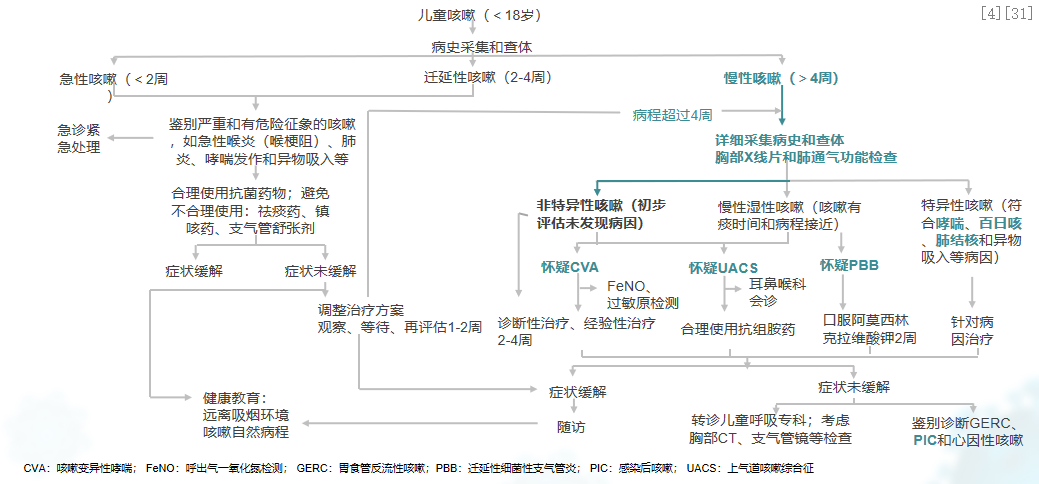
儿童呼吸道感染后急性咳嗽 (≤4周):需强化病因诊断,并针对性治疗。[4、31]
在怀疑PIC的治疗中,经验治疗与明确病因相结合至关重要。首先经验治疗,如果咳嗽继发于先前的呼吸道感染。未见X线胸片异常,表现为刺激性干咳或咳少量白痰。镇咳药:外周镇咳药物疗效差,不建议选用。咳嗽症状明显者建议选用中枢性镇咳药物,如可待因、右美沙芬、海罂粟碱等;抗组胺药及减充血剂:咳嗽症状明显的患者建议短期应用。指南指出,复方甲氧那明治疗有一定效果(2C);抗菌药物:不建议常规使用;但对于肺炎支原体、肺炎衣原体、百日咳造成的感染后咳嗽,应及早应用大环内酯类抗生素;糖皮质激素:顽固性重症感冒后咳嗽患者,在一般治疗无效时,可短期使用糖皮质激素治疗;白三烯受体拮抗剂:临床上广泛使用 ,孟鲁斯特最为常见。然而临床治疗研究结果并不统一,联合用药可能具有一定效果。如果经验性治疗无效者,考虑其他病因。单纯依靠感冒或上呼吸道感染的病史和咳嗽症状诊断,可能会造成CVA,EB的漏诊。对于按PIC常规治疗无效者,建议有条件时应进行支气管激发试验、诱导痰细胞学检查等,或进行其他病因的经验性治疗。若明确病因,则针对病因进行治疗。若可明确呼吸道感染的病原体,如新冠病毒、流感病毒、百日咳、肺炎支原体 、肺炎衣原体、肺结核等,可进行针对性治疗。[4、31]
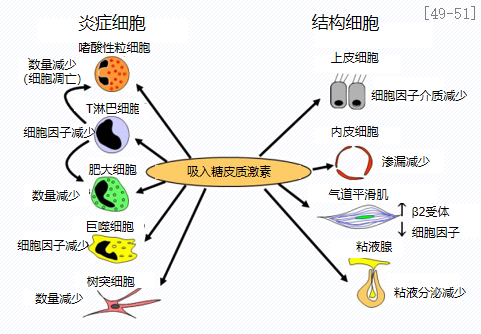
面对哮喘儿童呼吸道感染引发的急性发作该如何处理呢?首先,ICS抑制气道炎症,保护气道上皮,可用于哮喘患儿。哮喘儿童在呼吸道病毒感染时考虑间歇性给予高剂量ICS短期治疗,可减少间歇性病毒感染触发的喘息急性发作。在病毒感染或季节性变应原暴露期间,需要短期升级治疗,增加维持ICS剂量1-2周。在急性呼吸道感染初期或出现与哮喘相关的先兆征象时,对未使用每日控制治疗的哮喘儿童短程使用强化控制药物治疗,或在原有控制治疗的基础上短时增加控制药物剂量,以预防哮喘发作。哮喘患儿出现喷嚏、流涕等鼻部症状和明显咳嗽先兆征象时,尽早给予吸入高剂量ICS进行预先干预,可有效预防可能哮喘急性发作。[49-51]
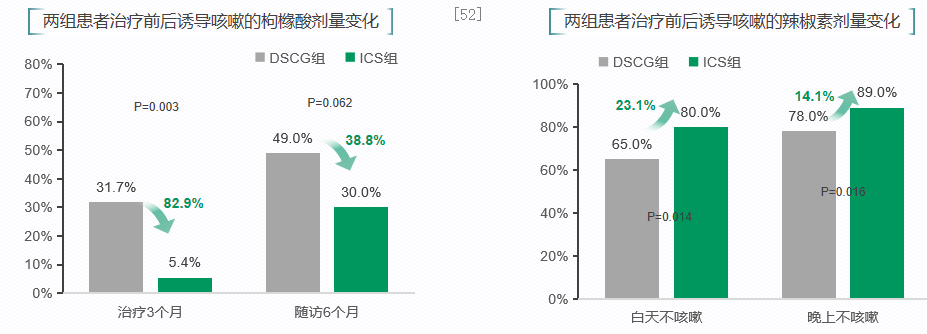
一项前瞻性,随机对照研究纳入82名哮喘儿童(6-36个月),随机接受雾化ICS和色甘酸二钠治疗3个月,随访6个月,比较雾化ICS和DSCG对36个月以下哮喘儿童的有效性。研究显示,与雾化吸入色甘酸二钠(DSCG)相比,雾化吸入ICS)组患儿的急性发作率更低,无咳嗽症状天数更多。因此,ICS可有效减少哮喘患儿急性发作和咳嗽症状。[52]
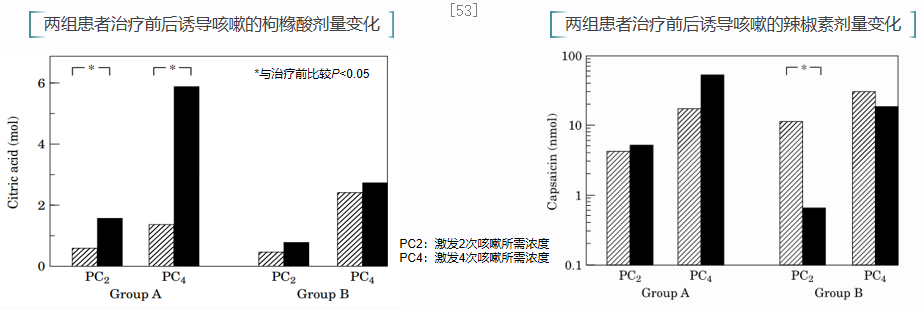
一项前瞻性对照研究评估了ICS对哮喘患者咳嗽敏感性的影响,共纳入36例哮喘患者,A组使用ICS+沙美特罗治疗,B组使用安慰剂+沙美特罗治疗,分别与入组时和治疗1个月后使用辣椒素和枸橼酸进行咳嗽激发试验,分析咳嗽敏感性变化。研究显示,哮喘患者使用ICS治疗1个月后,咳嗽激发试验所需激发物浓度显著升高,表示咳嗽敏感性降低。因此,ICS治疗可显著降低哮喘患者的咳嗽高敏感性。[53]
怀疑UACS该如何处理呢?首先确定患者有鼻炎、鼻窦炎或咽喉疾病的临床表现、病史等,同时开展诊断性治疗+经验性治疗,使用鼻用激素、抗组胺药、抗菌药物、祛痰药等进行经验性和诊断性治疗,同时进行鼻腔冲洗等。辅助检查推荐开展鼻窦CT、鼻腔镜检、鼻咽镜检查等,判断是否支气管扩张症、支气管发育异常等。确定病因后再进行对因治疗。慢性鼻窦炎:建议抗菌药物≥2周+鼻腔吸入鼻用糖皮质激素≥3个月;变应性鼻炎:推荐口服第2代抗组胺药;普通通感冒:推荐口服抗组胺药和减充血剂。如果未确定病因,则选择对症治疗。鼻用减充血剂、祛痰药、生理盐水等对症治疗。若症状未缓解,需考虑其他病因,如支气管扩张症等;进行FeNO检测、支气管镜检等;转诊至儿童呼吸专科。因此,怀疑UACS的治疗原则是鼻用激素/抗组胺药等经验性治疗+辅助检查。[4、31]
怀疑PBB该如何处理呢?首先确定患者又湿性(有痰)咳嗽持续>4 周,有下呼吸道感染病史或证据。采取抗菌药物经验治疗,首选口服阿莫西林-克拉维酸钾(7:1-14:1)25-30 mg/(kg·次),每12小时1次,疗程至少2周(阿莫西林最大剂量不超过2g/d)(1C)。同时微生物培养明确抗菌药物使用指征。抗菌药物使用指征:下呼吸道标本病原体培养阳性,且菌落计数≥104菌落形成单位/ml 时,称为“基于微生物学诊断的PBB”。鉴别诊断:PIC、GERC和心因性咳嗽等。确定病因后对因治疗,根据药敏试验选择敏感抗菌药物治疗。CSLD:轻中度可口服阿莫西林或阿莫西林-克拉维酸,中重度者可静脉给予头孢噻肟或头孢曲松,也可选择哌拉西林-他唑巴坦或替卡西林-克拉维酸,给药至少2周。若未确定病因则对症治疗,口服或雾化吸入祛痰药,持续5-7d。若症状仍未缓解,考虑其他病因,进行胸部CT、支气管镜检等;转诊至儿童呼吸专科。因此,怀疑PBB应遵循“明确抗菌药物使用指征+辅助检查”的原则。[52]
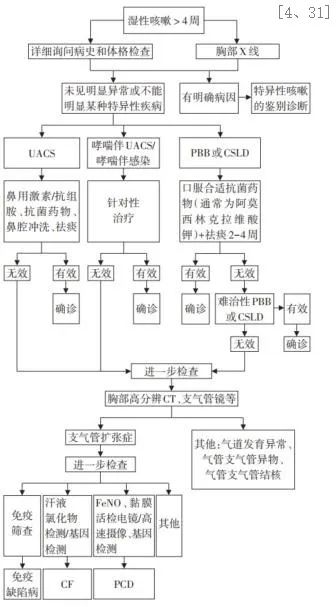
如果是儿童CSLD诊治步骤又该如何?如果患者反复发作湿性咳嗽(每次>4周,1年内>3次),伴或不伴有其他症状,如活动后呼吸困难、气道高反应症状、生长困难、杵状指(趾)、胸廓畸形、肺部湿啰音、肺过度充气等。首先,影像学上无BE症表现是儿童CSLD诊断的必要条件。PBB、CSLD 和BE症三者均以慢性湿性咳嗽为主要临床表现,区别在于症状和体征的严重程度、对2-4周口服抗菌药物的治疗反应、以及高分辨CT的表现。提出儿童CSLD的概念,有助于对儿童BE症的早期识别及干预,对改善预后至关重要。治疗方面,首先是病因治疗:予以抗菌药物治疗,PBB患儿可优先选择7:1阿莫西林-克拉维酸制剂或第2代以上头孢菌素或阿奇霉素等口服,通常疗程需2-4周。轻中度的CSLD患儿可口服阿莫西林或阿莫西林-克拉维酸,中重度者可静脉给予头孢噻肟或头孢曲松,也可选择哌拉西林-他唑巴坦或替卡西林-克拉维酸。一旦获得细菌培养结果,要根据药敏试验选择敏感抗菌药物治疗;一般建议CSLD给药至少2周。对症治疗可口服氨溴特罗或氨溴索5-7d或雾化吸入黏液溶解剂NAC 0.3g/次,每天1-2次,持续5-7d。[4、31]
此外,反复呼吸道感染引发持续咳嗽的患儿建议使用免疫调节剂。免疫调节剂可增强机体对多种病原的防御,主要是提供非特异性的免疫调节,这意味着固有免疫和适应性免疫中免疫应答的更普遍变化,从而导致宿主对许多不同抗原的反应性发生改变。免疫调节剂有四大优点:1、避免出现耐药性。它不直接影响微生物,因此可以避免耐药性快速出现的问题;2、对抗多种病原体。免疫调节剂可提供针对细菌、病毒和真菌疾病的广谱预防反复感染能力,出现罕见病原体时提供非特异性的紧急治疗方案;3、提升自身免疫。与疫苗协同使用增强或调节患者的固有免疫应答。非特异性诱导人体进入“预警”状态,增强整体免疫应答水平;4、提供有效预防。对于反复呼吸道感染,预防策略是临床管理的基石,因为预防能减少感染的反复发作。通过防止后续的感染,对患者的长期预后产生有益的影响。[54、55]
参考文献
1. Mitra A, Hannay D, Kapur A, et al. The natural history of acute upper respiratory tract infections in children[J]. Primary Health Care Research & Development, 2011, 12(04): 329-334.
2. Kantar A. Phenotypic presentation of chronic cough in children[J]. J Thorac Dis, 2017, 9(4): 907-913. DOI:10.21037/jtd.2017.03.53
3. Campos C, Prokopich S, Loewen H, et al. Long-Term Effect of COVID-19 on Lung Imaging and Function, Cardiorespiratory Symptoms, Fatigue, Exercise Capacity, and Functional Capacity in Children and Adolescents: A Systematic Review and Meta-Analysis. Healthcare (Basel). 2022;10(12):2492.
4. 中华医学会儿科学分会临床药理学组, 国家儿童健康与疾病临床医学研究中心, 中华医学会儿科学分会呼吸学组, et al. 中国儿童咳嗽诊断与治疗临床实践指南(2021版)[J]. 中华儿科杂志, 2021, 59(9): 720-729. doi:10.3760/cma.j.cn112140-20210513-00423.
5. 中国医师协会儿科医师分会儿童呼吸学组, 中华医学会儿科学分会儿科呼吸学组儿童慢性咳嗽协作组, 《中国实用儿科杂志》编辑委员会. 儿童祛痰止咳治疗专家共识[J]. 中国实用儿科杂志, 2022, 37(8): 567-574. doi:10.19538/j.ek2022080602.
6. Thompson M, Vodicka T A, Blair P S, et al. Duration of symptoms of respiratory tract infections in children: systematic review[J]. Bmj, 2013, 347: f7027.
7. 中华医学会儿科学分会呼吸学组慢性咳嗽协作组, 《中国实用儿科杂志》编辑委员会. 中国儿童慢性湿性咳嗽的诊断与治疗专家共识 (2019年版)[J]. 中国实用儿科杂志, 2019, 34(4): 256-264.
8. 李雨含, 苏松, 刘俊荣, et al. 儿童慢性咳嗽的病因构成比变化趋势研究进展[J]. 国际儿科学杂志, 2023, 50(9): 630-633. doi:10.3760/cma.j.issn.1673-4408.2023.09.012.
9. 中国儿童慢性咳嗽病因构成比研究协作组. 中国儿童慢性咳嗽病因构成比多中心研究[J]. 中华儿科杂志, 2012, 50(2): 83-92. doi:10.3760/cma.j.issn.0578-1310.2012.02.002.
10. Cash H, et al. JAMA Otolaryngol Head Neck Surg. 2015,141(5): 417-23
11. 陆权,等. 中华儿科杂志, 2012, 50(2):83-92
12. 中华医学会儿科呼吸学组.中华儿科杂志,2014,52(3):1-5
13. Braman SS, et al. Chest, 2006, 129 (1 suppl) :138S–46S
14. 中华医学会呼吸病学分会哮喘学组. 咳嗽的诊断与治疗指南(2021)[J]. 中华结核和呼吸杂志, 2022, 45(1): 34.
15. 赖克方, 聂怡初. 感染后咳嗽发病机制、诊断与治疗研究进展[J]. 中华肺部疾病杂志(电子版), 2014, 7(5): 1-5. doi:10.3877/cma.j.issn.1674-6902.2014.05.001.
16. Juhn Y J. Risks for infection in patients with asthma (or other atopic conditions): is asthma more than a chronic airway disease?[J]. The Journal of allergy and clinical immunology, 2014, 134(2): 247-259.
17. 中华医学会呼吸病学分会哮喘学组. 支气管哮喘防治指南(2020年版)[J]. 中华结核和呼吸杂志, 2020, 43(12): 1023-1048. doi:10.3760/cma.j.cn112147-20200618-00721.
18. Lai K, Satia I, Song W-J, et al. Cough and cough hypersensitivity as treatable traits of asthma[J]. The Lancet Respiratory Medicine, 2023, 11(7): 650-662. doi:10.1016/S2213-2600(23)00187-X.
19. Shimizu T, Mochizuki H, Morikawa A. Effect of influenza A virus infection on acid-induced cough response in children with asthma[J]. Eur Respir J, 1997, 10(1): 71-4. doi:10.1183/09031936.97.10010071.
20. Matsumoto H, Niimi A, Takemura M, et al. Prognosis of cough variant asthma: a retrospective analysis[J]. J Asthma, 2006, 43(2): 131-5. doi:10.1080/02770900500498477.
21. 赖克方. 中国慢性咳嗽研究从国内走向国际[J]. 国际呼吸杂志, 2023, 43(8): 869-874. doi:10.3760/cma.j.cn131368-20230516-00300.
22. Kloepfer KM, Olenec JP, Lee WM, Liu G, Vrtis RF, Roberg KA, Evans MD, Gangnon RE, Lemanske RF Jr, Gern JE. Increased H1N1 infection rate in children with asthma. Am J Respir Crit Care Med. 2012 Jun 15;185(12):1275-9.
23. 彭健, 黄荣宁. 儿童支气管哮喘与肺炎支原体感染的关系[J]. 实用儿科临床杂志, 2007, 22(10): 761,779.
24. 张亦南, 王涛, 刘德行, 等. 慢性咳嗽的研究进展[J]. 中华结核和呼吸杂志, 2021, 44(7): 645-650.
25. O’grady K-a F, Drescher B J, Goyal V, et al. Chronic cough postacute respiratory illness in children: a cohort study[J]. Archives of Disease in Childhood, 2017, 102(11): 1044-1048. doi:10.1136/archdischild-2017-312848.
26. Newcombe PA, Sheffield JK, Petsky HL, et al. A child chronic cough-specific quality of life measure: development and validation. Thorax. 2016;71(8):695-700.
27. Waring G, Kirk S, Fallon D. The impact of chronic non-specific cough on children and their families: A narrative literature review. J Child Health Care. 2020;24(1):143-160.
28. Lai K, Long L. Current Status and Future Directions of Chronic Cough in China[J]. Lung, 2020, 198(1): 23-29. doi:10.1007/s00408-019-00319-z..
29. Marchant J M, Newcombe P A, Juniper E F, et al. What is the burden of chronic cough for families?[J]. Chest, 2008, 134(2): 303-309. doi:10.1378/chest.07-2236.
30. 梁瀚文,易芳,陈玥晗,等. 中国慢性咳嗽流行病学调查的现状与展望[J]. 中华结核和呼吸杂志,2022,45(1):100-106.
31. 中华医学会呼吸病学分会哮喘学组. 咳嗽的诊断与治疗指南(2021)[J]. 中华结核和呼吸杂志,2022,45(1):13-46
32. Georgountzou A, Papadopoulos N G. Postnatal innate immune development: from birth to adulthood[J]. Frontiers in immunology, 2017, 8: 957.
33. Trends Immunol, 2014, 35(7): 299-310.
34. 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 人民卫生出版社, 2002.
35. Naqvi K F, Mazzone S B, Shiloh M U. Infectious and Inflammatory Pathways to Cough[J]. Annu Rev Physiol, 2022. DOI:10.1146/annurev-physiol-031422-092315
36. 叶新民, 刘春丽, 钟南山, et al. 感染后咳嗽及其神经源性炎症机制研究进展[J]. 中华哮喘杂志(电子版), 2010
37. 李凤英, 邓政. 病毒感染后咳嗽发病机制的研究进展[J]. 中华结核和呼吸杂志, 2022, 45(2): 5
38. Vareille M, Kieninger E, Edwards M R, et al. The airway epithelium: soldier in the fight against respiratory viruses[J]. Clinical microbiology reviews, 2011, 24(1): 210-229.
39. Bridges J P, Vladar E K, Huang H, et al. Respiratory epithelial cell responses to SARS-CoV-2 in COVID-19[J]. Thorax, 2022, 77(2): 203-209.
40. Song W-J, Hui C K, Hull J H, et al. Confronting COVID-19-associated cough and the post-COVID syndrome: role of viral neurotropism, neuroinflammation, and neuroimmune responses[J]. The Lancet Respiratory Medicine, 2021, 9(5): 533-544.
41. Dawre S, Maru S. Human respiratory viral infections: Current status and future prospects of nanotechnology-based approaches for prophylaxis and treatment[J]. Life Sci, 2021, 278: 119561. doi:10.1016/j.lfs.2021.119561.
42. Kim Y C, Song W J. Neuro-Immune Interactions and IFN-gamma in Post-Infectious Cough[J]. Allergy Asthma Immunol Res, 2022, 14(6): 581-584.
43. Deng Z, Zhou W, Sun J, et al. IFN-γ Enhances the Cough Reflex Sensitivity via Calcium Influx in Vagal Sensory Neurons[J]. American Journal of Respiratory and Critical Care Medicine, 2018, 198(7): 868-879.
44. Chen F, Yu M, Zhong Y, et al. The role of neutrophils in asthma[J]. Zhejiang Da Xue Xue Bao Yi Xue Ban, 2021, 50(1): 123-130. doi:10.3724/zdxbyxb-2021-0030.
45. Nalbandian A, Sehgal K, Gupta A, et al. Post-acute COVID-19 syndrome[J]. Nat Med, 2021, 27(4): 601-615. doi:10.1038/s41591-021-01283-z.
46. Mcgarvey L P, Elder J. Future directions in treating cough[J]. Otolaryngol Clin North Am, 2010, 43(1): 199-211, xii. doi:10.1016/j.otc.2009.11.011.
47. 那颖,于少飞. 肺炎支原体感染引起儿童气道高反应性的研究进展[J]. 内蒙古医学杂志,2022,54(7):836-839,843. DOI:10.16096/J.cnki.nmgyxzz.2022.54.07.019.
48. Hardy RD, Jafri HS, Olsen K, Hatfield J, Iglehart J, Rogers BB, Patel P, Cassell G, McCracken GH, Ramilo O. Mycoplasma pneumoniae induces chronic respiratory infection, airway hyperreactivity, and pulmonary inflammation: a murine model of infection-associated chronic reactive airway disease. Infect Immun. 2002 Feb;70(2):649-54. doi: 10.1128/IAI.70.2.649-654.2002.
49. Barnes P J. Inhaled Corticosteroids[J]. Pharmaceuticals (Basel), 2010, 3(3): 514-540. doi:10.3390/ph3030514.
50. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention (updated 2023)[EB/OL]. (May 2023). [2023-05-09]. https://ginasthma.org/wp-content/uploads/2023/05/GINA-2023-Full-Report-2023-WMS.pdf.
51. 中华儿科杂志编辑委员会, 中华医学会儿科学分会呼吸学组, 中国医师协会儿科医师分会儿童呼吸专业委员会. 儿童支气管哮喘规范化诊治建议(2020年版)[J]. 中华儿科杂志, 2020, 58(9): 708-717. doi:10.3760/cma.j.cn112140-20200604-00578.
52. 中华医学会, 中华医学会临床药学分会, 中华医学会杂志社, et al. 咳嗽基层合理用药指南[J]. 中华全科医师杂志, 2020, 19(7): 582-592. doi:10.3760/cma.j.cn114798-20200518-00586.
53. Di Franco A, Dente F L, Giannini D, et al. Effects of inhaled corticosteroids on cough threshold in patients with bronchial asthma[J]. Pulmonary pharmacology & therapeutics, 2001, 14(1): 35-40.
54. Dhama K, Saminathan M, Jacob S S, et al. Effect of immunomodulation and immunomodulatory agents on health with some bioactive principles, modes of action and potent biomedical applications[J]. International Journal of Pharmacology, 2015, 11(4): 253-290.
55. Schaad US, et al. Arch Pediatr Infect Dis. 2016 January;4(1):e31039.
专家介绍

陈德晖
广州医科大学附属第一医院儿科学科带头人、科主任、博士研究生导师;国家卫健委医政医管局儿科呼吸内镜专家组成员,中华医学会儿科分会呼吸学组儿童间质性肺疾病协助组副组长,中华医学会儿科分会呼吸学组支气管镜协助组委员,广东省医学会儿科分会副主任委员、呼吸学组组长,广东省胸部疾病学会儿科呼吸介入专业委员会主任委员;亚洲儿童呼吸介入学会理事,中国医师协会儿科呼吸内镜委员会副主任委员,中国医师协会儿科医师分会儿童内镜专业委员会委员;北京医学奖励基金会全国儿童过敏免疫风湿病医学研究发展基金会副主任委员;广东省医学会儿科分会儿童疑难罕见疾病学会副主任委员。
*审批编号CN-131085 过期日期2024-12-5
*本材料由阿斯利康提供,仅供医疗卫生专业人士进行医学科学交流,不用于推广目的
本文由《呼吸界》编辑 冬雪凝 整理
本文完
责编:Jerry


