
雾化吸入治疗在儿科应用得越来越广泛,尽管广泛使用,但是仍然存在一些问题。因此在此基础上,我们撰写了《儿童呼吸系统疾病雾化治疗合理应用专家共识》。今天我将主要对此进行解读。
雾化吸入疗法适用于全年龄段儿童,另外也适用于多种儿童呼吸系统疾病类型,最常用于支气管哮喘、喘息性疾病、变异性咳嗽、喉炎、喉气管炎、支气管扩张症和支气管肺发育不良等等中。在不同疾病中,我们使用的药物类型不同,稍后也会重点介绍。[1-3]
雾化之所以成为呼吸系统疾病的重要治疗方法,是因为它具有多重优势。例如雾化吸入药物直接作用于气道,起效迅速;局部药物浓度高,疗效佳;用药量小,全身不良反应少;药物剂量调节方便;另外,对于一些年龄较小的患儿,无法像成人一样配合,雾化吸入疗法潮式呼吸即可,无需患者刻意配合,且使用方便,无需特别学习,在家中或医院都可以使用;还可以同时辅助供氧、更容易实现联合药物治疗。[4]
虽然雾化疗法非常重要,并且也广泛应用,然而,当前雾化吸入疗法的临床规范应用亟待提升,但许多调查显示:1、雾化吸入疗法和装置认知不足,一项全国范围内关于雾化治疗临床实践的问卷调研显示,72.1%的医护人员对如何正确使用雾化装置的相关知识缺乏;2、雾化用药的选择和应用不明确,一项回顾性分析调研显示,仅30.5%的护师熟悉雾化吸入药物的选择;3、儿童雾化的适应症和应用不规范,一项对某医院儿科门诊糖皮质激素类药物应用的调查显示,适应证不适宜在不合理用药处方中占比高达61.48%。[5-7]
这些数据提示我们,如此广泛使用的疗法仍存在许多问题,在这种前提下,《儿童呼吸系统疾病雾化治疗合理应用专家共识》2022年在《中华儿科杂志》发表。共识面向问题、贴近临床,主要包括几个方面,第一,雾化吸入疗法基础知识;第二,雾化吸入常用药物;第三,儿童雾化吸入临床应用。[8]
详细来说,雾化吸入疗法基础,包括雾化吸入疗法的作用机制、呼吸系统适合雾化给药的特点、雾化的工作模式和各自的特点、雾化机选择的主要参数指标、雾滴选择的原理以及药物雾化剂型效能的影响因素;雾化吸入常用药物部分,涉及药物的作用机制与临床使用要点,包括ICS、β2受体激动剂、毒蕈碱型受体阻滞剂、祛痰药、高渗盐水等未来雾化用,另外也包括药物的开发前景;儿童雾化吸入临床应用,包括儿童雾化的适应证、慢性肺疾病的雾化治疗进展、肺炎的雾化注意事项、雾化药物的联合使用原则、雾化药物的配置注意事项、雾化前儿童的准备工作、儿童雾化过程的注意事项。[8]
一、雾化吸入疗法和装置的基础介绍
Q:雾化吸入疗法的作用机制是什么?
雾化吸入疗法:指用专门装置将吸入药物分散成气溶胶形式,吸气时气溶胶随气流进入呼吸系统的给药方法,气溶胶通常为 0.01~10.00 μm,这是决定药物沉积在哪个部位、雾化治疗效应的主要因素之一。气溶胶粒径非常大,大于5μm,可能在口咽部、鼻腔沉积,或主要发生在大气道;0.5~5μm才能到达小气道,小于<0.5μm的粒径主要在末梢气道,部分在肺泡沉积。[9,10]
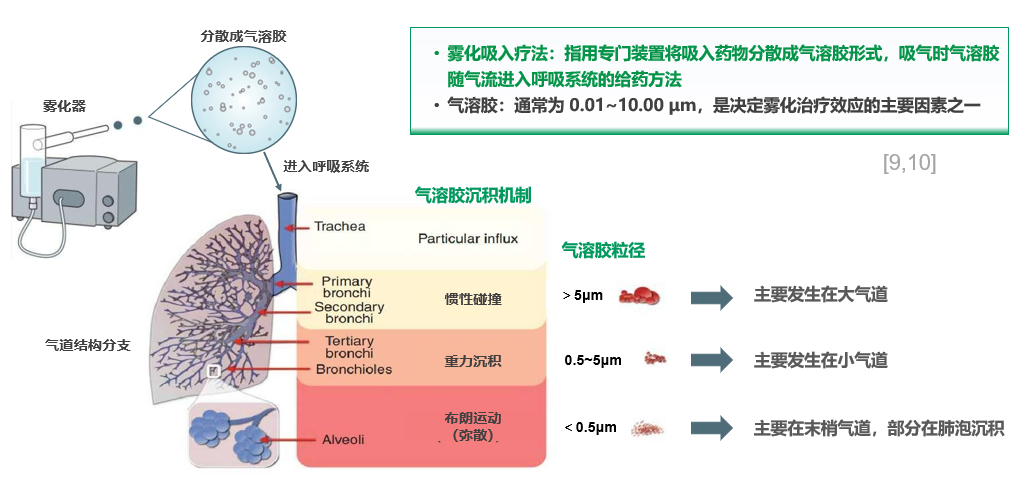
雾化吸入时的粒径大小主要依赖雾化装置/设备,是通过装置将液体变成气溶胶再进行吸入,因此这个装置非常重要;而且,雾化药物本身的理化性质、能否被黏液纤毛和巨噬细胞清除、亲脂性和亲水性等特点、沉降率以及药代动力学特点等存在相互作用,因此吸入装置/设备、吸入药物和患者特点这三方面均会对雾化吸入产生影响。[11]
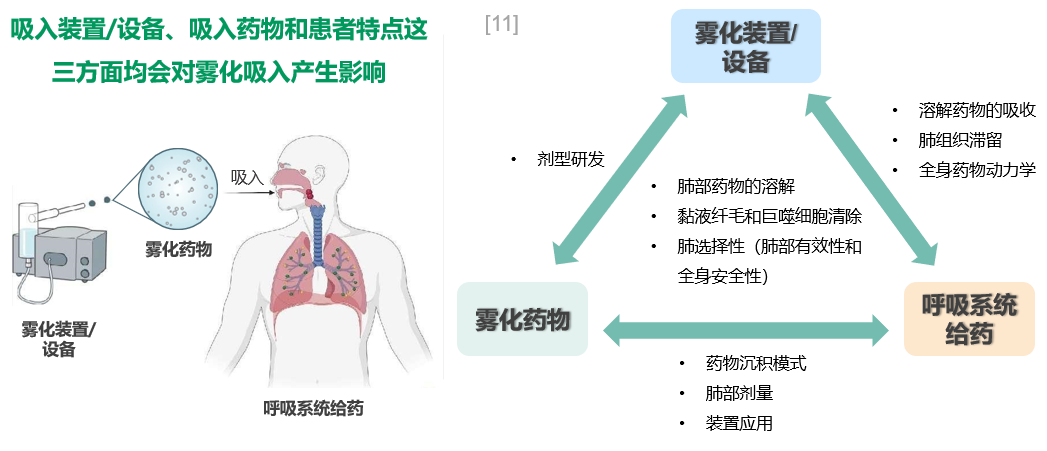
Q:呼吸系统适合雾化给药的特点有哪些?
首先,可供药物吸收面积大,成人的肺泡表面积为70-100平方米,婴儿只有3-4平方米,但也是体表面积的20倍。另外,肺泡壁非常薄,膜通透性高,吸收迅速,再有,局部浓度较高,起效时间短,生物率利用度较高。这种吸入也有一部分会经咽喉吞咽进入胃肠道吸收,但由于肝脏的首过消除效应,真正进入血液循环的量较小、全身不良反应小。[11,12]
Q:雾化的工作模式有哪几种?各自的特点是什么?
临床常用的雾化机有几种,包括是喷射雾化器、筛网雾化器、超声雾化器。[4]
喷射雾化器的主要作用机制是通过压缩空气或高速气流将负压吸出的药液撞击形成气溶胶,粒径能达到3~7 μm,一般来讲气体压力越高,流速越大,粒径越小,释雾量越大。但它也有一些缺点,由于体积大、噪声高,患儿听到声音害怕、不易配合,而且也不适用于某些容易降解的大分子药物。[4]
筛网雾化器主要是药液通过固定直径的微小筛孔形成气溶胶颗粒均匀释出,粒径:3~5 μm,也适合下气道的吸入,粒径大小取决于筛孔的直径和驱动力。它的优点在于噪声小、小巧轻便、可以倾斜使用(喷射雾化器往往要求患者在坐位,但一些病重的孩子往往处于卧位,因此有倾斜使用的需求)等,缺点在于筛网耐久性较低、易滋生微生物等。[4]
超声雾化器是若干年前特别常用的,超声在溶液中产生波动,通过振动网产生气溶胶并促进液体药物高效雾化成细颗粒,粒径4~10 μm主要利用超声波原理产生震动和物力。但普通超声雾化机产生的雾粒较大,而且由于其采用超声波,会影响药物活性,临床已很少使用,改良型开始进入临床。[4]
Q:雾化机选择的主要参数指标有哪些?
许多家长询问购买哪种雾化机,我们可以告诉他们关注影响雾化效能的主要因素,首先,雾粒直径应在0.5-10 μm,3-5μm为佳,取决于药物本身颗粒大小及雾化器的性能;其次单位时间释雾量,这取决于雾化器的性能,释雾量大能更有效发挥治疗效果,但药物短时间大量进入也可能导致不良反应增多,应综合评估。[4]
我们理想雾化吸入装置应该能产生出较小颗粒雾滴(一般要求直径<5 μm的颗粒达到 ≥60%),残留药量少、噪声低、轻巧便于携带。
我们目前常用的是喷射雾化器或筛网雾化器。喷射雾化器的气流量≥3.5L/min,压力20~150 kPa,喷雾速率0.1~0.8mL/min,残液量≤1mL,整机噪音≤65dB;等效体积粒径分布:1.0~5.0μm雾粒占比≥60%,中位粒径1~5μm,误差≤±25%。筛网雾化机的工作频率110kHz,误差≤±10%,喷雾速率0.1~0.8mL/min,雾化器药杯水温≤60℃,残液量≤1ml,整机噪声≤50 dB;等效体积粒径分布:1.0~5.0μm雾粒占比>50%,中位粒径1~5μm,误差≤±25%。[8]
Q:雾滴选择的原理是什么?
刚刚提到,药雾微粒的大小将影响呼吸系统疾病的治疗效果,药雾微粒直径与作用部位间的关系?如果大于10μm,药雾微粒就会在鼻咽部、口腔部沉积,基本无法进入大气道;雾粒>5.0 μm可达中央气道(气管和支气管),绝大多数在口咽部沉积,最终经吞咽进入体内;雾粒<0.5 μm能达到末梢气道(细支气管、肺泡),但90%微粒可随呼气排出体外;在很多呼吸疾病患者面前,我们希望药雾微粒能到达小气道,那么雾粒 1.0~5.0 μm较为适宜,可达中间气道及以下(支气管),故可广泛应用于呼吸系统疾病的雾化吸入治疗。
5-10μm主要沉积在大气道 ,很多疾病希望它进入小气道,因此需要在1微米到5微米的大小才能达到我们的需求。[12]
Q:药物雾化剂型效能的影响因素有哪些?
雾化吸入药物本身的理化特性和药理学特性是影响吸入药物效能的重要因素。
理化特性:
•pH值:3~10
•渗透压:285~310 mmol/L(近血浆渗透压),过高可致肺损伤,过低可致气道黏膜水肿
•颗粒大小:1.0~5.0 μm(最有可能沉积在肺部)
•其他:稳定,能被雾化器裂解为可吸入性气溶胶,辅料不影响黏膜或纤毛功能
药理特性:
•肺部滞留时间:受体亲和力(尽量高)、药物的酯化作用(酯化作用延长药物滞留时间)
•药物受体:受体肺内分布(尽量广)、受体亲和力(尽量高)
•肺组织吸收:沉积部位、药物的亲脂性/亲水性(最好都有)、相对分子量(尽量小)
•半衰期&清除率:肝脏首过代谢率(尽量高)、口咽部沉积量(尽量小)、血浆蛋白结合率(尽量低)
总之,雾化吸入药物的颗粒大小、肺部滞留时间、受体亲和力、生物利用度、半衰期以及清除率是影响其效能的主要因素。[11,13,14]
药物的颗粒大小影响雾化效能
以临床常用的ICS为例,布地奈德、丙酸倍氯米松和丙酸氟替卡松这三种药物的颗粒大小、形态特征存在差异,雾化效能有所不同,小于<0.5 μm的平均可吸入剂量更高[15](见下图)。
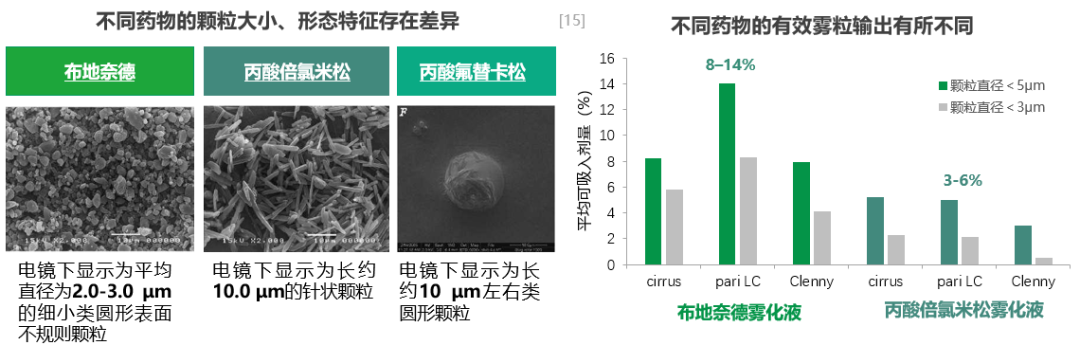
不同药物的可递送剂量及递送总量存在差异
复旦大学针对目前国内外3个厂家的布地奈德吸入制剂的递送速率、递送总量、空气动力学粒径分布、物理粒度、Calu-3 细胞药物累积转运量等指标参数进行测评,对产品质量的共性进行评价。研究数据表明,原研药的可递送剂量和递送总量显著高于仿制品,可能与其先进的生产工艺、规范的储藏运输等有关。[16]
药物的分子结构影响药动学/药效学特点
我们还是聚焦布地奈德(BUD)、丙酸倍氯米松(BDP) 、丙酸氟替卡松(FP)这三种雾化吸入激素,下图右表展示了分子结构的不同带来药动学/药效学特性的差别,包括受体亲和力、亲脂性、亲水性、蛋白结合率、生物利用度、清除率、分布容积、清除半衰期、酯化作用。布地奈德基本都适中,不过高、不过低,它还有一个特点是具有酯化作用,因此在气道里的滞留时间较长、作用时间较长。[17]
二、雾化吸入疗法的常用药物及其选择
最常用的是吸入性糖皮质激素(ICS),国内临床常用的ICS包括:布地奈德(BUD)、倍氯米松、氟替卡松等;其次是β2 肾上腺素能受体激动剂,包括短效β2受体激动剂(SABA):如特布他林、沙丁胺醇等、长效β2受体激动剂(LABA):如沙美特罗、福莫特罗等;还有祛痰药、毒蕈碱型受体阻滞剂。[8]
Q:吸入性糖皮质激素(ICS)作用机制是什么?
分为经典途径和非经典途径。[18,19]
经典途径:与细胞质中激素受体结合,启动基因转录后发挥抗炎作用,一般数小时起效。
非经典途径:与膜受体结合,数分钟内生效,但需大剂量激素。
−特异性非经典途径:与细胞膜表面不成熟的低亲和力受体结合(占10%~25%)
−非特异性非经典途径:溶入细胞各种脂质膜结构中,影响细胞能量代谢并稳定溶酶体膜
Q:ICS的临床使用要点是什么?
儿科临床如何使用ICS?哮喘急性发作期,大剂量ICS,配合支气管舒张剂,以快速控制哮喘症状,症状控制后要减低 ICS 剂量,长期大剂量吸入激素可能有不良反应;在慢性气道炎症性疾病,需要长期规范吸入ICS,以控制气道炎症,保护肺功能,现有文献支撑长期低剂量吸入激素是安全的,但需避免过度使用。[8]
Q:雾化用β2受体激动剂的作用机制和使用要点是什么?
β2受体激动剂刺激β2受体的信号转导,引发平滑肌松弛,短效β2受体激动剂(SABA)包括特布他林、沙丁胺醇,亲水性比较高,直接从细胞外液进入β2受体的活性部位,快速舒张支气管,但作用时间短,仅4~5h;长效β2受体激动剂(LABA)包括福莫特罗、沙美特罗,具有亲脂性,迅速进入细胞膜,再横向扩散接近β2受体的活性部位,所以过程缓慢,作用时间长。[8,20]
Q:雾化用毒蕈碱型受体阻滞剂的作用机制和使用要点是什么?
短效抗胆碱能药物(SAMA)包括异丙托溴铵、噻托溴铵,儿童哮喘急性发作时的对症治疗,SABA 加用异丙托溴铵治疗哮喘急性发作,在改善患儿肺功能、症状评分、减少住院次数等方面明显获益;SAMA 具有良好的有效性和安全性,尤其在单用 SABA 疗效不佳时,宜尽早与 SAMA 联合雾化吸入。[8,21]
Q:雾化用祛痰药的作用机制和使用要点是什么?
雾化祛痰药主要有两种,N-乙酰半胱氨酸(NAC)和氨溴索。
N-乙酰半胱氨酸分子结构中巯基可使黏蛋白分子间二硫键断裂,降低痰液黏度,儿童用药通常每天 1~2 次,持续 5~10 d,可根据情况调整;对于不能自主排痰的患儿,用药后体位引流或吸痰,排出分泌物;对于哮喘患儿,用药后应密切观察,如发生支气管痉挛应立即终止治疗,可与支气管舒张剂合用。
氨溴索主要是降低痰液黏稠度,刺激肺泡表面活性物质的合成与释放,增强气道纤毛的摆动,适用于伴有痰液分泌异常及排痰功能不良者,在儿童呼吸道感染中应用广泛且耐受性好,但也有诱发支气管痉挛的风险,哮喘患儿应慎用,吸入给药前建议使用支气管舒张剂。如果在家庭使用,一定要告知家长慎重观察。
高渗盐水也可以改变痰液黏性、重建气道表面液体层、刺激咳嗽、加快黏液清除,例如囊性纤维化(CF)患儿可使用7%高渗盐水,2次/d,如不能耐受,改为3%,对于毛细支气管炎住院患儿,不太主张使用高渗盐水,如需使用,应严密监测下用3%高渗盐水雾化,使用前可吸入支气管舒张剂,同时注意吸痰、保持呼吸道通畅。[8]
Q:雾化药物的联合使用原则是什么?
联合使用的原则:药物混合后能保证在同一雾化器中的相容性、稳定性,无理化性质的配伍禁忌;保证混合后药物治疗的安全性和有效性;药物混合后,储药池内总液量适宜。
联合使用的优势:多种药物同时雾化可以减少雾化的频率,提高效率;雾化次数减少能增加患儿的依从性;一些药物联合使用具有协同作用,提高治疗效果。
联合使用的注意事项:注意储药池的总液量充足,但不能超过雾化器储药池总量;喷射雾化器:3.0~4.0 ml,5~ 10 min 内输出;筛网式雾化器:0.3~2.0 ml,3~10 min 输出;总液量过少,可加用生理盐水;总液量过多,增加雾化时间。
联用时需考虑雾化药物的配伍相容性和稳定性
临床 使用时,需注意确定下表这些药物是否有专用的雾化吸入制剂。[8]
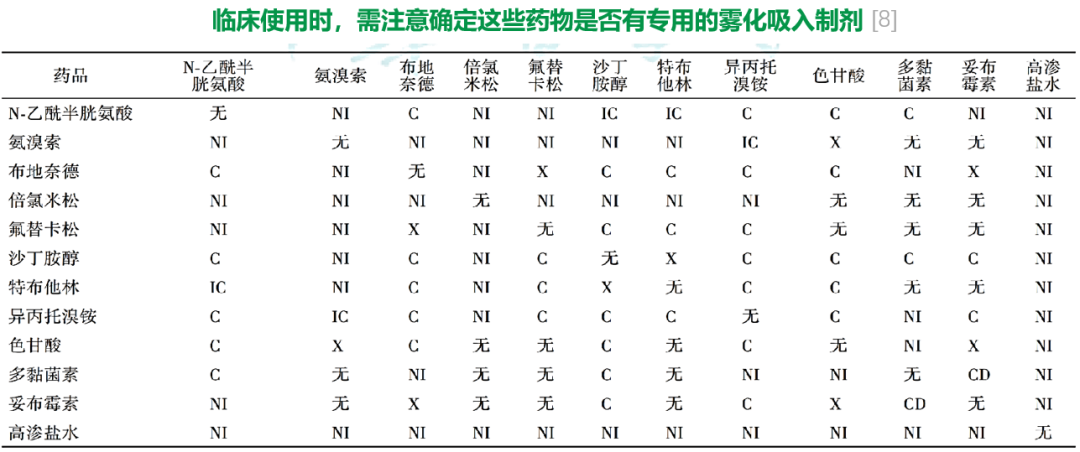
注:无为无证据;NI为评价配伍稳定性证据不充分,除非将来有证据证明可行;C为有临床研究确证特定混合物的稳定性和相容性;IC为来自生产厂家的报告确证特定混合物的稳定性和相容性;X为有证据确认或建议,特定混合物不能配伍;CD为配伍稳定性数据有争议
Q:雾化药物的配置注意事项有哪些?
当生理死腔体积保持不变时,药物的联合雾化增加药雾的输出,雾化药物的总输出质量和吸入质量都会上升。
雾化药物的联用和配置:ICS 和 SABA 有协同作用;SAMA 常和 SABA 联合应用;雾化吸入抗感染药物:多黏菌素和沙丁胺醇、乙酰半胱氨酸常混合使用,妥布霉素和异丙托溴铵、沙丁胺醇可联合使用;氨溴索雾化制剂:可与生理盐水 1:1 混合,与 SAMA 混合,不能与色甘酸钠混用。[8]

三、雾化吸入疗法在临床儿童疾病中的应用
Q:儿童雾化的适应证有哪些?
首先是过敏性气道炎症,如支气管哮喘,可用于支气管哮喘急性发作期和长期控制、咳嗽变异性哮喘、变应性咳嗽、嗜酸粒细胞性支气管炎;以及婴幼儿喘息,如毛细支气管炎、喘息性支气管炎;也可以在呼吸道感染性疾病中应用,如急性喉气管支气管炎、急性会厌炎、百日咳或类百日咳样综合征、肺炎,在使用雾化给药之前,往往是肌肉注射糖皮质激素或静脉给药,雾化吸入避免了这种全身给药。[8]
Q:慢性肺疾病的雾化有哪些推荐意见?
对于支气管肺发育不良,目前没有吸入治疗的一致意见,有学者建议符合某些条件者,可使用吸入性支气管舒张剂。
闭塞性细支气管炎方面,对于病情稳定的轻症患儿和重症患儿,可加强局部抗炎治疗;对于移植后闭塞性细支气管炎,单中心研究使用雾化环孢菌素取得了获益的初步证据。
支气管扩张症方面,黏液溶解剂及高渗剂:患儿每日症状严重、病情频繁发作、排痰困难、生活质量评分差,在耐受性良好的情况下可使用高渗盐水或甘露醇的吸入制剂;抗菌药物:目前指南不推荐常规使用,除非在极少数有慢性假单胞菌定植、频繁恶化的病例中使用。
囊性纤维化(CF)方面,有时会雾化吸入抗菌药物来预防和抑制慢性细菌感染。[8]
Q:雾化前儿童的准备工作有哪些?
1、治疗前30min避免患儿过度进食;吸入前清理口腔;
2、雾化治疗前需充分清除气道分泌物,呼吸道分泌物多时,先拍背咳痰,必要时吸痰;
3、雾化吸入治疗前需洗脸,不要涂抹油性面霜或膏以减少面部药物吸附;
4、正确组装管路、喷雾器及面罩(或咬嘴);新开启使用的雾化器应在使用前用空气吹3~5 min;
5、最好选择坐位以利于吸入药物沉积,不能采取坐位者应抬高头部并与胸部呈30°,婴幼儿可半坐卧位;
6、咬嘴型适合病情轻、中度的年长儿;面罩型适合不能正确掌握或不能配合使用咬嘴型雾化器的年幼儿或病情较重的年长儿。择密闭性较好的面罩可减少药物对面部及眼睛的刺激并增加气溶胶的输送量;
7、手持喷雾器要保持与地面垂直;雾化面罩要紧贴口鼻部避免漏气,幼儿烦躁时易使面罩移位;
8、刚开始时使雾化面罩离患儿6~7 cm,逐步减少到3 cm 左右,最后紧贴口鼻部;让患儿逐渐适应雾化液的温度,减轻冷空气对气道的刺激,减轻患儿的不适;
9、治疗最初阶段,部分儿童会很难把握正确的呼吸节律,导致眩晕或恶心,可以拿开喷雾器用鼻部轻松呼吸几次,待不适感觉消失后再继续治疗,此种方法也适用于在吸入过程中突然想要咳嗽的儿童。[8]
Q:儿童雾化过程的注意事项有哪些?
在治疗中、治疗后也需要关注一些问题,治疗中应按照医嘱将药液放入雾化吸入器内,观察出雾情况,注意避免药液进入眼内;应采用舒适的坐位或半卧位,用嘴深吸气、鼻呼气方式进行深呼吸,使药液充分达到支气管和肺部;密切关注患儿雾化吸入过程中潜在的不良反应:如出现急剧频繁咳嗽及喘息加重,应放缓雾化吸入的速度观察;出现手足抖动、震颤、肌肉痉挛等不适,应考虑 SABA 引起,一般停药后即可恢复;若出现呼吸急促或突然胸痛,应立即停止治疗并即刻处置。
雾化结束后,及时洗脸和漱口,以减少药物在脸部、口腔和咽部沉积,预防念珠菌感染;如年龄较小患儿不会漱口,用棉签或冷开水棉球擦拭,10 min 后让患儿喝水或喝奶;管路、喷雾器及面罩(或咬嘴)套装应该专人专用,避免交叉污染。每次使用后需进行清洁并干燥存放,以防受到污染,影响治疗;同时根据产品要求定期更换。[4]
总结
雾化吸入是儿童,尤其是学龄前儿童呼吸系统疾病中最常使用的治疗方法,它具有很多优点,但是也存在一些问题。
《雾化吸入疗法在呼吸疾病中的应用专家共识》就雾化吸入疗法过程中的常见问题达成共识,希望能够为儿童雾化吸入疗法的规范合理使用提供帮助,重点包括1、雾化吸入疗法和装置的基础(雾化吸入的作用机制和特点、雾化器的工作模式和特点、雾化器的选择原理和参数、影响雾化剂型效能的因素);2、雾化吸入疗法的常用药物及其选择(雾化吸入的常见药物如ICS、雾化用 β2受体激动剂、雾化用毒蕈碱型受体阻滞剂、雾化用祛痰药、高渗盐水等的作用机制和使用要点、雾化药物的联合使用原则、雾化药物的配置注意事项、未来雾化用药物的开发前景);3、雾化吸入疗法在临床儿童疾病中的应用(儿童雾化的适应证、慢性肺疾病的雾化治疗进展、肺炎的雾化注意事项、雾化前儿童的准备工作、儿童雾化过程的注意事项),只有充分注意这些事项,才能更好地进行儿童呼吸系统疾病雾化治疗。
参考文献
[1] Batchelor H K, Marriott J F. Paediatric pharmacokinetics: key considerations[J]. Br J Clin Pharmacol, 2015, 79(3): 395-404. doi:10.1111/bcp.12267.
[2]Ari A, Fink J B. Guidelines for aerosol devices in infants, children and adults: which to choose, why and how to achieve effective aerosol therapy[J]. Expert Review of Respiratory Medicine, 2011, 5(4): 561-572. doi:10.1586/ers.11.49.
[3]国家儿童医学中心(北京), 《中国实用儿科杂志》编辑委员会. 儿童常用雾化吸入药物处方审核建议[J]. 中国实用儿科杂志, 2020, 35(2): 81-87,136. doi:10.19538/j.ek2020020601.
[4]中华医学会呼吸病学分会《雾化吸入疗法在呼吸疾病中的应用专家共识》制定专家组. 雾化吸入疗法在呼吸疾病中的应用专家共识[J]. 中华医学杂志, 2016, 96(34): 2696-2708. doi:10.3760/cma.j.issn.0376-2491.2016.34.003.
[5]Zhu Z, Zheng J, Wu Z, et al. Clinical Practice of Nebulized Therapy in China: A National Questionnaire Survey[J]. J Aerosol Med Pulm Drug Deliv, 2014, 27(5): 386-391. doi:10.1089/jamp.2013.1053.
[6]丁建强, 段丹丹, 孟阳. PDCA循环管理在规范雾化吸入药物临床使用中的作用[J]. 中国药房, 2016, 27(26): 3721-3724,3725. doi:10.6039/j.issn.1001-0408.2016.26.40.
[7]黄忠华, 黄富宏, 姜亚莉, et al. 医院2016年儿科门诊糖皮质激素类药物应用调查与分析[J]. 中国药业, 2018, 27(19): 3. doi:10.3969/j.issn.1006-4931.2018.19.026.
[8]刘瀚旻, 符州, 张晓波, et al. 儿童呼吸系统疾病雾化治疗合理应用专家共识[J]. 中华儿科杂志, 2022, 60(4): 283-290. doi:10.3760/cma.j.cn112140-20220118-00059.
[9]Douafer H, Andrieu V, Brunel J M. Scope and limitations on aerosol drug delivery for the treatment of infectious respiratory diseases[J]. Journal of Controlled Release, 2020, 325: 276-292. doi:10.1016/j.jconrel.2020.07.002.
[10]Klinger-Strobel M, Lautenschläger C, Fischer D, et al. Aspects of pulmonary drug delivery strategies for infections in cystic fibrosis--where do we stand?[J]. Expert Opin Drug Deliv, 2015, 12(8): 1351-74. doi:10.1517/17425247.2015.1007949.
[11]Borghardt J M, Kloft C, Sharma A. Inhaled Therapy in Respiratory Disease: The Complex Interplay of Pulmonary Kinetic Processes[J]. Canadian respiratory journal, 2018, 2018: 2732017-2732017. doi:10.1155/2018/2732017.
[12]Gregory K L, Wilken L, Hart M K. Pulmonary disease: aerosol delivery devices[J]. Irving: American Association for Respiratory Care, 2017.
[13]陈卉, 陈燕忠, 吕竹芬, et al. 吸入制剂中影响肺部沉积性能的因素[J]. 西北药学杂志, 2013, 28(2): 220,封3-封4. doi:10.3969/j.issn.1004-2407.2013.02.040.
[14]Hickey A J, Mansour H M. Inhalation aerosols: physical and biological basis for therapy, Third Edition (3rd ed.).[M]. CRC press, 2019.
[15]Vaghi A, Berg E, et al. Pulm Pharmacol Ther. 2005;18(2):151-3. 2. Biddiscombe MF, et al. J Aerosol Med. 2006 Fall;19(3):245-53.
[16]王蕊等. 中国药物经济学杂志-药物研究. 2021;16(2):108-113
[17]Miller-Larsson A et al. Drug Metab Dispos 1998;26(7):623-630. 2.Miller-Larsson A, et al. Am J Respir Crit Care Med 2000; 162: 1455–1461. 3.中华医学会临床药学分会«雾化吸入疗法合理用药专家共识»编写组. 医药导报, 2019, 38(2)135-146.
[18]Horvath G, Wanner A. Inhaled corticosteroids: effects on the airway vasculature in bronchial asthma[J]. Eur Respir J, 2006, 27(1): 172-87. doi:10.1183/09031936.06.00048605.
[19]Barnes P J. Inhaled Corticosteroids[J]. Pharmaceuticals (Basel), 2010, 3(3): 514-540. doi:10.3390/ph3030514.
[20]Patalano F, Banerji D, D’andrea P, et al. Addressing unmet needs in the treatment of COPD[J]. European Respiratory Review, 2014, 23(133): 333-344. doi:10.1183/09059180.00004014.
[21]Ti H, Zhou Y, Liang X, et al. Targeted Treatments for Chronic Obstructive Pulmonary Disease (COPD) Using Low-Molecular-Weight Drugs (LMWDs)[J]. Journal of Medicinal Chemistry, 2019, 62(13): 5944-5978. doi:10.1021/acs.jmedchem.8b01520.
专家介绍

徐保平
医学博士 主任医师 教授;首都医科大学附属北京儿童医院呼吸科主任、呼吸疾病研究室主任;国家呼吸系统疾病临床医学研究中心副主任;中华医学会儿科学分会呼吸学组组长;中华医学会儿科学分会呼吸学组疑难少见病协作组组长;中国医师协会呼吸分会儿科基层呼吸联盟副主任委员等;主要研究方向:儿童原发性纤毛运动障碍、支气管扩张症和肺炎支原体肺炎。
*审批编号CN-130800 过期日期 2025-2-28
*本材料由阿斯利康提供,仅供医疗卫生专业人士进行医学科学交流,不用于推广目的
本文由《呼吸界》编辑 Jerry 整理
本文完
责编:Jerry


