
今天与大家一起交流的内容是关于抗炎+免疫调节在反复呼吸道感染哮喘儿童管理中的应用。众所周知,哮喘疾病在呼吸道感染中发病率较高。我将从现象分析、核心机制探讨及应对策略三个方面与大家一起探讨。
现象:呼吸道感染在哮喘儿童中“常见且重要”
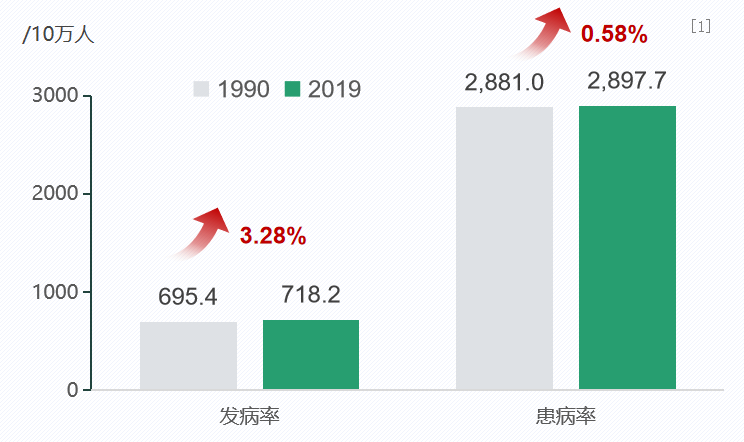
我国现有逾800万哮喘儿童的数量,实际上,0-19岁儿童青少年哮喘总患病人数高达869万,且呈现明显上升趋势。一份关于哮喘疾病负担及其变化趋势的研究,采用了2019年全球疾病负担中国分省研究结果,对1990-2019年我国1-19岁儿童青少年哮喘疾病负担进行了分析。研究结果直观地展示了两个年龄段的发病率与患病率情况。从1990年到2019年,患病人数从695.4万上升至718.2万;而患病率更是从2881万上升至2897.7万,增幅为0.5%。[1]
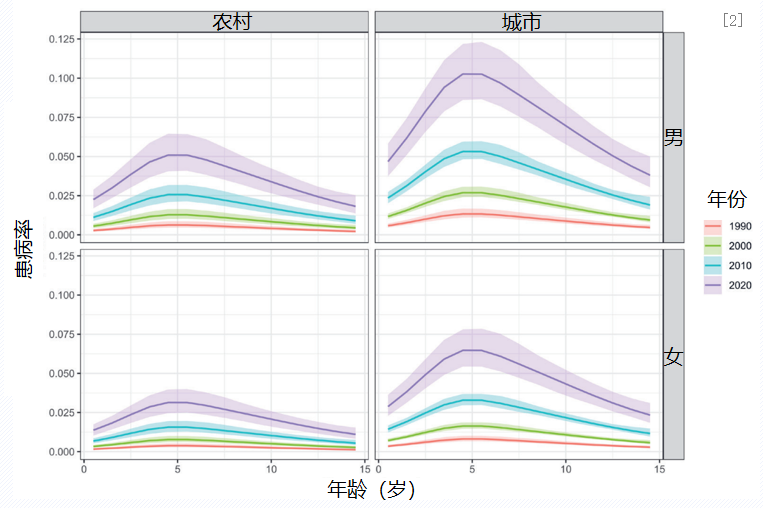
一项系统回顾分析,检索自1990年至2019年3月16日发表的所有222篇中国儿童(0-14岁)哮喘流行病学研究,建立哮喘患病率随年龄、性别、环境变化的模型进行分析。结果显示,2020年14岁农村女童的哮喘患病率为1.11%,95%CI=0.82-1.54),城市4岁男童的哮端患病率最高,为10.27%(95% CI=8.61-12.18)。由此可见,我国儿童哮喘患病率呈现以下特点:男性高于女性,城市高于农村,4岁男童哮喘患病率最高。[2]
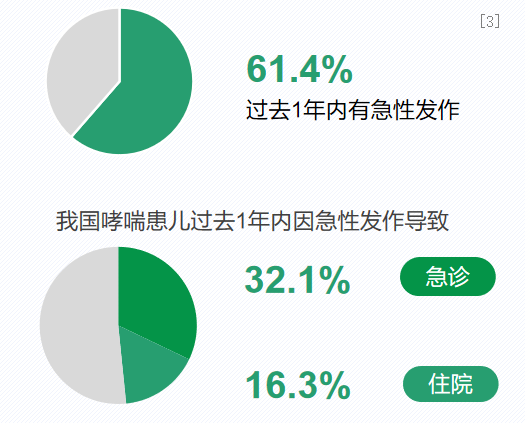
儿童哮喘管理的现状其实就是控制水平不佳,易反复急性发作。全国儿科哮喘协作组在全国27个省或自治区、4个直辖市等共43个城市,开展0-14岁城区儿童哮喘流行病学调查,旨在了解目前全国各省主要城市城区儿童哮喘的患病率、发病规律、诊治情况以及管理状况等。全国第三次哮喘调查显示,我国哮喘患儿仍有逾6成未能控制,近1年内仍有发作。61.4%在一年中有反复发作,32.1%需要急诊,16.3%需要住院治疗。而在国际上,哮喘的控制率一般而言要达到80%,但我国是发作率达到61.4%。[3]
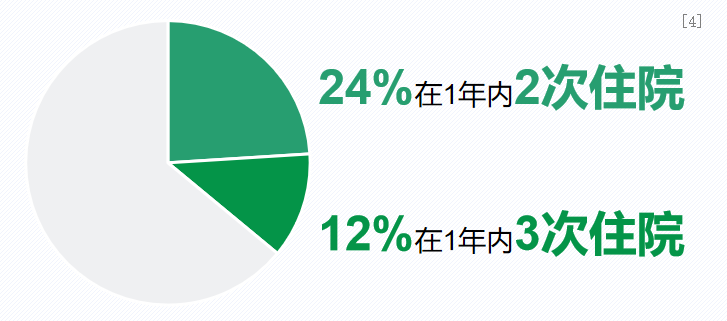
一项回顾性多中心研究,对2012年至2013年期间在美国18个州25家医院因哮喘加重住院的患者病历进行了审核分析,共纳入369名2-17岁的哮喘患儿和555名18-54岁的成人哮喘患者。这项美国多中心研究数据显示,曾因哮喘发作住院的儿童,高达36%会在1年内再次入院。[4]
哮喘急性发作频发危害患儿健康,带来沉重疾病负担。从临床不良后果看,第一,导致急性发作频发:87.7%哮喘患儿1年喘息发作1-5次;第二,导致肺功能降低:≤3岁哮喘反复急性发作患儿未来肺功能显著下降;第三,导致死亡风险升高:反复发作的重症哮喘的死亡风险是轻中度哮喘的4.4倍。从社会经济负担看,第一,导致经常就医和住院:反复发作的重症哮喘的急诊就诊频率高出15倍,住院频率高出20倍;第二,导致误工误学:63.6%的在校哮喘学生过去一年中因哮喘发作误学,平均误学2.4次、10.4天;第三,导致医疗费用增加:80%的哮喘直接成本是由急性发作急诊或住院治疗所造成的,反复发作的难治性哮喘医疗负担是轻症哮喘的6倍。[3、5-8]
我们都知道哮喘与过敏息息相关,感染、过敏以及其他原因统统可以导致喘息的发作,反复喘息发作就可以考虑为哮喘。哮喘急性发作其实有规律可循,除了5月份春暖花开的季节和10月份秋收的季节,过敏原增多,因此哮喘发作也增加,但别忘了,还有一个“9月现象”。[9]
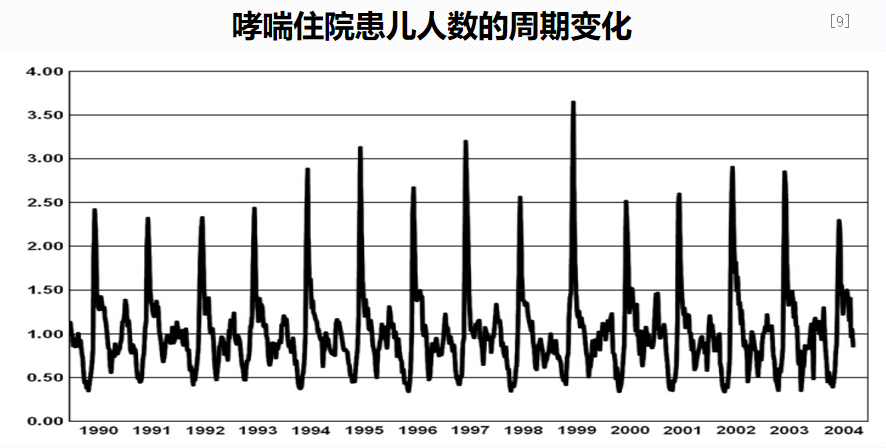
1990年至2004年,加拿大2至15岁儿童哮喘住院人数以年内每周平均住院人数为基数的倍数,显示每年9月出现住院高峰。研究数据来源包括加拿大卫生信息研究所、瑞典国家卫生与福利委员会以及伦敦帝国学院的小区域健康统计单位。数据涵盖了1990年至2004年加拿大学龄儿童的哮喘住院情况,以及2001年至2004年加拿大安大略省的急诊部门就诊情况。何谓哮喘发作的“9月现象”呢?每年9月,加拿大等多个北半球国家都会出现儿童哮喘急诊就医、住院和急诊门诊量激增的规律周期性高发期。哮喘儿童“9月现象”发生的可能原因:北半球鼻病毒感染的高峰期通常出现在9月,以鼻病毒为主的呼吸道病毒感染与80%的学龄前儿童哮喘急性发作有关。因此,根据临床已知,哮喘发作呈现“9月现象”,与呼吸道病毒流行规律及过敏原暴露相符。[9]

临床数据表明,相较于正常儿童,哮喘病患呼吸道感染率显著提高。哮喘儿童发生呼吸道感染频率远高于普通儿童。[10]
一项病例对照研究纳入317例哮喘儿童(哮喘组)和317例非喘息性疾病儿童(对照组),对既往患病情况进行了分析,初步探讨了儿童后期哮喘发病与婴幼儿期羅患呼吸道感染疾病之间的关系。数据显示,哮喘患儿上呼吸道感染率为42%,非哮喘患儿上呼吸道感染率为22%。而从下呼吸道感染率看,同样,哮喘患儿比非哮喘患儿高一倍。[11]
一项前瞻性研究纳入180名4-12岁儿童(95名有哮喘,66 名没有哮喘),连续8周对鼻腔样本进行病毒诊断,并对感冒和哮喘症状评分,评估哮喘和非哮喘儿童病毒高峰季的的H1N1感染情况。数据显示,哮喘患儿H1N1病毒感染率为41%,非哮喘患儿H1N1病毒感染为24%。[12]
一项研究纳入152名支气管哮喘患儿(观察组)和100名上呼吸道感染患儿(对照组),进行肺炎支原体抗体(MP-Ab)阳性检测,比较两组MP-Ab阳性率,同时对阳性患儿进行分组治疗,分为常规组(一般常规治疗)和治疗组,(加用阿奇霉素治疗),比较两组疗效,探讨儿童支气管哮喘病与肺炎支原体感染的关系。数据显示,哮喘患儿肺炎支原体感染率为45%,非哮喘患儿肺炎支原体感染率仅为7%。[13]
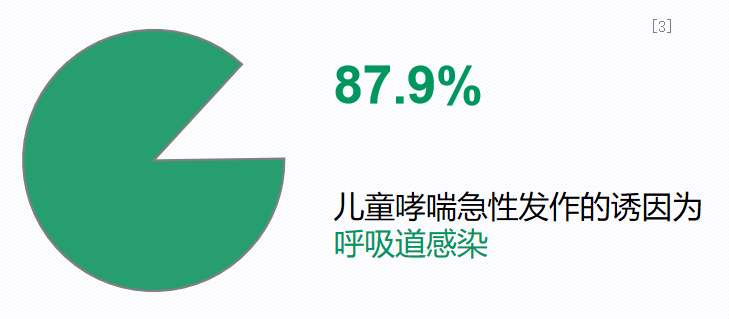
之前提到过,全国儿科哮喘协作组在全国27个省或自治区、4个直辖市等共43个城市开展0-14岁城区儿童哮喘流行病学调查,了解目前全国各省主要城市城区儿童哮喘的患病率、发病规律、诊治情况以及管理状况等。而这次是全国第三次儿童哮喘流行病学调查,结果显示呼吸道感染是儿童哮喘急性发作最常见的诱因,它在急性感染的诱因里达到87.9%。因此,对于儿童,呼吸道感染是引起哮喘急性发作的重要诱因之一。[3]
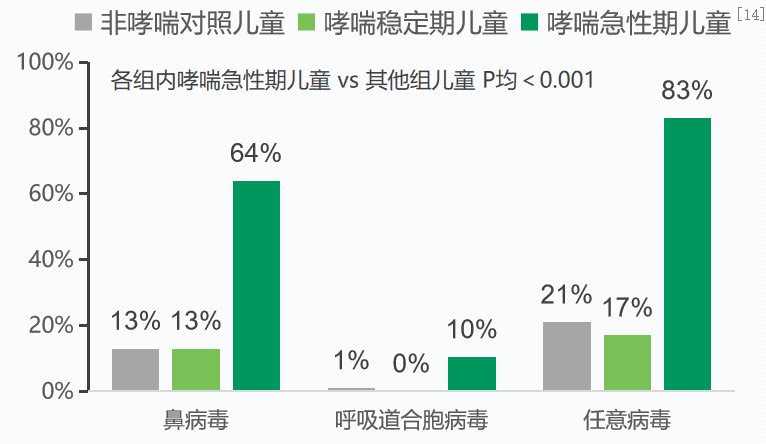
一项研究纳入287名7-12岁儿童(96名哮喘急性发作儿童、65名哮喘稳定期儿童及126名非哮喘对照受试者),采用PCR和基因测序检测鼻洗液中的病毒阳性率,评估其与IgE抗体、呼出一氧化氮水平分数、及哮喘急性发作之间的关系。在这里可以看到,绿色柱状图是哮喘急性发作期,苹果绿柱状图是稳定期,灰色是非哮喘的对照儿童。鼻病毒在哮喘患者中检出率达到64%,呼吸道合胞病毒哮喘患者急性发作期是10%,其他总的病毒加起来,任意的病毒在哮喘急性发作期,病毒发现率是83%,也就是说稳定期与正常儿童是相近的。这些结论都在提示我们,哮喘急性发作儿童的呼吸道病毒感染阳性率显著高于哮喘稳定期儿童和非哮喘儿童。病毒感染是诱发哮喘急性发作一个非常重要的诱因。[14]
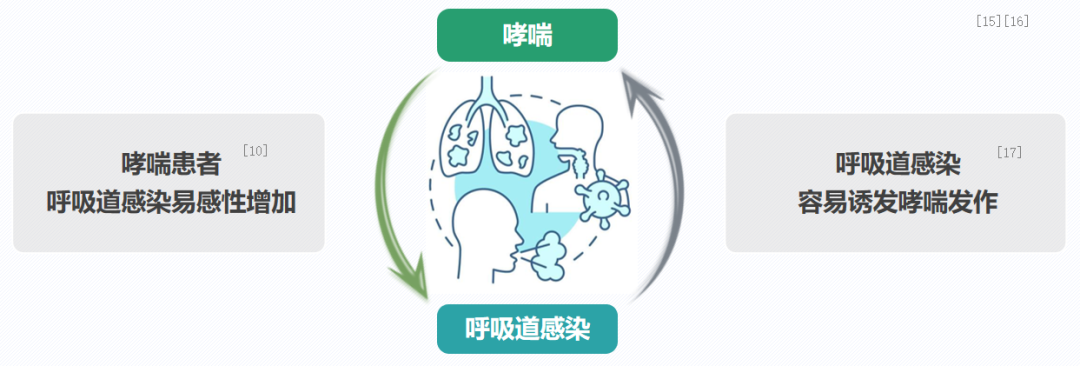
呼吸道感染与哮喘发作之间的关联紧密,在哮喘病的治理过程中,对此应给予足够的关注。哮喘患者在遭遇呼吸道感染时,其易感性会相应提高。换言之,哮喘病症本身即易于引发呼吸道感染,而一旦发生呼吸道感染,又将诱发哮喘发作,从而形成恶性循环。因此,在治疗哮喘的同时,还需对呼吸道感染进行有效管理。[10、15-17]
探讨:异常免疫炎症反应模式:哮喘与呼吸道感染相互作用的核心机制
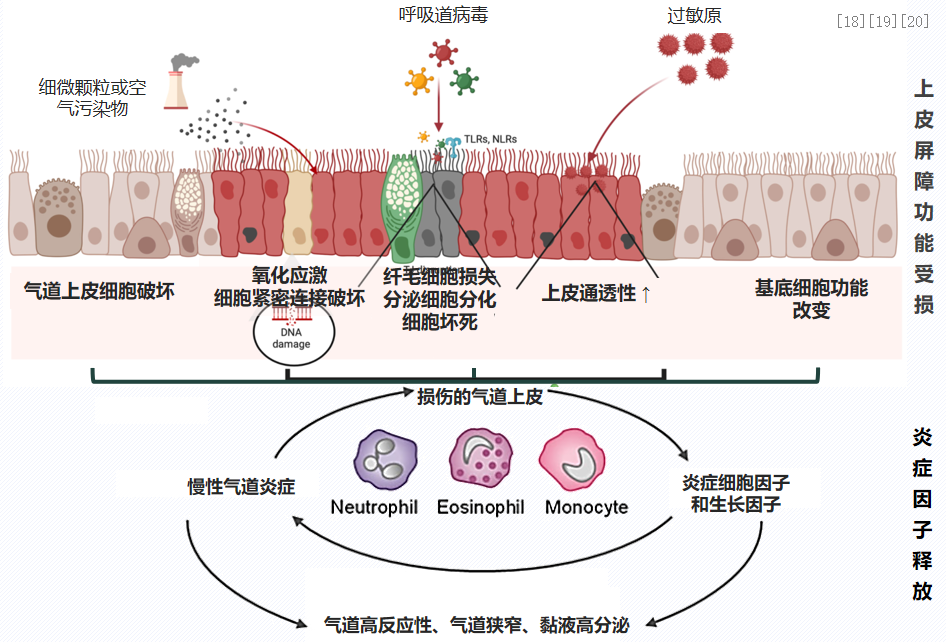
哮喘的反复呼吸道感染,它的核心机制可能有异常的免疫炎症反应。我们知道哮喘患者基础病理特征是:气道上皮损伤,免疫屏障功能受损,炎症因子释放。上皮屏障功能受损包括:上皮细胞破坏、基底细胞功能改变、细胞紧密连接破坏、纤毛清除能力下降,黏蛋白和抗菌肽分泌减少、上皮通透性增加等。上皮细胞受损的同时增加炎症因子的释放,包括:中性粒细胞、嗜酸性粒细胞和单核细胞的募集,炎症因子释放增加。[18-20]
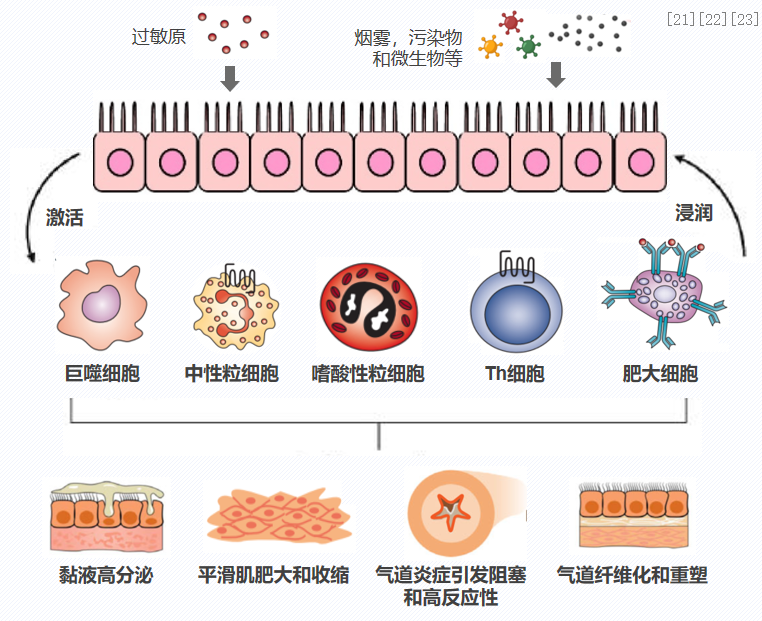
哮喘患者的基本病理生理什么?就是免疫失调的持续存在,也就是说机体处于长期的慢性炎症状态。我们知道哮喘的定义叫慢性气道炎症性疾病,所谓慢性气道炎症也就是处于一个长期存在的慢性气道炎症。哮喘患者的气道炎症,是由过敏原、烟雾、病原微生物等吸入性诱发因素刺激气道上皮细胞产生炎症介质。由于吸入诱发物,刺激气道上皮细胞产生炎症细胞因子,炎症介质进一步激活和募集多种炎症细胞,炎症细胞浸润气道并释放介质,增强气道上皮的炎症反应。比如:激活Th细胞、巨噬细胞、肥大细胞、嗜碱性粒细胞、中性粒细胞等炎症细胞。引起气道阻塞和高反应性、气道上皮和平滑肌病理变化、气道黏液高分泌,并可能导致气道重塑。[21-23]
过去我们认为哮喘是一种可逆的气流受限疾病。在急性发作时,通过使用支气管舒张剂和抗炎药物等措施,可以缓解平滑肌痉挛,从而使气流完全恢复。然而现今的研究发现,反复发作会导致气道高反应性通过平滑肌增生、肥厚,气道重塑以及纤维化,进而引发肺功能不可逆的阻塞。因此,研究发现,反复发作的哮喘患者,部分重症者在23岁时即可出现慢性阻塞性肺病及小气道病变。这就解释了为何哮喘患者需要长期规范地吸入糖皮质激素,以消除慢性气道炎症。
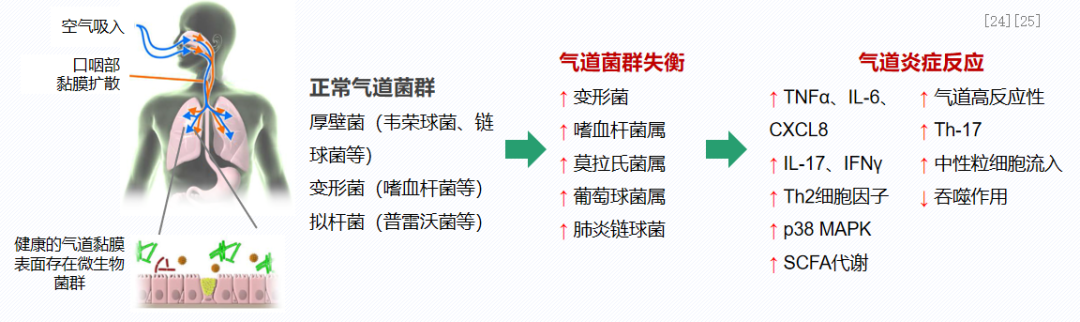
哮喘患者气道微生物菌群改变也是重要的促炎因素。与健康者相比,哮喘患者气道中特定微生物的种类和丰度发生变化,如变形菌、嗜血杆菌、奈瑟氏球菌、莫拉氏菌、葡萄球菌和链球菌等,菌群失衡进一步引发气道炎症反应。所以我们经常会讲,有的患者真的是需要微生态进行治疗。[24、25]
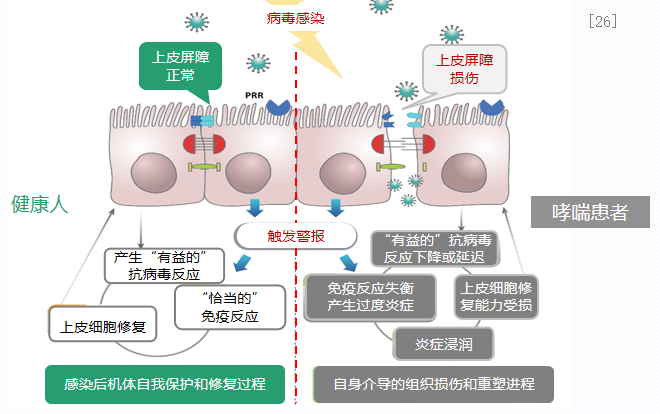
哮喘患者的异常免疫炎症反应模式导致发生呼吸道感染时影响比健康人更为严重。病毒感染时,哮喘患者免疫防御能力下降,促炎反应增加。这是因为在病毒感染时,哮喘上皮细胞的免疫炎症反应模式与正常上皮细胞不同,机体不能发挥正常的保护功能,而是产生过度的免疫炎症反应,诱导组织损伤,因此会加重病情。[26]
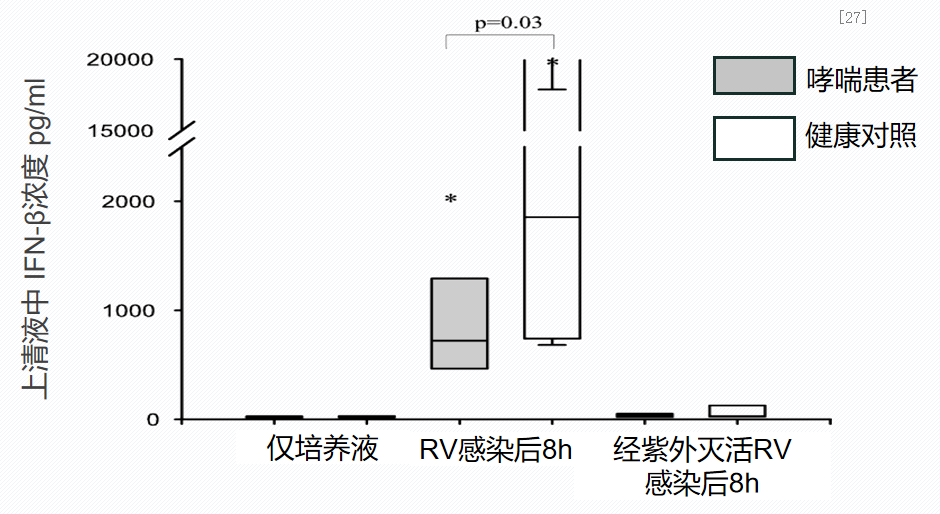
一项体外研究,将14例中重度哮喘患者和10例健康受试者的支气管上皮细胞进行体外培养,使用RV病毒感染后,检测病毒复制和Ⅰ型IFN干扰素IFN-β,分析哮喘患者支气管上皮细胞在病毒诱导下的Ⅰ型IFN反应。I型干扰素(包括IFN-β)是固有免疫的重要组成部分,可直接作用于病毒并刺激产生适应性免疫。哮喘患气道上皮细胞感染鼻病毒(RV)后IFN-β分泌较健康人显著降低。这说明,哮喘患者对病毒的“有益”免疫反应下降。[27]
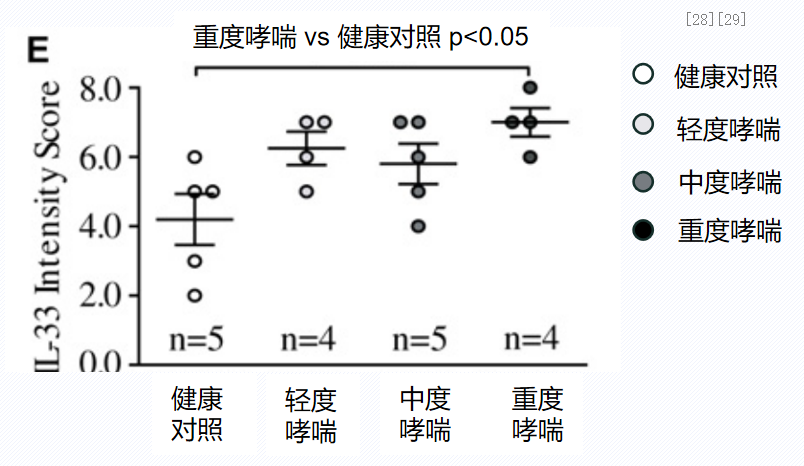
一项体外研究,分离13例哮喘患者和5例健康受试者的支气管上皮细胞,分别进行化学染色和体外培养,分析哮喘患者和健康对照组支气管上皮细胞IL-33的表达水平。结果显示,IL-33可抑制抗病毒的固有免疫和适应性免疫,并增强气道高反应性和炎症。与健康对照组相比,哮喘患者气道上皮产生更多IL-33。这说明,哮喘患者对病毒的“有害”免疫反应增加。当遭遇病原体感染时,哮喘患者抗病毒免疫能力下降。[28、29]
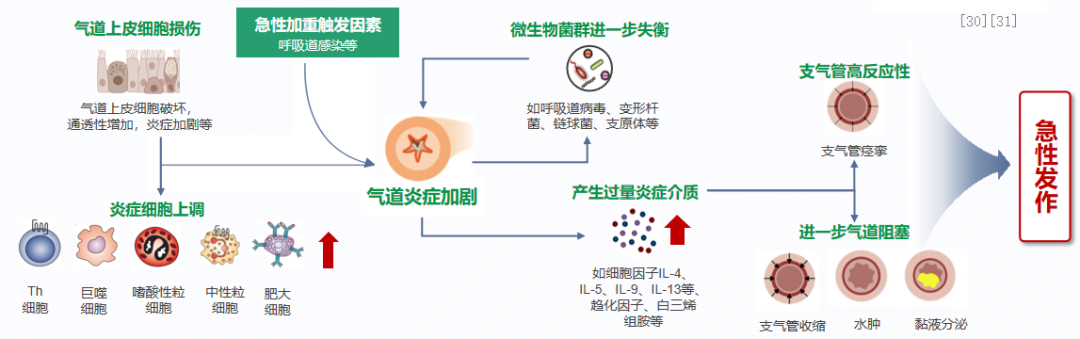
病原体入侵机体触发免疫级联反应,加剧炎症,诱发急性发作。与缓解期相比,急性期哮喘患者气道中多种炎症细胞上调,气道上皮细胞损伤加剧,产生过量的炎症介质,与平滑肌和气道上皮细胞相互作用,导致早期支气管痉挛,以及后期炎症,引起黏液大量产生和气道水肿,进一步引发气道阻塞和支气管痉挛。急性期哮喘患者气道中的微生物菌群种类和丰度也进一步发生变化,如呼吸道病毒(如鼻病毒等)、肺炎链球菌、肺炎支原体感染,变形杆菌群落(如血杆菌、假单胞菌和克雷伯菌等)丰度显著增加,进一步加剧气道炎症反应。[30、31]
小结:[19、25、32]
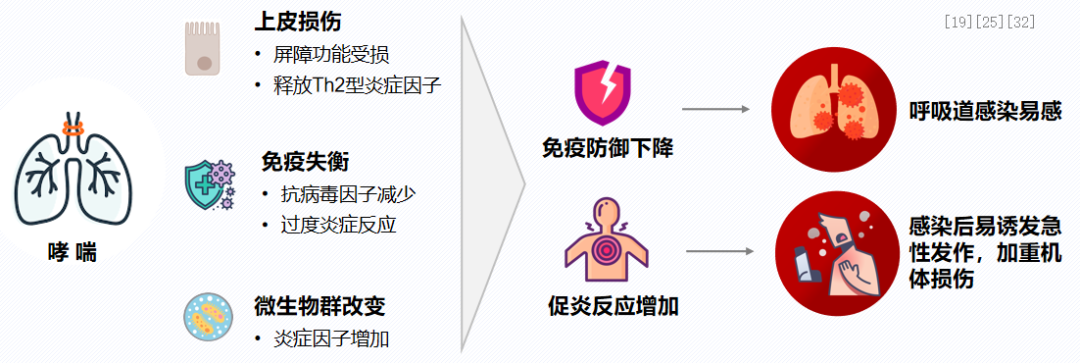
异常免疫炎症反应模式导致哮喘与呼吸道感染密不可分。患者的基础炎症症状,即慢性炎症和免疫功能紊乱,导致呼吸道病原体易感、感染风险增加及抗病毒能力下降。上皮受损、菌群紊乱以及免疫功能失衡,加剧了炎症反应,降低了免疫防御能力。因此,感染频发,且感染后诱发急性哮喘发作,进一步加重机体损伤。
应对:抗炎+免疫治疗,优化反复呼吸道感染哮喘儿童管理
前述从流行病学出发,讲了反复呼吸道感染在哮喘中发生率高,而分析病理机制,气道多种病理改变是呼吸道感染的哮喘的重要原因。那么,抗炎+免疫双管齐下,优化反复呼吸道感染的哮喘患者管理,就是应对方案,也是药物的作用。
抗炎治疗与免疫炎症反应治疗被视为疾病治疗的两大策略。过去,人们普遍认为病毒感染不宜采用激素治疗。十余年前,我们曾遇到一例重症腺病毒感染患儿,其症状包括高热、眼睛红肿以及精神不振。腺病毒感染若扩散至血液,可能导致腺病毒血症,进而损害其他脏器,甚至发展为腺病毒肺炎。若病情进一步恶化,侵犯心脏,可能造成严重后果甚至死亡。
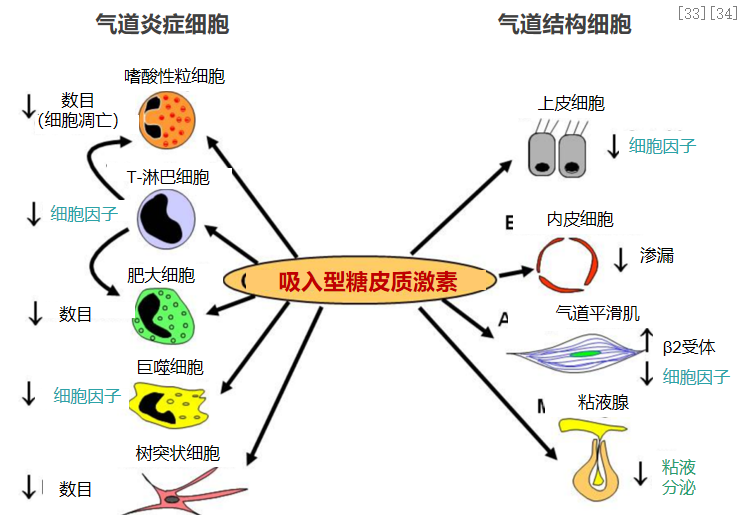
ICS(吸入型糖皮质激素)具有强大抗炎效果,可快速减轻气道炎症,修复上皮损伤。ICS抗炎治疗,一方面能减轻气道炎症:减少气道炎症细胞数量及炎症细胞因子释放,抑制气道炎症发生发展;另一方面能保护气道上皮:维护气道上皮细胞屏障,减少内皮细胞渗漏,减少黏液分泌和炎症细胞因子释放。[33、34]
GINA指南推荐,ICS是哮喘急性期首选缓解药物和缓解期重要控制药物,可用于哮喘急性期+缓解期的全程管理。为什么要全程管理?因为哮喘本身是一个慢性气道炎症性疾病,当急性发作期时,一定是大剂量的吸入糖皮质激素,短时间之内可一小时给予数次,也就是每20分钟一次,以减少需要全身用激素乃至要住院的需要。但是当患儿急性发作期稳定以后,可以让其回家,给其用吸入糖皮质激素在家里持续治疗,这可以减少未来再发生急性发作的风险,可降低未来再次住院的风险,因此急性期一定是可以用的。[35]
ICS用于哮喘管理应至少持续3个月,重症哮喘和长期没有得到有效治疗者需更长时间。哮喘患者控制维持至少3个月以上才考虑调整治疗方案。GINA 2023对6-11岁儿童的治疗,急性期——急诊处理:急性发作后的第一个小时内给予大剂量ICS可以减少未接受全身激素治疗患者的住院需要(证据等级 A);出院回家:应继续为患者处方含ICS治疗,因发生重度急性发作是未来急性发作的风险因素(证据等级 B) ,含ICS治疗显著降低哮喘相关死亡或住院风险(证据等级 A)。缓解期——Step1:首选当应用SABA时应给予低剂量ICS;Step2:首选每日低剂量ICS治疗;Step3:中等剂量ICS可作为首选控制药物。[35]
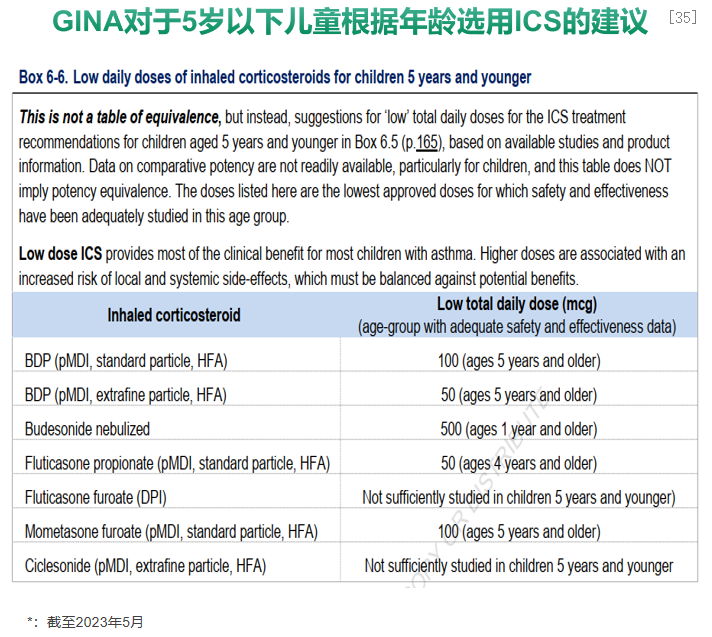
≤5岁哮喘儿童,ICS也是急性期和缓解期的重要方案。根据GINA对于5岁以下儿童根据年龄选用ICS的建议,急性期——急诊处理:之前未使用过ICS的患儿,可以使用双倍的最低ICS剂量并维持使用数周或数月(D 级证据);在家管理:抢先给予高剂量ICS雾化治疗可减少间歇性病毒感染触发的哮喘急性发作(D 级证据)。缓解期——Step1:在病毒引发哮喘发作时考虑间歇性给予高剂量ICS短期治疗;Step2:首选低剂量ICS。该初始治疗应至少给药3个月;Step3:首选双倍“低剂量”ICS。[35]
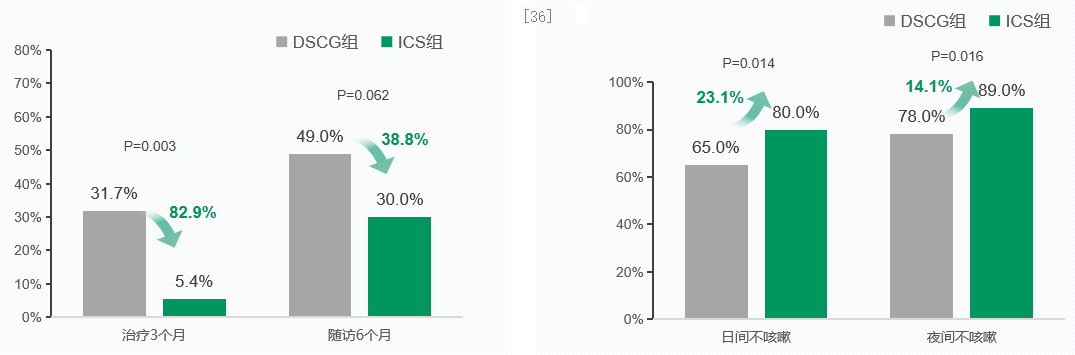
一项前瞻性,随机对照研究纳入82名哮喘儿童(6-36个月),随机接受雾化吸入ICS和色甘酸二治疗3个月,随访6个月,比较雾化ICS和DSCG对36个月以下哮喘儿童的有效性。从左侧柱状图可见,雾化吸入ICS减少治疗和随访期间,哮喘患儿的急性发作率分别达82.9%和38.8%。右侧柱状图可见,雾化吸入ICS显著增加哮喘患儿日间和夜间无咳嗽天数占比达23.1%和14.4%。研究显示,与雾化吸入色甘酸二钠(DSCG)相比,雾化吸入ICS治疗组哮喘患儿的急性发作率更低,无咳嗽症状天数更多。雾化吸入ICS维持期治疗3个月,有效减少哮喘患儿急性发作和临床症状。[36]
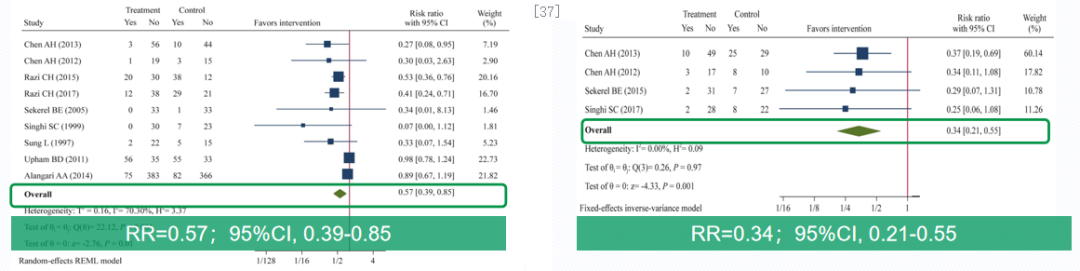
哮喘患儿急性期使用雾化ICS治疗可降低住院风险和使用全身激素的风险。一项荟萃分析,纳入16项RCT研究,评价中重度哮喘急性发作患儿雾化吸入ICS后的住院率、住院时间、全身糖皮质激素使用以及不良事件。从左侧柱状图可见,雾化吸入ICS可显著降低43%,哮喘急性发作患儿住院风险。右侧柱状图可见,雾化吸入ICS可显著降低66%,哮喘急性发作患儿使用全身糖皮质激素风险。由此可得出结论:Meta分析结果表明,在标准治疗基础上加用雾化吸入ICS,可显著降低中重度哮喘急性发作患儿的住院风险达43%,显著降低需要使用全身糖皮质激素的风险达66%。[37]
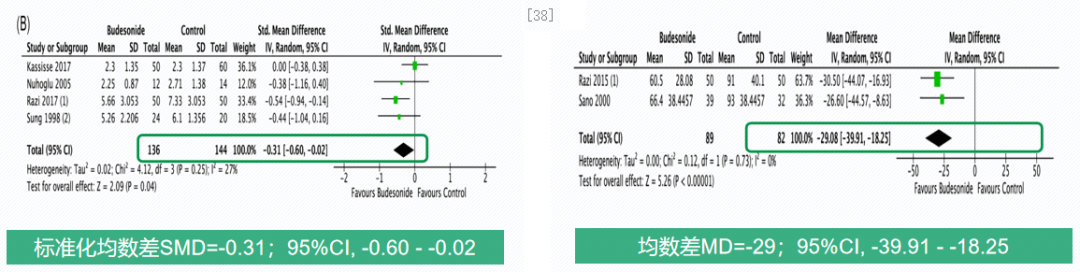
雾化吸入ICS急性期治疗有效改善哮喘急性发作严重程度,缩短病程。一项meta分析,共纳入9项随机对照研究,评估在急诊或住院期间的哮喘急性发作患儿(n=1473)中,与单独使用全身糖皮质激素相比,联合吸入糖皮质激素(ICS)的疗效。从左侧柱状图可见,雾化吸入ICS可显著改善哮喘急性发作严重程度评分达0.31分。右侧柱状图可见,雾化吸入ICS可显著缩短哮喘急性发作住院时间29小时。由此也可得出结论:Meta分析结果表明,在标准治疗基础上加用雾化吸入ICS,可显著改善哮喘急性发作患儿的哮喘评分,并显著缩短住院时间达29小时。[38]
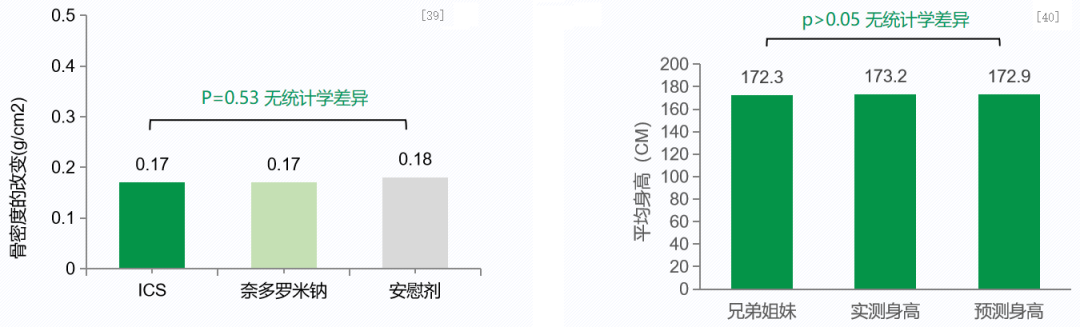
低剂量ICS长期治疗安全性良好,不影响儿童骨密度和成年后身高。[39、40]
左侧柱状图是一项随机对照研究,1041例5-12岁中重度哮喘儿童随机分为ICS ,奈多罗米钠组及安慰剂组。治疗4到6年,观察治疗的远期影响。结果显示,与非ICS治疗的两组相比:治疗期间,与安慰剂相比,每日低剂量ICS、组降低住院风险43%(P=0.04), 降低急诊就诊率45%(P<0.001), 减少43%全身激素使用 (P<0.001)。每日低剂量ICS不降低骨密度,不增加骨折风险,均达到正常成年身高。这说明,低剂量ICS长期治疗不影响患儿骨密度。[39]
右侧柱状图是一项前瞻性研究,探讨长期吸入ICS对哮喘患儿成年身高的影响。纳入211例儿童,包括142例接受ICS治疗(每日平均剂量412μg,平均治疗时间9.2年)的哮喘儿童,18例未接受ICS治疗的哮喘儿童和51例接受ICS治疗患儿的健康的兄弟姐妹。主要研究终点即比较实际测量的成年身高与预测成年身高间的差异。次要终点为影响实际与预测身高差异的因素(包括ICS平均每日剂量、累计剂量、治疗疗程等)。结果表明,接受长期ICS治疗的哮喘患儿达到了正常的成年身高。这说明,低剂量ICS长期治疗不影响患儿身高。[40]
常见免疫调节剂,主要分为三类:微生物制剂(细菌溶解产物);化学制剂(匹多莫德);生物制剂(胸腺肽、脾氨肽)。微生物制剂的作用机制,固有免疫:1.提升吞噬细胞杀灭病原体活性,刺激单核细胞活性,促进非特异性免疫;2刺激Toll样受体,提高抗原递呈细胞的活性。适应性免疫:1.促进T细胞转化,增加调节T细胞数量和活性,调节Th1/Th2向Th1飘移;2.激活B细胞,增加免疫球蛋白的含量。适用人群是6个月及6个月以上的儿童及成人。化学制剂的作用机制,固有免疫:增强巨噬细胞、中性粒细胞吞噬活性和趋化性,激活NK细胞。适应性免疫:促进T细胞增殖,纠正辅助性T细胞/抑制性T细胞比值等。适用人群是3岁及3岁以上的儿童及成人。生物制剂如胸腺肽的作用机制,适应性免疫:1.促进胸腺淋巴细胞分化、发育和成熟,调节CD4+/CD8+平衡;2.间接调节B淋巴细胞,提供免疫球蛋白的含量。适用于成人,儿童及老年患者慎用。脾氨肽的作用机制,适应性免疫:增强细胞免疫功能,纠正Th1/Th2的不平衡,提高血IL-4和IFN-ϒ水平,使CD4+ /CD8+比值上升。适用于成人,儿童及老年患者疗效及安全性尚不明确。(备注:Th:辅助T细胞;IFN:干扰素;IL:白介素)[41-45]

指南推荐:应用免疫调节剂是预防哮喘呼吸道感染的重要策略。预防儿童反复呼吸道感染发作的专家共识声明指出,免疫治疗可用于预防儿童(包括特应性/过敏性和哮喘患者)反复呼吸道感染。儿童反复呼吸道感染诊断和治疗的实用指南指出,免疫调节剂可做为预防反复呼吸道感染的策略。儿童支气管哮喘诊断与防治指南(2016年版)指出,因反复呼吸道感染诱发喘息发作的患儿,除应用合适的控制治疗药物以外,可联合应用免疫调节剂以改善呼吸道免疫功能。[46-48]
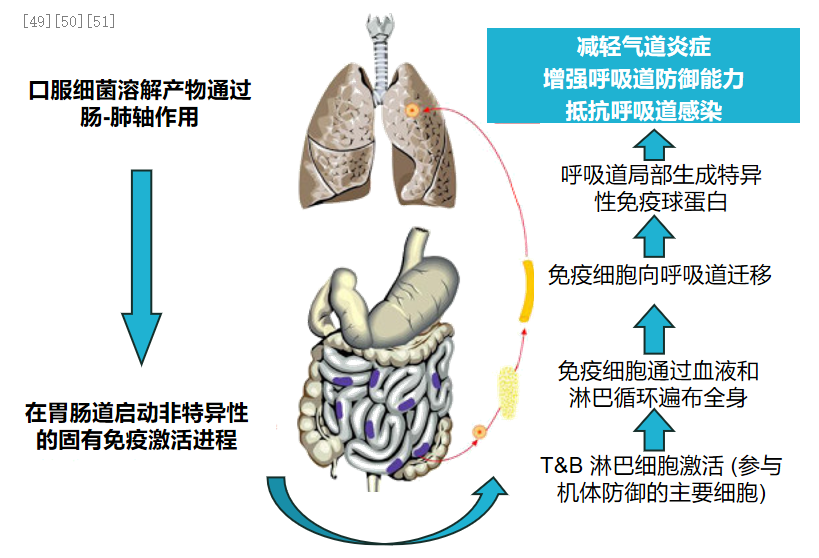
细菌溶解产物可激活免疫进程,调节免疫失衡,提升免疫防御能力。口服细菌溶解产物含有我们常见的多种呼吸道感染的细菌,把它溶解的产物通过口服进入肠道,通过肠-肺轴刺激粘膜的免疫,所以它是通过局部的免疫进入血液,提高肺部免疫力,减轻气道炎症。并且,细菌溶解产物通过血液通过淋巴进入肺部,能提高呼吸道免疫球蛋白水平,增强呼吸道防御能力,抵抗呼吸道感染。[49-51]
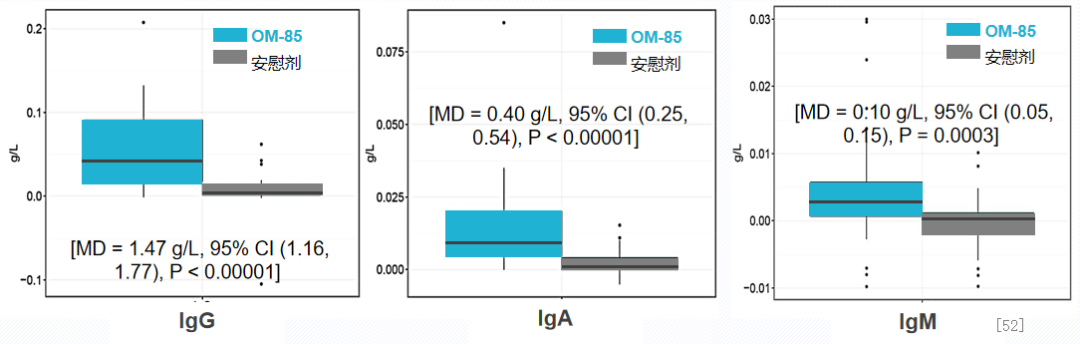
细菌溶解产物可提高免疫球蛋白水平,提升气道免疫力。一项荟萃分析纳入53项RCT研究4851例反复呼吸道感染患儿,评价OM-85预防儿童反复呼吸道感染的疗效及安全性。其中31项RCT研究观察到了血清IgG变化,30项RCT研究观察到了血清IgA变化,25项RCT研究观察到了血清IgM改变。荟萃分析显示,相比安慰剂, 细菌溶解产物给药3个月可显著提升反复呼吸道感染患儿血IgG、IgA、IgM水平。细菌溶解产物OM-85对反复呼吸道感染患儿血清IgG、IgA、IgM水平的影响。[52]
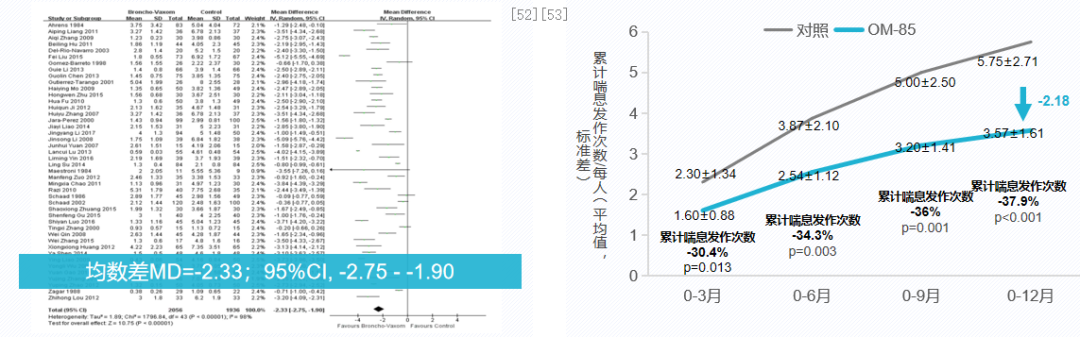
细菌溶解产物可有效减少儿童呼吸道感染和喘息发作次数。一项系统性回顾和荟萃分析(图左),纳入53项随机对照研究,4851例反复呼吸道感染患儿,评价OM-85预防儿童反复呼吸道感染的疗效及安全性。其中有44项研究报道了患儿呼吸道感染情况,结果显示,与对照组相比,OM-85降低患儿呼吸道感染次数,平均每人每年降低2.33次。[52]
一项随机,双盲,安慰剂对照平行研究,共纳入75例年龄1-6岁反复呼吸道感染导致喘息的患儿,35例给予OM-85 3.5mg/d治疗,连续治疗10天、停20天、连续治疗3个月,40例给予安慰剂治疗,随访1年,观察其减少喘息发作的效果。结果显示,OM-85减少反复呼吸道感染导致喘息发作学龄前儿童喘息发作2.18次。[53]
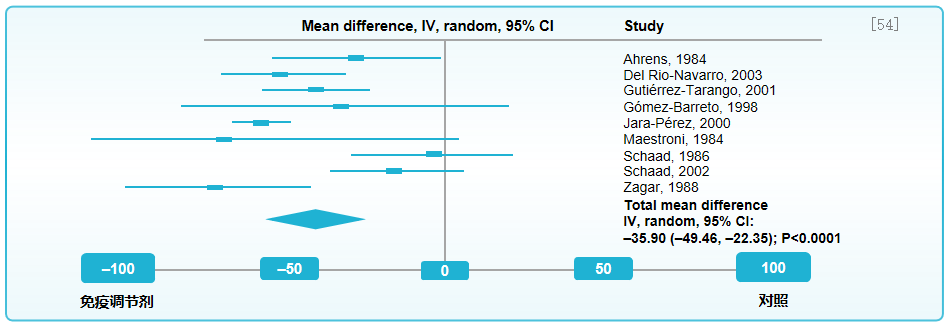
Cochrane 荟萃分析,共纳入35安慰剂对照试验,总人数为4060例,纳入的患者数为852例,观察免疫调节剂对儿童呼吸道感染的预防作用。通过免疫调节剂预防用药组与对照组的呼吸道感染发生率比较,可以看到,免疫调节剂可有效降低儿童急性呼吸道感染发生率。[54]
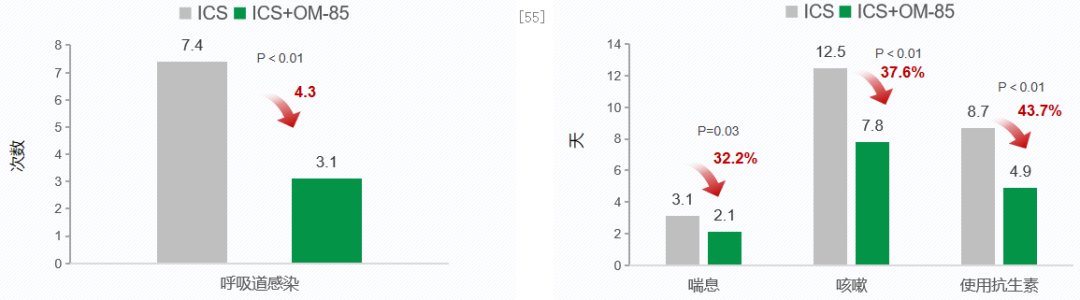
对于反复呼吸道感染的哮喘儿童,在ICS常规治疗基础上加用细菌通解产物,可有效预防呼吸道感染,减少喘息的发生。一项前瞻性对照研究,纳入60名过去12个月内反复发生呼吸道感染的哮喘儿童,随机分为ICS对照组(n=36)和OM-85治疗组(n=24)。OM-85治疗组在传统ICS治疗基础上增加OM-85的口服治疗,5-12 岁剂量为 3.5 mg,>12 岁剂量为 7.0 mg,每月连续给药10 天,停20天,每3个月一疗程。OM-85治疗共包括2个疗程(1-3月,7-9月)。随访一年,评估常规治疗联合口服细菌溶解产物在哮喘儿童中的疗效。从左侧柱状图可见,ICS+OM-85治疗后,呼吸道感染次数显著降低4.3次。右侧柱状图可见,ICS+OM-85治疗后喘息、咳嗽和抗生素使用持续时间显著减少32.2%、37.6%和43.7%。结论显示,在ICS常规治疗基础上,OM-85给药3个月可有效减少反复呼吸道感染的哮喘患儿呼吸道感染次数,同时喘息、咳嗽以及使用抗生素的时间显著减少。[55]
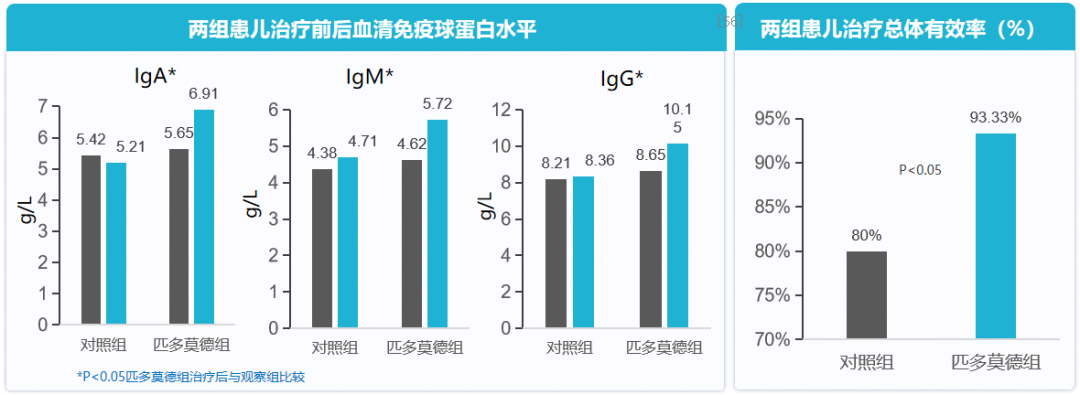
哮喘患儿在常规治疗基础上加用化学制剂免疫调节剂,改善免疫功能。一项前瞻性对照研究,纳入90例支气管哮喘患儿,分为匹多莫德治疗组45例和对照组45例,探究匹多莫德治疗对支气管哮喘患儿免疫功能的影响,并分析其疗效。对照组按照GINA指南给予常规治疗,观察组在此基础上加用匹多莫德口服液每 次10mL,每天1次,连续服用60d为1个疗程。治疗后随访观察6个月,比较两组哮喘患儿的免疫功能。结论显示,在常规治疗基础上加用匹多莫德,患儿血清免疫球蛋白水平增加,总体治疗有效率高于对照组。[56]
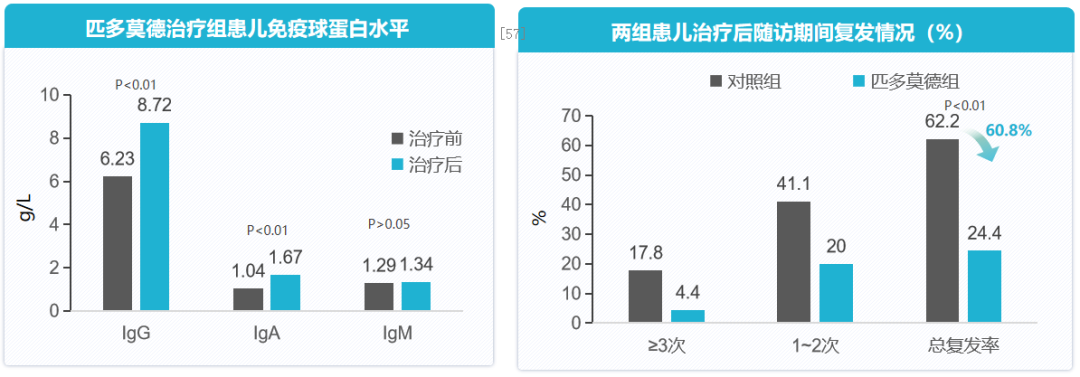
匹多莫德改善患儿免疫功能,减少呼吸道感染复发。一项前瞻性、随机对照研究,纳入180例反复呼吸道感染患儿,随机分为观察组和对照组各90例,旨在评价免疫调节剂匹多莫德对小儿反复呼吸道感染的临床症状和免疫功能的影响。对照组患儿在感染初期对症治疗,抗病毒治疗,可酌情增加抗生素。观察组在对照组基础上加用匹多莫德口服液,第1周400mg/次,2次/d;2周后改为1次/d,持续用药8周。随访12个月,观察并比较两组患儿治疗前后呼吸道感染频率、病程、临床症状及免疫功能。结论显示,在匹多莫德治疗下,反复呼吸道感染患儿免疫球蛋白IgG和IgA水平提升;随访期间呼吸道感染总复发率降低60.8%。[57]

因此,可以这样讲,如果哮喘患者ICS+免疫调节剂联合治疗,双管齐下,是可以改善当前的症状,也可以减少未来的风险。吸入激素可以修复上皮细胞,减轻气道炎症,免疫调节剂则可以调节气道免疫,纠正微生态的失衡。两者联合,可以共同帮助反复呼吸道感染的哮喘患者提升免疫防御能力、减轻气道炎症反应,减少将来呼吸道感染和哮喘发作的风险。[30、31、46、48、58、59]
总结:[15、16、19、25、32、33、36、46、49、50、54-57、60]
1、呼吸感染是哮喘管理的重点问题之一:哮喘患者呼吸道易感性增加,呼吸道感染又可诱发哮喘急性发作;
2、哮喘患者存在异常免疫炎症反应模式——免疫防御能力降低,促炎因子增加;
3、抗炎+免疫 优化反复呼吸道感染哮喘患者管理:
·ICS抗炎治疗:减轻哮喘气道炎症,保护气道上皮屏障;
·免疫治疗:调节免疫,减少炎症,预防反复呼吸道感染。
4、研究显示:
·ICS维持期治疗哮喘患儿3个月,与抗过敏治疗组相比,哮喘急性发作率下降82.9%(p=0.003),白天不咳嗽天数增加23.1%(p=0.014);
·在标准治疗基础上加用雾化吸入ICS,可显著降低中重度哮喘急性发作患儿的住院风险达43%(RR=0.57,95%CI ,0.39-0.85),显著降低需要使用全身糖皮质激素的风险达66% (RR=0.34,95%CI,0.21-0.55);
·细菌溶解产物相比安慰剂降低35.9%(MD=35.90%,95%CI, -49.46- -22.35)的儿童急性呼吸道感染发生率,减少儿童呼吸道感染2.33次/年(MD=2.33,95%CI, -2.75- -1.90);
·在ICS常规治疗基础上,联用细菌溶解产物治疗可显著减少反复呼吸道感染哮喘患儿呼吸道感染导致的喘息时间,并减少呼吸道感染4.3次/年(p<0.01);
·反复呼吸道感染患儿加用匹多莫德可,改善部分免疫球蛋白水平,减少呼吸道感染复发(62.2% vs 24.4%,p<0.01)。
参考资料
1. 伊娜,刘婷婷,周宇畅,et al.1990-2019年中国儿童青少年哮喘疾病负担分析[J].中华流行病学杂志,2023,44(2):235-242.doi:10.3760/cma.j.cn112338-20220526-00469.
2. Li X,Song P,Zhu Y,et al.The disease burden of childhood asthma in China: a systematic review and meta-analysis[J].Journal of Global Health,2020,10(1).
3. 全国儿科哮喘协作组,中国疾病预防控制中心环境与健康相关产品安全所.第三次中国城市儿童哮喘流行病学调查[J].中华儿科杂志,2013,51(10):729-735.
4. Hasegawa K,Bittner J C,Nonas S A,et al.Children and adults with frequent hospitalizations for asthma exacerbation,2012-2013:a multicenter observational study[J].The Journal of Allergy and Clinical Immunology:In Practice,2015,3(5):751-758.e1.
5. Castillo J R,Peters S P,Busse W W.Asthma Exacerbations:Pathogenesis,Prevention,and Treatment[J].J Allergy Clin Immunol Pract,2017,5(4):918-927.
6. O'Brian AL,Lemanske RF Jr,Evans MD,Gangnon RE,Gern JE,Jackson DJ.Recurrent severe exacerbations in early life and reduced lung function at school age.J Allergy Clin Immunol.2012 Apr;129(4):1162-4.
7. 林江涛,王文巧,周新,et al.我国30个省市城区门诊支气管哮喘患者控制水平的调查结果[J].中华结核和呼吸杂志,2017,40(7):494-498.
8. Eisner M D,Yelin E H,Katz P P,et al.Risk factors for work disability in severe adult asthma[J].Am J Med,2006,119(10):884-91.
9. Sears M R,Johnston N W.Understanding the September asthma epidemic[J].Journal of Allergy and Clinical Immunology,2007,120(3):526-529.
10. Juhn Y J.Risks for infection in patients with asthma (or other atopic conditions):is asthma more than a chronic airway disease?[J].The Journal of allergy and clinical immunology,2014,134(2):247-259.
11. 黄艳庆,陈萍,庄家用.早期呼吸道感染疾病与儿童哮喘发病关系的病例对照研究[J].中国儿童保健杂志,2012,20(7):648-650.
12. Kloepfer KM,Olenec JP,Lee WM,Liu G,Vrtis RF,Roberg KA,Evans MD,Gangnon RE,Lemanske RF Jr,Gern JE.Increased H1N1 infection rate in children with asthma.Am J Respir Crit Care Med. 2012 Jun 15;185(12):1275-9.
13. 彭健,黄荣宁.儿童支气管哮喘与肺炎支原体感染的关系[J].实用儿科临床杂志,2007,22(10):761,779.
14. Soto-Quiros M,Avila L,Platts-Mills TA,Hunt JF,Erdman DD,Carper H,Murphy DD,Odio S,James HR,Patrie JT,Hunt W,O'Rourke AK,Davis MD,Steinke JW,Lu X,Kennedy J,Heymann PW.High titers of IgE antibody to dust mite allergen and risk for wheezing among asthmatic children infected with rhinovirus.J Allergy Clin Immunol.2012 Jun;129(6):1499-1505.e5.doi: 10.1016/j.jaci.2012.03.040.Epub 2012 May 4.PMID:22560151;PMCID:PMC3792652.
15. Earl C S,An S-Q,Ryan R P.The changing face of asthma and its relation with microbes[J].Trends in Microbiology,2015,23(7):408-418.
16. Busse W W,Lemanske R F,Jr.,Gern J E.Role of viral respiratory infections in asthma and asthma exacerbations[J].Lancet (London, England),2010,376(9743):826-34.
17. Feddema J J,Claassen E.Prevalence of viral respiratory infections amongst asthmatics: Results of a meta-regression analysis[J].Respir Med, 2020,173:.
18. Hiemstra P S,Mccray P B,Jr.,Bals R.The innate immune function of airway epithelial cells in inflammatory lung disease[J].The European respiratory journal,2015,45(4):1150-1162. doi:10.1183/09031936.00141514.
19. Duchesne M,Okoye I,Lacy P.Epithelial cell alarmin cytokines:Frontline mediators of the asthma inflammatory response.Front Immunol.2022 Oct 14;13:975914.doi: 10.3389/fimmu.2022.975914.PMID: 36311787;PMCID: PMC9616080.
20. Roscioli E,Hamon R,Lester S,et al.Zinc-rich inhibitor of apoptosis proteins (IAPs) as regulatory factors in the epithelium of normal and inflamed airways[J].Biometals,2013,26(2):205-27.doi:10.1007/s10534-013-9618-2.
21. Robinson D,Humbert M,Buhl R,et al.Revisiting Type 2-high and Type 2-low airway inflammation in asthma:current knowledge and therapeutic implications[J].Clinical & Experimental Allergy,2017,47(2):161-175.
22. Ishmael F T.The Inflammatory Response in the Pathogenesis of Asthma[J],2011,111(s117):11-17.
23. Habib N,Pasha M A,Tang D D.Current Understanding of Asthma Pathogenesis and Biomarkers[J].Cells,2022,11(17):2764.
24. Invernizzi R,Lloyd C M,Molyneaux P L.Respiratory microbiome and epithelial interactions shape immunity in the lungs[J].Immunology,2020,160(2):171-182.doi:10.1111/imm.13195.
25. Budden K F,Shukla S D,Rehman S F,et al.Functional effects of the microbiota in chronic respiratory disease[J].Lancet Respir Med,2019,7(10):907-920.doi:10.1016/s2213-2600(18)30510-1.
26. Kim S R.Viral infection and airway epithelial immunity in asthma[J].International Journal of Molecular Sciences,2022,23(17):9914.
27. Contoli M,Message S D,Laza-Stanca V,et al.Role of deficient type III interferon-λ production in asthma exacerbations[J].Nature medicine,2006,12(9):1023-1026.
28. Ravanetti L,Dijkhuis A,Dekker T,et al.IL-33 drives influenza-induced asthma exacerbations by halting innate and adaptive antiviral immunity[J].Journal of Allergy and Clinical Immunology,2019,143(4):1355-1370.e16.
29. Préfontaine D,Nadigel J,Chouiali F,et al.Increased IL-33 expression by epithelial cells in bronchial asthma[J].Journal of Allergy and Clinical Immunology,2010,125(3):752-754.
30. Leung J S.Paediatrics:how to manage acute asthma exacerbations[J].Drugs Context,2021,10.
31. Dickson R P,Martinez F J,Huffnagle G B.The role of the microbiome in exacerbations of chronic lung diseases[J].Lancet (London,England),2014,384(9944):691-702.
32. Placha D,Jampilek J.Chronic Inflammatory Diseases,Anti-Inflammatory Agents and Their Delivery Nanosystems[J].Pharmaceutics,2021,13(1):64.
33. Barnes P J.Inhaled Corticosteroids[J].Pharmaceuticals (Basel),2010,3(3):514-540.
34. Duse M,Santamaria F,Verga M C,et al.Inter-society consensus for the use of inhaled corticosteroids in infants,children and adolescents with airway diseases[J].Italian Journal of Pediatrics,2021,47(1):97.
35. GINA 2023.
36. Zielen S,Rose MA,Bez C,Jarisch A,Reichenbach J,Hofmann D.Effectiveness of budesonide nebulising suspension compared to disodium cromoglycate in early childhood asthma.Curr Med Res Opin.2006 Feb;22(2):367-73.
37. Li CY,Liu Z.Effect of budesonide on hospitalization rates among children with acute asthma attending paediatric emergency department:a systematic review and meta-analysis.World J Pediatr.2021 Apr;17(2):152-163.
38. Castro-Rodriguez JA,Pincheira MA,Escobar-Serna DP,Sossa-Briceño MP,Rodriguez-Martinez CE.Adding nebulized corticosteroids to systemic corticosteroids for acute asthma in children:A systematic review with meta-analysis.Pediatr Pulmonol.2020 Oct;55(10):2508-2517.
39. CAMP.Long-Term Effects of Budesonide or Nedocromil in Children with Asthma[J].New England Journal of Medicine,2000,343(15):1054-1063.
40. gertoft L,Pedersen S.Effect of long-term treatment with inhaled budesonide on adult height in children with asthma[J].N Engl J Med,2000,343(15):1064-9.
41. Kearney S C,et al.Ann Allergy Asthma Immunol,2015,114(5):364-9.
42. 洪建国.中国实用儿科杂志,2013,28(03):165-168.
43. 各类药物说明书
44. 王丽英等.中国全科医学.2009,6489-90.
45. 王爱飞等.中国药物与临床.2012,12(11):1457-58.
46. Esposito S,Jones M H,Feleszko W,et al.Prevention of New Respiratory Episodes in Children with Recurrent Respiratory Infections:An Expert Consensus Statement[J].Microorganisms,2020,8(11):1810.doi:10.3390/microorganisms8111810.
47. Schaad U B,Esposito S,Razi C H.Diagnosis and Management of Recurrent Respiratory Tract Infections in Children:A Practical Guide[J].Arch Pediatr Infect Dis,2016,4(1):e31039.doi:10.5812/pedinfect.31039.
48. 中华医学会儿科学分会呼吸学组,《中华儿科杂志》编辑委员会.儿童支气管哮喘诊断与防治指南(2016年版)[J].中华儿科杂志,2016,54(3):167-181.
49. De Boer G M,Żółkiewicz J,Strzelec K P,et al.Bacterial lysate therapy for the prevention of wheezing episodes and asthma exacerbations:a systematic review and meta-analysis[J].Eur Respir Rev,2020,29(158).doi:10.1183/16000617.0175-2019.
50. Rossi G A,Pohunek P,Feleszko W,et al.Viral infections and wheezing-asthma inception in childhood:is there a role for immunomodulation by oral bacterial lysates?[J].Clinical and translational allergy,2020,10:17-17.
51. De Benedetto F,Sevieri G.Prevention of respiratory tract infections with bacterial lysate OM-85 bronchomunal in children and adults:a state of the art[J].Multidiscip Respir Med,2013,8(1):33.
52. Yin J,Xu B,Zeng X,et al.Broncho-Vaxom in pediatric recurrent respiratory tract infections:A systematic review and meta-analysis[J].International immunopharmacology,2018,54:198-209.
53. Razi C H,Harmancı K,Abacı A,et al.The immunostimulant om-85 BV prevents wheezing attacks in preschool children[J].Journal of allergy and clinical immunology,2010,126(4):763-769.
54. Del‐Rio‐Navarro B E,et al.Evidence‐Based Child Health:A Cochrane Review Journal,2012,7(2):629-717.
55. Lu Y,Li Y,Xu L,et al.Bacterial lysate increases the percentage of natural killer T cells in peripheral blood and alleviates asthma in children[J].Pharmacology,2015,95(3-4):139-44.
56. 蔡晓华.匹多莫德对支气管哮喘患儿免疫功能的影响及疗效分析[J].重庆医学,2014,43(12):1508-1511.
57. 马力忠,王桂兰,梁桂明,等.免疫调节剂对小儿反复呼吸道感染临床症状及免疫功能的影响[J].中国妇幼保健,2016.DOI:CNKI:SUN:ZFYB.0.2016-02-072.
58. 中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南(2020年版)[J].中华结核和呼吸杂志,2020,43(12):1023-1048. doi:10.3760/cma.j.cn112147-20200618-00721.
59. 中华医学会呼吸病学分会哮喘学组,中国哮喘联盟.支气管哮喘急性发作评估及处理中国专家共识[J].中华内科杂志,2018,57(1):4-14. doi:10.3760/cma.j.issn.0578-1426.2018.01.002.
60. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention (updated 2023)[EB/OL]. (May 2023). [2023-05-09]. https://ginasthma.org/wp-content/uploads/2023/05/GINA-2023-Full-Report-2023-WMS.pdf.
专家介绍

赵德育
南京医科大学附属儿童医院主任医师,教授,医学博士,博士研究生导师,现任南京医科大学附属儿童医院儿内科教研室主任、过敏诊疗中心主任,中华医学会儿科分会儿童“肺血管病协作组”副组长,中国医药质量管理协会儿科呼吸标准化诊治及质量控制委员会副主任委员,南京医学会儿科分会名誉主任委员,卫生部合理专家委员会儿童用药专家组专家,国家儿童医学中心呼吸专科联盟副组长,江苏省儿科联盟呼吸专业委员会组长,《中华儿科杂志》、《临床儿科杂志》、《儿科药学杂志》和《中国实用儿科杂志》编委。
*审批编号CN-130311 过期日期2025-2-23
*本材料由阿斯利康提供,仅供医疗卫生专业人士进行医学科学交流,不用于推广目的
本文由《呼吸界》编辑 冬雪凝 整理
本文完
责编:Jerry


