
一、呼吸道病毒爆发,慢阻肺病患者面临更高风险
最近,门诊遇到很多患者被感染,其中以病毒感染最为常见。回想22年末到23年初,在疫情放开时我们遇到的患者主要以新冠病毒感染为主,而今年又出现的一波高峰,病毒感染相对呈现多样性。经历了疫情放开后的首个秋冬季,呼吸道病毒感染呈现流行乱象,不仅有病毒,还有些非典型病原体。目前,以流感为主,此外还有鼻病毒、肺炎支原体、呼吸道合胞病毒、腺病毒等引起,可能是某一种感染存在,也可能是混合性感染存在。[1-3]
我们查看了CDC的数据,2023年2月中旬至4月底,我国呈现一波A(H1N1)亚型为主的流感流行季,22年底、23年初主要是新冠病毒,接下来是流感病毒,之后又是新冠和流感病毒的胶着,当前,自8月中下旬我国南方开始呈现一波A(H3N2) 亚型为主的流感流行,北方10月开始出现流行。12月下旬,这波流行达到高峰。[4-6]
前几年的新冠疫情逐渐“夺走了风头”。其实一个多世纪以来,流感对世界的经济政治等大事件上造成了影响,去年一年里,无论是南方还是北方,流感病毒都有非常明显的流行高峰。
大家是否认为新冠病毒销声匿迹了?哈佛大学公共卫生领域专家在《Science》发文,预测未来5年新冠病毒仍可能持续流行。人体对新冠病毒有免疫力,免疫力会维持一段时间。作者推测,新冠病毒在今后仍会有峰值叠加,变异株可能会越来越多,传播率加快,毒力可能会持续性下降。因此大家未来不能遗忘新冠病毒感染的可能。[7]
其实病毒感染并不那么可怕,因为许多病毒具有自限性,特别是在毒力下降的情况下,如果没有基础疾病或者免疫力较正常的群体,都会有自限的过程。
但我们不要忘记我国有庞大的慢性基础疾病和免疫抑制患者。这是王辰院士带领全国多中心团队完成的中国肺部健康研究2018年报告,显示我国COPD患者人数接近1亿,≥40岁人群COPD患病率为13.7%,较钟南山院士在2007年报告的8.2%,高出5.5%,这个数据还将持续上升。流行病学数据显示,年龄是非常重要的因素,年龄越大、患慢阻肺病的百分比就越高。我们现在已经逐渐进入人口老龄化阶段,这个比例仍在逐渐上升的过程中。全球疾病负担(GBD)2019年研究报告显示,中国COPD患者的死亡率居全球之首,COPD在我国共造成104万人死亡,位居死因排行第三位,仅次于脑卒中和缺血性心脏病。[8,9]
在呼吸道病毒大流行的背景下,无论是感染流感病毒还是新冠病毒,首当其冲受害的是呼吸道和肺。慢阻肺病患者必然面临更高风险,并且更容易被感染。一旦感染,病毒可能导致疾病急性加重,后果会更加严重。GOLD报告明确指出,病毒感染是慢阻肺病急性发作(AECOPD)的主要触发因素,几乎50%的AECOPD患者合并上呼吸道病毒感染,以前,病毒检测一直是流行病学的瓶颈,很多时候并不能完全检测到病毒,现在随着检测手段的增加,我们可以看到最常见病毒病原体为鼻病毒,其次是流感病毒、呼吸道合胞病毒、副流感病毒、冠状病毒、腺病毒等。[10,11]
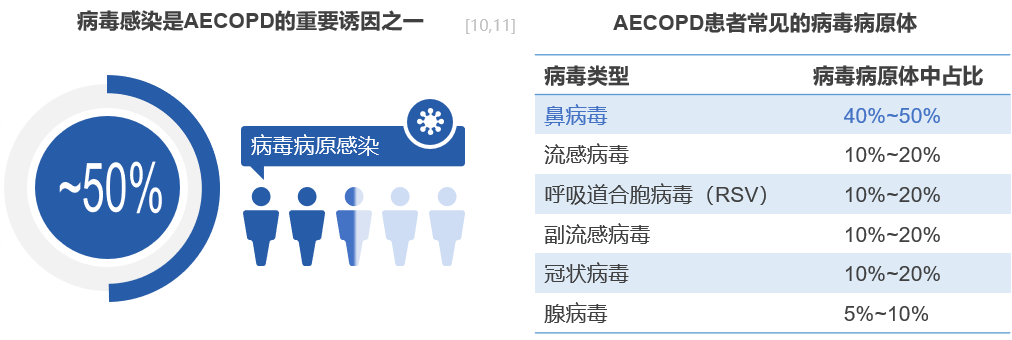
慢阻肺病患者存在气道上皮受损和炎症增强,呼吸道病毒感染后,气道上皮损伤和炎症加重,可诱发慢阻肺病急性加重,更容易雪上加霜。
病毒感染导致气道上皮防御功能受损:诱导气道上皮细胞凋亡,气道黏液分泌增加,气道纤毛清除能力下降,气道上皮连接受损;在此基础上,病毒激活NK-κB通路,诱导炎性细胞因子和趋化因子的产生,引起炎症细胞聚集,产生急性炎症反应;炎症反应导致的氧化应激和炎症细胞释放的炎症因子进一步激活气道上皮细胞及巨噬细胞NK-kB通路,加剧炎症反应,进而发生急性加重。[12-14]
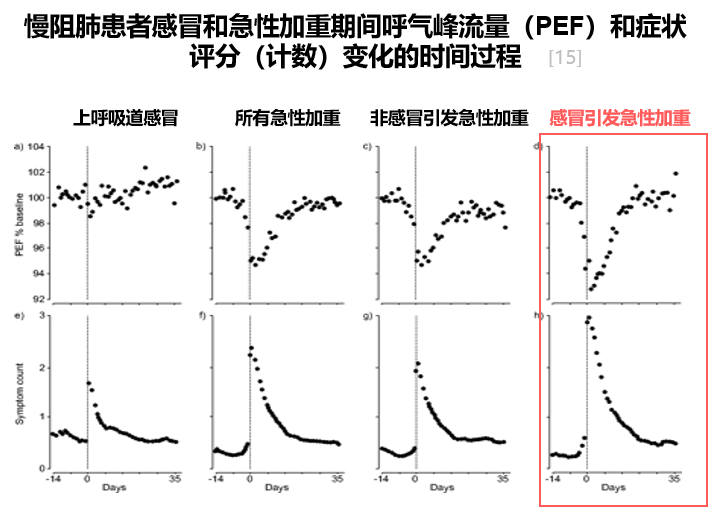
因此在呼吸道病毒大流行背景下,慢阻肺病患者往往面临更高风险。病毒导致的急性加重病情更重,它会导致肺功能破坏更加严重、症状更加严重、恢复时间更慢。而且呼吸道病毒感染后,继发细菌感染普遍存在,例如前段时间病毒流行后,又有非典型病原体感染,可能会再来一波其他病毒感染。这是由于患者的上皮屏障功能受损、免疫反应恶化,因此我们经常强调患者应尽量避免病毒感染导致急性加重。[15]
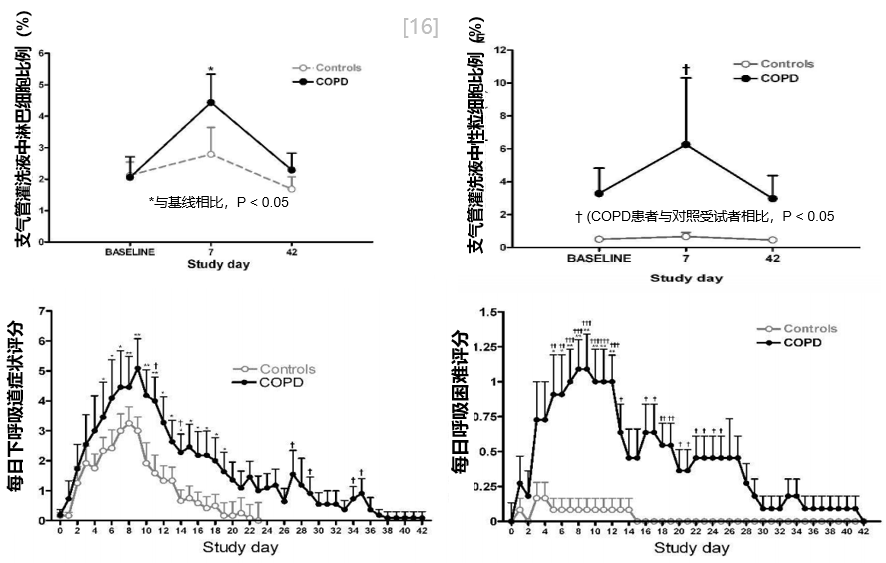
一项研究纳入13 名慢阻肺病患者和13名无阻塞对照受试者进行实验性鼻病毒感染。在感染过程中,虚线是对照组,实线的为COPD组。从支气管灌洗液中的淋巴细胞比例、中性粒细胞比例、下呼吸道症状评分和每日呼吸困难评分,慢阻肺病患者远远高于没有气道阻塞的患者,这表明他们的炎症活化更为明显,而且通常以中性粒细胞炎症为主,淋巴细胞也会活化。同时症状和呼吸困难时间会明显加重,持续时间也会明显延长。[16]
我们可以观察到,慢阻肺病患者的呼吸困难症状持续时间约为40天左右,肺功能通常在急性发作后6、8周内才可能恢复稳定,也有可能无法恢复正常反而进一步下降。因此对于慢阻肺病的患者,感染的后果更加严重,我们需要尽可能避免感染。
有句话是病毒搭台,细菌唱戏。慢阻肺病患者的上皮破坏更为明显,其固有免疫和适应性免疫受损更为严重,炎症因子活化更为明显。有时慢阻肺病患者肺功能差就是许多细菌如铜绿假单胞菌定植的高危因素,即他们在气道内部的细菌存在一定的定植。一旦有病毒感染,这些定植菌很容易转换成致病菌,从而导致病毒感染后的细菌感染。
研究显示,鼻病毒感染15天后,细菌负荷显著增加,流感嗜血杆菌增加尤为明显,可以持续到鼻病毒感染42天后。因此,在此基础上大家可以看到,慢阻肺病患者在病毒感染后可能还存在进一步的细菌感染或者其他混合感染。[17]
对于慢阻肺病患者,我们经常强调严控急性加重对于慢阻肺病患者而言非常关键,每一次急性加重事件都可能导致慢阻肺病患者的肺功能下降更快,从而导致死亡的产生。
一项研究进行了观察,与未发生急性加重者相比,出现0~1次、2次急性加重的慢阻肺病患者肺功能下降速度更快,可快37%、65%,这证明急性加重与肺功能下降有相关性。另一项研究纳入1990年-2005年来自加拿大魁北克的73106例慢阻肺病首次住院患者,随访至其死亡或2007年3月31日,随访17年间死亡病例为50580例,评估了慢阻肺病急性加重住院风险和全因死亡率。结果显示,慢阻肺病首次住院患者,3.6年内死亡率达50%,7.7年内死亡率达75%。因此我们尽可能要规避慢阻肺病急性加重。[18,19]
急性加重对慢阻肺病患者带来的沉重医疗和经济负担不言而喻。我们知道每次急性加重可能是致死性的,可能需要急诊、住院或者进入ICU。我国慢阻肺病患者过去1年内,超50%的患者存在急性加重门诊治疗经历(53.04%~53.20%),而需要急性加重住院治疗患者比例可达35.60%,疾病治疗需求突出;也面临着巨大的经济负担。全球慢阻肺病经济负担研究显示,我国慢阻肺病经济负担在全球范围内最重,将高达1.4万亿美元,占全球慢阻肺病总经济负担的32%。[20,21]
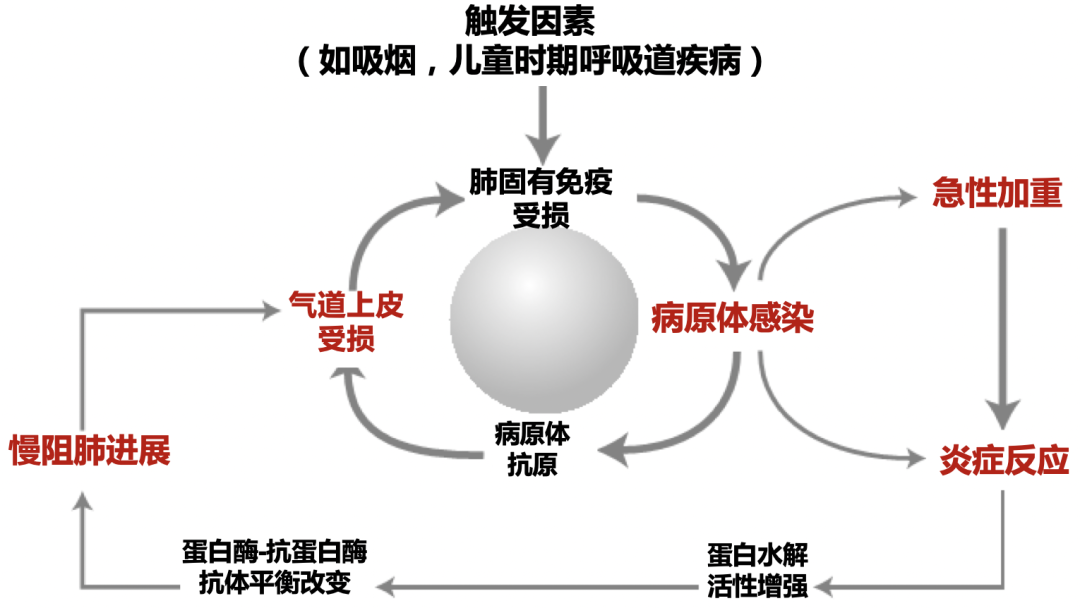
慢阻肺病患者的感染导致急性加重会形成慢阻肺病进展的恶性循环。气道上皮损伤和气道炎症导致对病原体防御的失败,允许病原体在呼吸道定植和感染;呼吸道病原体通过增强气道上皮损伤和气道炎症,进一步破坏肺部防御,使得慢性感染长期存在,形成恶性循环。这种互相加重可能从幼儿延续到成人,最终导致蛋白水解活性增强、蛋白酶-抗蛋白酶抗体平衡改变,进一步推动慢阻肺病进展。[22]
二、当前病毒大流行趋势下,慢阻肺病患者的药物治疗和预防
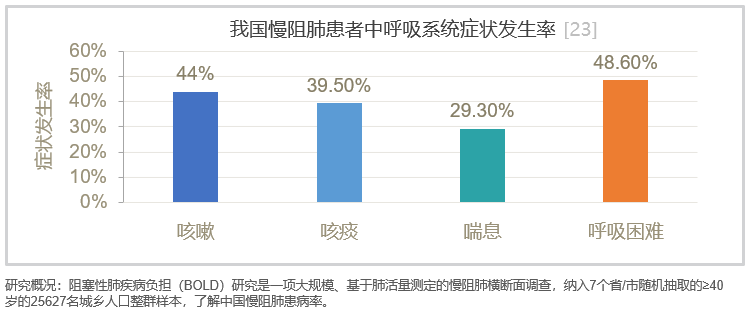
慢阻肺病患者临床表现特征主要涉及咳、痰、喘的呼吸道症状。在中国,呼吸困难症状最常见,接近50%的患者以呼吸困难为主要症状,BOLD研究对我国7省市慢阻肺病症状负担调查显示:大多数慢阻肺病患者(64.7%)面临呼吸系统症状困扰,如咳嗽(44%)、咳痰(39.5%)、喘息(29.3%)、呼吸困难(48.6%)等。[23]
我在门诊遇到过一位患者,他活动后有气促的症状,但他认为自己既然以前吸烟,出现这种症状也非常正常,他此次只是来看结节,并不认为自己需要对症状进行干预。虽然我向他提出需要进行肺功能,但是他仍然有些不理解需要进行肺功能检查的原因。
2017年多国慢阻肺病现状横向比较研究显示:相比欧洲和美国(20.5分和20.3分),我国慢阻肺病患者整体症状负担更高(24.4分);我国存在明显呼吸系统症状(CAT≥10分)患者比例高达98.2%,高于研究人群总体水平(90.4%)。[24]

为什么会这样?可以从慢阻肺病理机制来看,病毒、香烟烟雾和其他刺激物会激活气道上皮细胞和巨噬细胞分泌趋化因子,募集多种炎性细胞至肺部,这些炎症细胞如单核细胞、中性粒细胞和 T 淋巴细胞等,联同上皮细胞及巨噬细胞进一步释放炎性介质及蛋白酶,诱导成纤维细胞增殖导致小气道纤维化,释放的炎性介质及蛋白酶导致肺泡壁破坏(肺气肿)和黏液高分泌(慢性支气管炎),使得呼吸气流受阻,导致呼吸困难,并伴有气喘、咳嗽、咳痰、胸闷等症状。[25,26]
其实慢阻肺病症状的背后是气道炎症未得到非常好的控制,2023慢阻肺病急性加重诊治中国专家共识强调:气道炎症是慢阻肺病急性加重发病的关键机制。慢阻肺病患者存在一种特征性的气道炎症,即气道内中性粒细胞、巨噬细胞、T淋巴细胞和B淋巴细胞数量增加,这种炎症模式在急性加重期或由细菌/病毒感染引发急性加重时会被放大甚至进一步增加,一旦有病毒感染,它会使已活化的炎症反应进一步雪上加霜。
慢阻肺急性加重(AECOPD)定义中指出,AECOPD是一种急性事件,慢阻肺病患者呼吸困难和(或)咳嗽、咳痰症状加重,症状恶化发生在14d内,可能伴有呼吸急促和(或)心动过速,通常是因为呼吸道感染、空气污染造成局部或全身炎症反应加重,或者因损伤气道的其他原因所致。因此,抗炎是非常重要的治疗目标。[10,27,28]
西班牙EPOCAP研究显示,慢阻肺病急性加重患者中,88.7%的患者出现咳痰增多,87.5%的患者出现呼吸困难,64.4%的患者出现脓痰,43.5%的患者出现发热,咳、痰、喘的呼吸道症状是急性加重期间的主要临床表现。这预示着气道高分泌等问题是我们需要关注的焦点。[29]
对于慢阻肺病的急性加重,我们如何防治?首先在“治未病”状态,对于慢阻肺病的高危人群,我们需要加强疫苗接种;同时,我们有一些免疫调节药物,这些药物通过增加固有免疫和气道上皮IgA的活力,使COPD患者免于受到病毒侵害,或者在受到侵害后,整个炎症反应不会那么严重。
如果已经发生了病毒感染,那么目前还有抗病毒药物。在这里特别强调,不推荐 AECOPD 患者进行经验性抗流感病毒治疗,包括鼻病毒,我们仍然需要结合临床特征性表现,最好有PCR检测结果等。因为气道阻塞会更严重,所以推荐慢阻肺病急性加重的患者使用支气管舒张剂。既然抗炎的基础是炎症,那么目前吸入糖皮质激素是最重要的抗炎治疗,必要时还需要使用全身糖皮质激素。对于慢阻肺病患者,我们主要关注支气管舒张、抗炎以及抗病毒和抗细菌。很多急性加重主要以痰液分泌多为主,祛痰药也是我们非常重要的防治策略。[10,30,31]
多种途径预防呼吸道感染,减少慢阻肺病急性加重风险,例如先接种疫苗、使用免疫调节剂等。疫苗接种通常包括一些相关常见疫苗,可以预防病原体感染、激活主动免疫。同时,还有免疫调节剂,包括细菌溶解产物和具有抗炎作用的抗菌药物等,它们都具有一定的免疫调节功能。
对于病毒感染,如果大家有依据,那么应该尽快进行抗病毒感染,包括抗流感病毒和抗新冠病毒。目前我们不推荐经验性的抗病毒治疗。
在疫苗接种方面,GOLD 建议慢阻肺病患者应根据相关指南接受所有推荐的疫苗接种,这样可以有效预防病毒感染,并且具有许多循证依据。美国CDC曾经表示,接种流感疫苗会使流感发生率明显下降;世界卫生组织和美国疾病控制中心 (CDC) 建议接种 SARS-CoV-2 疫苗;其他还包括呼吸合胞病毒疫苗和带状疱疹疫苗,这些疫苗可以用于保护年龄相对较大的慢阻肺病患者。

免疫调节剂更加方便,包括口服和注射,GOLD报告提及两项使用免疫调节剂治疗慢阻肺病患者的随机对照研究,结果显示可以降低慢阻肺病急性加重的严重程度和频率。鉴于气道微生物定植和感染在慢阻肺病的发生、发展过程中发挥着重要作用,因此给予免疫调节剂治疗以改善慢阻肺病患者机体免疫力、抗感染能力可能是防治慢阻肺病的新途径。[30,32]
抗病毒治疗的原则是越早越好,如果有明确的临床依据,例如抗原或者核酸检测的依据,建议尽早进行抗病毒治疗。
抗病毒治疗中还有一句话:虽然越早越好,但是never too late。如果明确了感染,即便两天以后再进行抗病毒治疗,它仍然可以帮助患者改善症状,同时相对减轻急性加重后续的炎症反应。因此我们认为抗病毒治疗应该“该出手时就出手”,及时采取措施。
对于急性加重患者的支气管舒张剂治疗,雾化吸入短效β2 受体激动剂,或短效β2 受体激动剂-短效抗胆碱能联合制剂是 AECOPD 患者的主要治疗方案,患者如果存在青光眼或者前列腺增生,需要注意权衡利弊。
糖皮质激素的抗炎方面,它可以分为局部和全身两部分,AECOPD 患者全身应用糖皮质激素可缩短康复时间,改善肺功能 (如 FEV1) 和氧合,降低早期反复住院和治疗失败的风险,缩短住院时间,应用疗程一般为5~7天;轻度AECOPD门诊患者不推荐全身激素治疗;中重度AECOPD需要住普通病房或监护病房患者,建议雾化或全身糖皮质激素,单独应用或联合应用。
慢阻肺病急性加重的患者通常是高龄患者,有骨质疏松或糖尿病,大家如果认为全身应用糖皮质激素的弊可能会大于利,雾化是一个非常好的方法,另外,适当降低全身糖皮质激素的给药量、联合雾化,对于中重度患者来说也是非常好的个体化糖皮质激素给药方式。
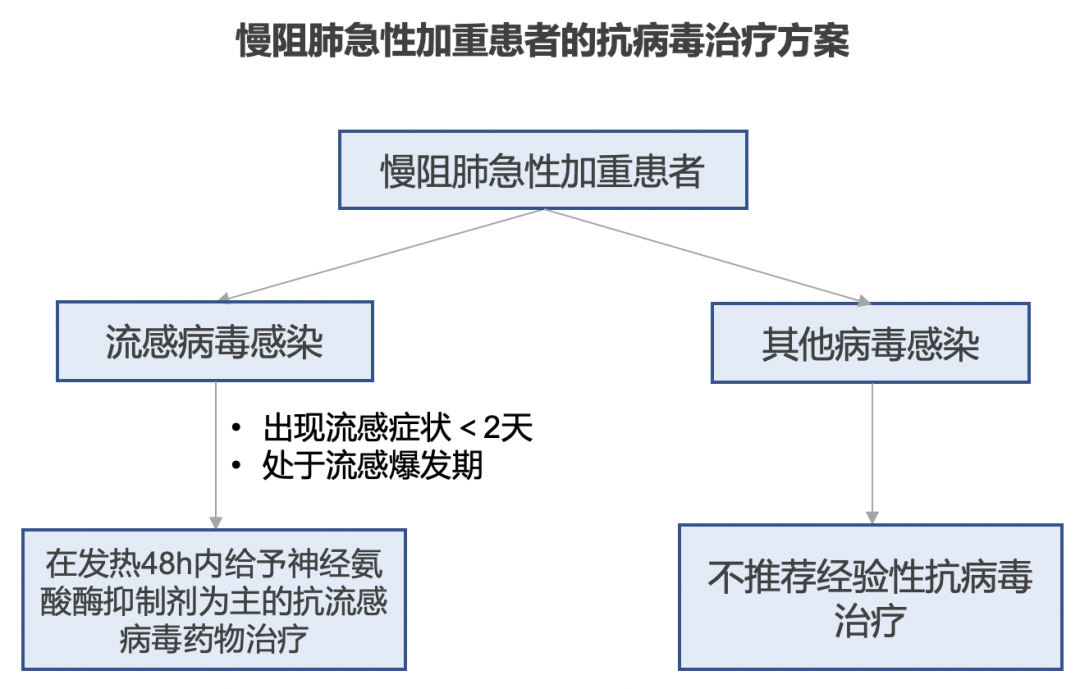
对于抗感染药物,尤其是对于肺功能相对较差的慢阻肺病患者和有脓痰的患者。如果抗菌治疗有足够依据,那么建议进行抗菌治疗,并且需要根据是否有结构破坏来判断是否合并铜绿,还是仅为单纯细菌感染,以便选择合适的药物。对于病毒感染方面,不推荐 AECOPD 患者进行经验性抗流感病毒治疗,包括鼻病毒。仅在出现流感症状时间<2 d 并且正处于流感暴发时期的 AECOPD 高危流感患者方可尝试使用。[10,33]
同时,我们需要重点监测患者的氧饱和度。由于新冠经历,大家已经非常接受氧饱和度的监测。对于慢阻肺病患者,我们需要监测氧饱和度、家中备有制氧机,这对于缺氧患者可以非常好地改善全身氧合,氧疗是 AECOPD 的基础治疗,可进行控制性氧疗和经鼻高流量湿化氧疗 (HFNC),无创机械通气可作为AECOPD 呼吸衰竭首选呼吸支持策略,能降低气管插管率、病死率,缩短住院时间及ICU时间。
对于支气管舒张剂来说,短效吸入性β2 受体激动剂(SABA)慢阻肺病急性加重首选支气管舒张剂,联合或不联合短效胆碱能受体拮抗剂(SAMA)推荐作为治疗急性加重治疗的首选支气管扩张剂。对于患者,长效支气管舒张剂出院前即开始预防再次急性加重。我们所使用的吸入药物大多是干粉剂,即使是气雾剂,也需要一定的吸气流速配合。但在慢阻肺病急性加重时,患者的吸气流速会明显下降。这时,雾化因为只需要平静呼吸,所以会有更好的肺部沉积率。患者出院回家后可以继续雾化,同时也可以给予吸入治疗,这样患者可以更便捷用药。
目前已经明确不推荐使用茶碱类药物,因为担心其有严重的副作用。使用糖皮质激素抗炎是一个非常重要的措施,它的给药途径分为:雾化吸入(ICS)及全身给药(包括口服及静脉);轻度慢阻肺病急性加重门诊患者不推荐全身激素治疗;中重度慢阻肺病急性加重需要住普通病房或监护病房患者,建议雾化或全身糖皮质激素,单独应用或联合应用。
对于全身给药糖皮质激素,住院患者宜在应用支气管舒张剂的基础上加用糖皮质激素治疗,能正常进食的患者建议口服用药,对于雾化吸入糖皮质激素(ICS),非危重患者在应用短效支气管舒张剂雾化治疗的基础上联合雾化 ICS 治疗,疗程 10~14 d。[10,34]

关于慢阻肺病急性加重的抗菌治疗应关注应用指征,大家在慢阻肺病的急性加重抗菌治疗方面应该比较有心得。例如,看到脓性痰、感染指标加重、高危因素或者结构性病变等,我们会根据患者的情况进行个体化治疗。对于慢阻肺病患者,例如长期使用糖皮质激素的患者,不要忘记真菌感染的风险;对于常见的阳性菌,例如肺炎链球菌,由于这些患者往往有反复应用抗菌药物的病史,也不要忘记可能存在耐药菌的产生。
10-20%慢阻肺病急性加重者对初始经验抗菌治疗反应不佳,原因可能有多种,1.进行有创机械通气治疗的患者并发院内感染;2.初始抗菌治疗未覆盖引起感染的病原微生物,如铜绿假单胞菌、金黄色葡萄球菌(包括耐甲氧西林金黄色葡萄球菌)、不动杆菌和其他非发酵菌等;3.长期使用糖皮质激素的患者可能发生真菌感染;4.引起感染的细菌可能为高度耐药的肺炎链球菌。
此外,气道黏液高分泌在慢阻肺病进展和呼吸道感染中具有重要作用,它是呼吸系统疾病常见临床表现、在慢阻肺疾病进展中扮演重要角色,气道黏液分泌过多会阻塞气道,导致气流受限,降低患者肺功能,也容易引起细菌定值、造成感染,同时炎症反应可降低纤毛清除能力,这两者会导致气道反复感染,进一步加重气道阻塞及气道重塑。[35-37]
因此需要管理和治疗,祛痰药可用于气道黏液高分泌的慢阻肺病患者,减少急性发作风险,目前祛痰药及抗氧化剂的应用可促进黏液溶解,有利于气道引流通畅,改善通气功能。对于有气道黏液高分泌的慢阻肺病患者,无论稳定期评估分组如何,均可在起始治疗中加用祛痰剂;临床常用祛痰抗氧化药物主要有:N‐乙酰半胱氨酸(NAC)、羧甲司坦、厄多司坦、福多司坦和氨溴索等。[10,31]
三、雾化治疗在慢阻肺病患者管理中的独特优势
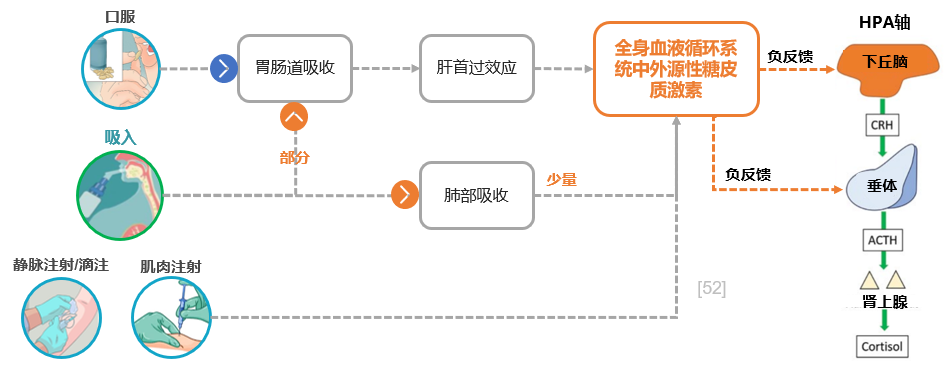
最后,我们讨论给药方式。我们需要使用支气管舒张剂、抗炎药物以及减少气道高分泌的药物,给药方式是口服、静脉还是吸入呢?呼吸科有一个与众不同的地方,即采用独特的雾化给药。与口服、静脉注射等全身性给药相比,雾化吸入给药靶向肺部抗炎,药物集中在气道和肺部,且进入全身血液循环的激素较少,可避免严重全身不良反应,安全性良好。[38,39]
肺的特点是可供药物吸收面积大、血管床丰富、液体交换能力大、肺泡上皮非常薄(~0.1 -0.5μm),吸收迅速、较低的全身效应、治疗效价高;雾化吸入的优势在于可同时辅助供氧、直接到达靶器官,起效迅速,肺部利用度高、全身生物利用度低,不良反应小,而且潮式呼吸即有效,无需患者刻意配合,在慢阻肺病缺氧的情况下、急性发作患者气流非常短促的情况下,可以保证局部高剂量,联合给药。[40]
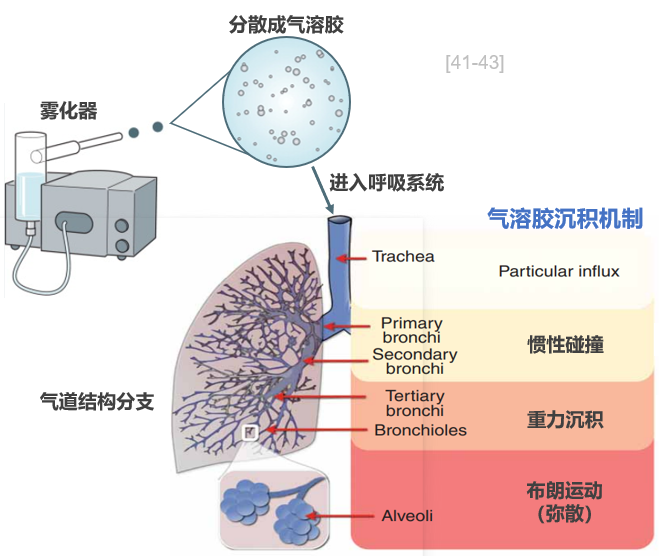
雾化吸入疗法用专门装置将吸入药物分散成气溶胶形式(通常粒径为 0.01~10.00 μm),吸气时气溶胶随气流进入呼吸系统,气溶胶粒径为1.0~5.0 μm时较为适宜,可达中间气道及以下(支气管),故可广泛应用多种呼吸系统疾病的治疗。气溶胶粒径>5μm时可达中央气道(气管和支气管),但绝大多数在口咽部沉积,最终经吞咽进入体内,<0.5μm时能达到末梢气道,部分在肺泡沉积,但90%微粒随呼气排出体外,因此0.5~5μm较为适宜,可达中间气道及以下(支气管)。[41-43]
慢阻肺病患者具有独特困难,患者在老年人中发病率高,生理机能普遍下降,气雾剂是需要手口协调的,身体状况不佳或认知、神经肌肉或通气障碍的患者可能很难使用手持式吸入装置,因而无法有效递送药物。另外,干粉剂需要一定的吸气流速,但慢阻肺病患者在急性发作、呼吸非常短促的情况下,通过这种方式给药有一定弊端,不能确保药物沉积率。因此研究显示,吸气峰流速<60L/min慢阻肺病患者,雾化吸入治疗(ICS+LABA+SAMA)相比干粉吸入,与再住院率降低、到再次发作时间延长显著相关。[8,44-46]
在慢阻肺病急性加重期,病情较轻门诊患者及病情较重需住院患者均可采用雾化吸入治疗,即便在急性发作刚刚结束,肺功能还没有恢复的情况下,雾化也是一个非常好的过渡方式;在慢阻肺病稳定期:雾化吸入对于部分年老体弱、吸气流速较低、疾病严重程度较重、使用干粉吸入器存在困难的患者可能是更佳选择。[47]
雾化吸入支气管舒张剂是慢阻肺病急性加重患者的主要治疗方案,2016年一项Meta分析纳入了8项RCT研究共250例参与者,比较了雾化器与加压定量吸入器 (pMDI)加储雾器治疗在慢阻肺病恶化中的效果,评估了支气管舒张剂不同给药方式在慢阻肺病急性加重时的疗效影响,发现相比pMDI给药方式,雾化吸入SABA治疗有利于早期(给药后1h)FEV1改善(95%CI=82.98 [10.30,155.67],p=0.03);相比pMDI给药方式,雾化吸入SABA治疗慢阻肺病急性加重患者的FEV1改善值相差高达83mL。[10,48-51]
前面提到的是舒张药物,接下来讨论抗炎药物。ICS局部给药,疗效更佳且全身不良反应少,与全身糖皮质激素相比,雾化 ICS不良反应较小,可以替代或部分替代全身糖皮质激素;在慢阻肺病急性加重期,推荐雾化ICS可以替代或部分替代全身激素(2C);推荐在非危重患者中应用雾化 ICS,建议在应用短效支气管舒张剂雾化治疗的基础上联合雾化 ICS 治疗,疗程 10~14 d;重症患者特别是有创通气或无创通气患者,雾化 ICS也可以取得一定的疗效;雾化ICS可作为急性加重期全身糖皮质激素的序贯治疗,使治疗效果延续,有效减小因糖皮质激素撤停而导致的急性加重再发的高风险,改善慢阻肺病患者临床症状,增加治愈成功率。[31,34,52]
荟萃分析显示,雾化吸入ICS与使用全身激素相比,对慢阻肺病急性加重患者肺功能和SaO2的全程改善无显著差异;真实世界研究显示,雾化吸入ICS临床预后与全身激素相似,并减少医疗花费,然而,这是一个不干预治疗方案环境下,医生的判断可能会存在倾向性,因此,大家需要谨慎看待这项研究。[53,54]
此外慢阻肺病患者咳痰问题突出,即气道高分泌问题。《雾化祛痰临床应用的中国专家共识》推荐意见认为,对于症状较重(CAT≥10)、痰多的稳定期慢阻肺病患者,以及痰量较多的慢阻肺病急性加重患者,在常规治疗基础上,建议增加N-乙酰半胱氨酸或氨溴索雾化吸入以促进痰液排出。[55,56]
一项体外试验以临床呼吸系统疾病患者清晨浓稠痰液作为研究对象,在标准的试验室环境下应用0.9%氯化钠注射液(1.0 mL)、氨溴索溶液(2mL:15mg,0.5、1.0 mL)和NAC溶液(3mL:300mg,0.5、1.0 、1.5、2.0 mL)溶解痰液,探讨临床常见祛痰药对慢性呼吸系统疾病患者的体外痰液的溶解速度、效果以及痰液黏滞度的改善效果。结果显示:相比0.9%氯化钠注射液组,祛痰药可以溶解慢性呼吸系统疾病患者的浓稠痰液痰液,增加其流动性并降低痰液黏度。[57]

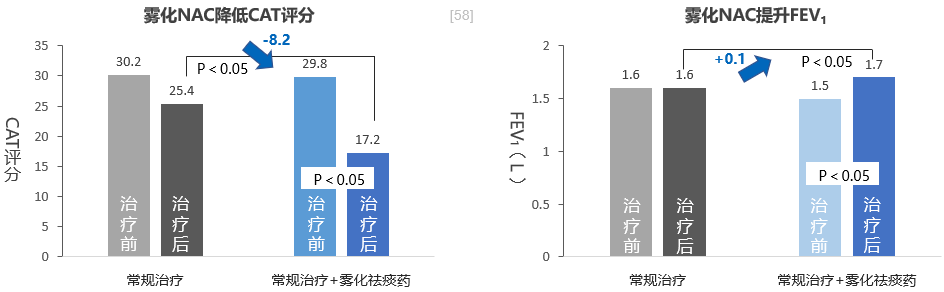
一项随机、对照研究,纳入100例慢阻肺病急性加重患者,50例给予氧疗、止咳、平喘、抗感染、应用糖皮质激素、纠正酸碱平衡等常规治疗;50例在常规治疗的基础上雾化吸入祛痰药(N-乙酰半胱氨酸,每次0.3g,每日2次)治疗10天,观察雾化吸入祛痰药治疗慢阻肺病急性加重的临床疗效。结果显示,相比常规治疗,常规治疗+雾化吸入祛痰药治疗后,慢阻肺病急性加重患者CAT评分降低8.2分,FEV1增加0.1 L。[58]
另一个重要点是慢阻肺病患者在家庭雾化,在呼吸道病毒感染流行背景下,在家庭雾化更安心,如果感染时再去医院或病房,很容易出现交叉感染。因此,在这种情况下,如果家里有雾化条件,一方面能够享受到相对安全隔离的环境,并且可以得到相对治疗。许多欧美国家,家庭雾化已在慢阻肺病患者中推广应用,在亚太地区,家庭雾化也越来越深入人心。使用雾化吸入治疗时,需关注雾化吸入药物的配伍,避免“贪容易”将雾化药物混合在一起使用。[59,60]
下图为雾化吸入药物的配伍相容性,可以看到,具有稳定性和相容性的药物配伍并不多。[40]
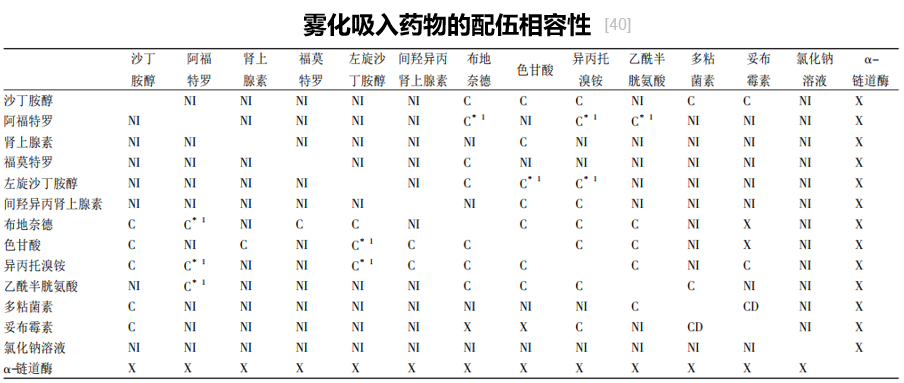
图:C: 有临床研究确证特定混合物的稳定性和相容性; *1C: 来自生产厂家的报告确证特定混合物的稳定性和相容性,在许多情况下,这些例子不适用于综述,通过包装内的说明或与厂家直接沟通确认;X: 有证据确认或建议,特定混合物不能配伍;NI: 评价配伍稳定性证据不充分,除非将来有证据证明可行;CD: 配伍稳定性数据有争议。
参考文献
[1]https://mp.weixin.qq.com/s/qnylV3jqjbzMD3J2WZM0fA(2023-12-22访问)
[2]http://www.nhc.gov.cn/xwzb/webcontroller.do?titleSeq=11532&gecstype=1中华人民共和国国家卫生健康委员会官网(2023-12-22访问)
[3]https://tv.cctv.com/lm/xwlb/央视网新闻联播(2023-12-22访问))
[4]中国流感疫苗预防接种技术指南(2023-2024)
[5]中国疾病预防控制中心-国家流感中心-流感周报(2023年第50周)
[6]中国疾病预防控制中心-新型冠状病毒感染-全国新型冠状病毒感染疫情情况(访问日期:2023年12月27日)
[7]Kissler S M, Tedijanto C, Goldstein E, et al. Projecting the transmission dynamics of SARS-CoV-2 through the postpandemic period[J]. Science, 2020, 368(6493): 860-868.
[8]Wang C, Xu J, Yang L, et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study): a national cross-sectional study[J]. Lancet (London, England), 2018, 391(10131): 1706-1717. doi:10.1016/s0140-6736(18)30841-9.
[9]Zhou M, Wang H, Zeng X, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. The Lancet, 2019, 394(10204): 1145-1158. doi:10.1016/S0140-6736(19)30427-1.
[10]慢性阻塞性肺疾病急性加重诊治专家组. 慢性阻塞性肺疾病急性加重诊治中国专家共识(2023年修订版)[J]. 国际呼吸杂志, 2023, 43(2): 132-149. doi:10.3760/cma.j.cn131368-20221123-01066.
[11]Siddiqi A, Sethi S. Optimizing antibiotic selection in treating COPD exacerbations[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2008, 3: 31-44. doi:10.2147/COPD.S1089.
[12]Guo-Parke H, Linden D, Weldon S, et al. Mechanisms of Virus-Induced Airway Immunity Dysfunction in the Pathogenesis of COPD Disease, Progression, and Exacerbation[J]. Frontiers in Immunology, 2020, 11.
[13]Rovina N, Koutsoukou A, Koulouris N G. Inflammation and Immune Response in COPD: Where Do We Stand?[J]. Mediators of Inflammation, 2013, 2013: 413735.
[14]Linden D, Guo-Parke H, Coyle P V, et al. Respiratory viral infection: a potential “missing link” in the pathogenesis of COPD[J]. European Respiratory Review, 2019, 28(151): 180063.
[15]Hurst J R, Donaldson G C, Wilkinson T M A, et al. Epidemiological relationships between the common cold and exacerbation frequency in COPD[J]. European Respiratory Journal, 2005, 26(5): 846-852. doi:10.1183/09031936.05.00043405.
[16]Mallia P, Message S D, Gielen V, et al. Experimental rhinovirus infection as a human model of chronic obstructive pulmonary disease exacerbation[J]. Am J Respir Crit Care Med, 2011, 183(6): 734-42. doi:10.1164/rccm.201006-0833OC.
[17]Mallia P, et al. Rhinovirus infection induces degradation of antimicrobial peptides and secondary bacterial infection in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2012;186:1117–24.
[18]Celli B R, Thomas N E, Anderson J A, et al. Effect of pharmacotherapy on rate of decline of lung function in chronic obstructive pulmonary disease: results from the TORCH study[J]. Am J Respir Crit Care Med, 2008, 178(4): 332-8. doi:10.1164/rccm.200712-1869OC.
[19]Suissa S, Dell'aniello S, Ernst P. Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality[J]. Thorax, 2012, 67(11): 957-963. doi:10.1136/thoraxjnl-2011-201518.
[20]Zhu B, Wang Y, Ming J, et al. Disease burden of COPD in China: a systematic review[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2018, 13: 1353-1364. doi:10.2147/COPD.S161555.
[21]Chen S, Kuhn M, Prettner K, et al. The global economic burden of chronic obstructive pulmonary disease for 204 countries and territories in 2020-50: a health-augmented macroeconomic modelling study[J]. Lancet Glob Health, 2023, 11(8): e1183-e1193. doi:10.1016/s2214-109x(23)00217-6.
[22]Sethi S, Murphy T F. Infection in the pathogenesis and course of chronic obstructive pulmonary disease[J]. N Engl J Med, 2008, 359(22): 2355-65. doi:10.1056/NEJMra0800353.
[23]Zhong N, Wang C, Yao W, et al. Prevalence of chronic obstructive pulmonary disease in China: a large, population-based survey[J]. Am J Respir Crit Care Med, 2007, 176(8): 753-60. doi:10.1164/rccm.200612-1749OC.
[24]Ding B, Small M, Bergström G, et al. COPD symptom burden: impact on health care resource utilization, and work and activity impairment[J]. Int J Chron Obstruct Pulmon Dis, 2017, 12: 677-689. doi:10.2147/copd.S123896.
[25]Brunton L L, Hilal-Dandan R, Knollmann B C: Goodman & Gilman's: The Pharmacological Basis of Therapeutics, 13e, Goodman & Gilman's: The Pharmacological Basis of Therapeutics, 13e, New York, NY: McGraw-Hill Education, 2017.
[26]Barnes P J. Similarities and differences in inflammatory mechanisms of asthma and COPD[J]. Breathe, 2011, 7(3): 229. doi:10.1183/20734735.026410.
[27]Wedzicha J A, Seemungal T A. COPD exacerbations: defining their cause and prevention[J]. Lancet (London, England), 2007, 370(9589): 786-96. doi:10.1016/s0140-6736(07)61382-8.
[28]Barnes P J. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease[J]. J Allergy Clin Immunol, 2016, 138(1): 16-27. doi:10.1016/j.jaci.2016.05.011.
[29]Murio C, Soler X, Pérez M, et al. Acute exacerbation of chronic obstructive pulmonary disease in primary care setting in Spain: the EPOCAP study[J]. Ther Adv Respir Dis, 2010, 4(4): 215-23. doi:10.1177/1753465810374611.
[30]GOLD 2024 report
[31]中华医学会呼吸病学分会慢性阻塞性肺疾病学组, 中国医师协会呼吸医师分会慢性阻塞性肺疾病工作委员会. 慢性阻塞性肺疾病诊治指南(2021年修订版)[J]. 中华结核和呼吸杂志, 2021, 44(3): 170-205. doi:10.3760/cma.j.cn112147-20210109-00031.
[32]《慢性阻塞性肺疾病免疫调节治疗专家共识》撰写组. 慢性阻塞性肺疾病免疫调节治疗专家共识[J]. 中国全科医学, 2022, 25(24): 2947-2959. doi:10.12114/j.issn.1007-9572.2022.0384.
[33]慢性阻塞性肺疾病急性加重抗感染治疗中国专家共识编写组. 慢性阻塞性肺疾病急性加重抗感染治疗中国专家共识[J]. 国际呼吸杂志, 2019, 39(17):1281-1296.
[34]慢性阻塞性肺疾病糖皮质激素规范管理撰写组. 慢性阻塞性肺疾病糖皮质激素规范管理专家共识(2021版)[J]. 中华结核和呼吸杂志, 2021, 44(12): 1054-1063. doi:10.3760/cma.j.cn112147-20210802-00543.
[35]刘又宁, 曹彬, 王辉, 等. 中国九城市成人医院获得性肺炎微生物学与临床特点调查[J]. 中华结核和呼吸杂志, 2012 (2012 年 10): 739-746.
[36]Shen Y, Huang S, Kang J, et al. Management of airway mucus hypersecretion in chronic airway inflammatory disease: Chinese expert consensus (English edition)[J].
[37]Rogers D F, Barnes P J. Treatment of airway mucus hypersecretion[J]. Ann Med, 2006, 38(2): 116-25. doi:10.1080/07853890600585795.
[38]Williams D M. Clinical Pharmacology of Corticosteroids[J]. Respiratory Care, 2018, 63(6): 655-670. doi:10.4187/respcare.06314.
[39]Duse M, Santamaria F, Verga M C, et al. Inter-society consensus for the use of inhaled corticosteroids in infants, children and adolescents with airway diseases[J]. Italian Journal of Pediatrics, 2021, 47(1): 97. doi:10.1186/s13052-021-01013-8.
[40]中华医学会临床药学分会«雾化吸入疗法合理用药专家共识»编写组. 雾化吸入疗法合理用药专家共识(2019年版)[J]. 医药导报, 2019, 38(2): 135-146. doi:10.3870/j.issn.1004-0781.2019.02.001.
[41]Douafer H, Andrieu V, Brunel J M. Scope and limitations on aerosol drug delivery for the treatment of infectious respiratory diseases[J]. Journal of Controlled Release, 2020, 325: 276-292. doi:10.1016/j.jconrel.2020.07.002.
[42]Klinger-Strobel M, Lautenschläger C, Fischer D, et al. Aspects of pulmonary drug delivery strategies for infections in cystic fibrosis--where do we stand?[J]. Expert Opin Drug Deliv, 2015, 12(8): 1351-74. doi:10.1517/17425247.2015.1007949.
[43]Gregory K L, Wilken L, Hart M K. Pulmonary disease: aerosol delivery devices; A Guide for Physicians, Nurses, Pharmacists, and Other Health Care Professionals — 3rd Edition. [M]. Irving: American Association for Respiratory Care, 2017.
[44]Incalzi R A, Scarlata S, Pennazza G, et al. Chronic Obstructive Pulmonary Disease in the elderly[J]. European Journal of Internal Medicine, 2014, 25(4): 320-328. doi:10.1016/j.ejim.2013.10.001.
[45]Barjaktarevic I Z, Milstone A P. Nebulized Therapies in COPD: Past, Present, and the Future[J]. Int J Chron Obstruct Pulmon Dis, 2020, 15: 1665-1677. doi:10.2147/copd.S252435.
[46]Loh C H, Peters S P, Lovings T M, et al. Suboptimal inspiratory flow rates are associated with chronic obstructive pulmonary disease and all-cause readmissions[J]. Annals of the American Thoracic Society, 2017, 14(8): 1305-1311.
[47]中华医学会呼吸病学分会《雾化吸入疗法在呼吸疾病中的应用专家共识》制定专家组. 中华医学杂志, 2016, 96(34).
[48]Pratter M R, Brightling C E, Boulet L P, et al. An empiric integrative approach to the management of cough: ACCP evidence-based clinical practice guidelines[J]. CHEST Journal, 2006, 129(1_suppl): 222S-231S.
[49]胡茂霞. 雾化吸入特布他林治疗慢性阻塞性肺病急性发作的疗效观察及护理[J]. 中国医药指南, 2010, 8(30): 309-310. doi:10.3969/j.issn.1671-8194.2010.30.243.
[50]吴炬, 王开云, 阳凤华, et al. 博利康尼及异丙托溴胺氧驱雾化吸入治疗慢性阻塞性肺病急性加重期疗效观察[J]. 西部医学, 2010, 22(6): 1037-1038. doi:10.3969/j.issn.1672-3511.2010.06.024.
[51]Van Geffen W H, Douma W R, Slebos D J, et al. Bronchodilators delivered by nebuliser versus pMDI with spacer or DPI for exacerbations of COPD[J]. The Cochrane database of systematic reviews, 2016, 2016(8): Cd011826. doi:10.1002/14651858.CD011826.pub2.
[52]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency[J]. BMJ, 2021, 374: n1380. doi:10.1136/bmj.n1380.
[53]Gu Y L, Pang J, Sun Z X, et al. Comparative efficacies of nebulized budesonide and systemic corticosteroids in the treatment of exacerbations of chronic obstructive pulmonary disease: A systematic review and meta-analysis[J]. J Clin Pharm Ther, 2020, 45(3): 419-429. doi:10.1111/jcpt.13095.
[54]Ding Z, Li X, Lu Y, et al. A randomized, controlled multicentric study of inhaled budesonide and intravenous methylprednisolone in the treatment on acute exacerbation of chronic obstructive pulmonary disease[J]. Respiratory Medicine, 2016, 121:39-47
[55]中华医学会呼吸病学分会. 雾化祛痰临床应用的中国专家共识[J]. 中华结核和呼吸杂志, 2021, 44(04): 340-348.
[56]Hogg J C, Chu F, Utokaparch S, et al. The nature of small-airway obstruction in chronic obstructive pulmonary disease[J]. New England Journal of Medicine, 2004, 350(26): 2645-2653.
[57]张雅萍, 沙先谊. 临床常见祛痰药对慢性呼吸系统疾病患者体外痰液的化痰效果.[J]药物研究,2020,2(15):47-50,54.
[58]李润萍,王优.雾化吸入N-乙酰半胱氨酸治疗慢性阻塞性肺疾病急性加重期患者疗效观察[J].实用医技杂志,2020,27(6):747-749.
[59]Dhand R, Dolovich M, Chipps B, et al. The role of nebulized therapy in the management of COPD: evidence and recommendations[J]. Copd, 2012, 9(1): 58-72. doi:10.3109/15412555.2011.630047.
[60]Arnaudis B, Lairez O, Escamilla R, et al. Impact of chronic obstructive pulmonary disease severity on symptoms and prognosis in patients with systolic heart failure[J]. Clin Res Cardiol, 2012, 101(9): 717-26. doi:10.1007/s00392-012-0450-4
专家介绍

张旻
上海交通大学医学院附属第一人民医院呼吸与危重症医学科主任;主任医师,上海交通大学医学院教授,博士生导师;目前担任:中华医学会呼吸分会哮喘学组副组长;中国医师协会呼吸医师分会委员,哮喘与变态反应疾病专家委员会秘书;海峡两岸医药卫生交流协会呼吸病学专家委员会常委。肺癌学组副组长;上海市医学会内科分会副主任委员;上海市医师协会呼吸医师分会副会长;上海市医学会呼吸病学分会委员,哮喘学组副组长。
*审批编号CN-130079 过期日期2025-2-4
*本材料由阿斯利康提供,仅供医疗卫生专业人士进行医学科学交流,不用于推广目的
本文由《呼吸界》编辑 Jerry 整理
本文完
责编:Jerry


