
此次与大家一起在呼吸道疾病流行的背景之下探索慢性呼吸系统疾病与免疫之道,分享呼吸系统疾病的相关知识。
慢性呼吸系统疾病患者免疫受损,是呼吸道感染的高危人群
慢性呼吸系统疾病与免疫之间的关联性一直是人们广泛关注和讨论的焦点。当前背景下,从慢性呼吸系统疾病角度出发,首先看看免疫与之有何种关系,再深入探讨慢性呼吸系统疾病患者的免疫功能状况,分析其是否因免疫功能受损而导致成为呼吸道感染的高风险群体。

这是我国慢性呼吸系统疾病患者的基本状况。最常见的慢性呼吸系统疾病主要包括慢性气道疾病,如为广大民众所熟知的慢性阻塞性肺疾病,这是以往被称为“老慢支”“肺气肿”的一类呼吸慢病。2018年,我国全国范围内的“成人肺部健康研究”对慢性阻塞性肺病(COPD)的患病状况进行了调查。结果显示:20岁以上人群中慢阻肺病的患病率约为8.6%,而40岁以上人群的患病率则高达13.7%。据此推算,我国慢阻肺病患者数量接近1亿,这一庞大的患者群体凸显出我国慢阻肺病的高疾病负担。[1]
其次,支气管扩张症也是一个慢性的气道疾病。2013年,全国七省市调查结果提示:40岁以上人群中,支气管扩张症的患病率达到1.2%,也是一个比较高发的、常见的慢性呼吸系统疾病。[2]
2015年,对29,359名北京市民进行的一个横断面研究,探讨了慢性支气管炎的患病率,整体人群是6.9%,如果是60岁以上人群进行单独计算,慢性支气管炎的患病率则高达12.2%。种种数据均表明,慢性呼吸系统疾病在我国具有较高的发病率和普遍性。这也意味着我国患有慢性呼吸系统疾病的人群庞大,从而导致疾病负担愈发沉重。[3]
在当前呼吸道疾病流行的背景下,这些高危人群面临重症/死亡的风险又如何?一项研究基从2010年-2011年至2014年-2015年的流行季全国流感监测和死因监测数据的研究,采用线性回归模型评估计算流感相关超额呼吸系统疾病死亡。全国平均每年有8.8万例流感相关呼吸系统疾病超额死亡,其中80%为≥60岁老人;≥60岁老人超额死亡率显著高于<60岁人群(38.5/10万人年 VS 1.5/10万人年),说明老年人罹患流感后面临更高死亡风险。[4]
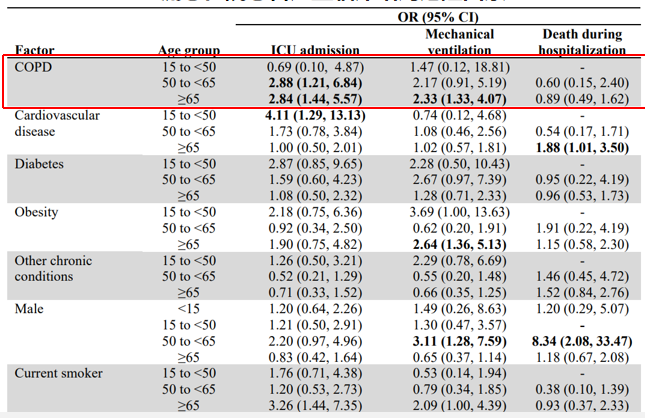
一项研究基于全球流感住院监测网络数据分析,共纳入12,803名2017年-2018年流感流行季住院患者。结果显示,慢性基础疾病的患者更易发展为重症乃至死亡,流感住院患者严重临床结局危险因素。该研究针对不同疾病类型进行分组,分析住院患者的ICU入住、机械通气和死亡率风险。最上列是慢阻肺病,按照年龄将其划分为15-50岁、50-65岁和≥65岁三个组,发现随着年龄的增长,患者入住ICU的风险显著增加,机械通气比例上升,死亡率也明显提高。[5]
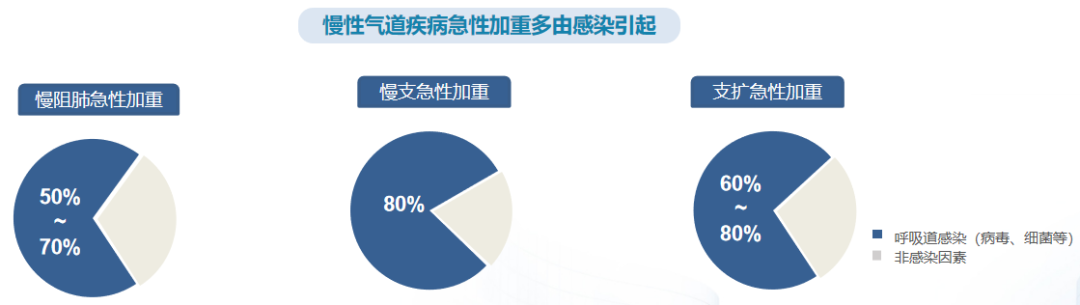
这组数据也提示了呼吸道病毒感染的高水平流行对于慢性气道疾病的影响。可以看到最左边的是慢阻肺病急性加重,50%-70%的急性加重是和感染相关的常见病原学,比如铜绿假单胞菌、肺炎克雷伯菌、流感嗜血杆菌等;中间是慢性支气管炎。80%的急性加重也与感染相关,比如常见病原菌为肺炎克雷伯菌、流感嗜血杆菌、铜绿假单胞菌等;支气管扩张症的急性加重,60%-80%与呼吸道感染因素密切相关。60%-80%的稳定期患者都存在潜在的致病菌定植,包括流感嗜血杆菌、铜绿假单胞菌等。这就意味着呼吸道病毒感染高水平流行,势必增加慢性气道疾病急性加重风险。要知道,50%-70%慢阻肺病急性加重事件、80%慢性支气管炎急性加重事件由呼吸道病毒、细菌等感染引起,支扩急性加重一般都是定植菌群引起。[6-8]

对于患有基础慢性气道疾病的人群而言,急性加重的发生将带来何种负面影响?以上这些数据清晰表明,慢性气道疾病的恶化及急性加重是其关键事件之一,加重频率越高,预后效果越差。通过急性加重,可加速疾病本身的进展,进而降低生活质量;增加医疗负担,最终带来的后果是增加死亡风险。所以,一旦出现慢性气道疾病,由于感染导致的急性加重,会加速疾病进展,带来多重危害。[9-17]
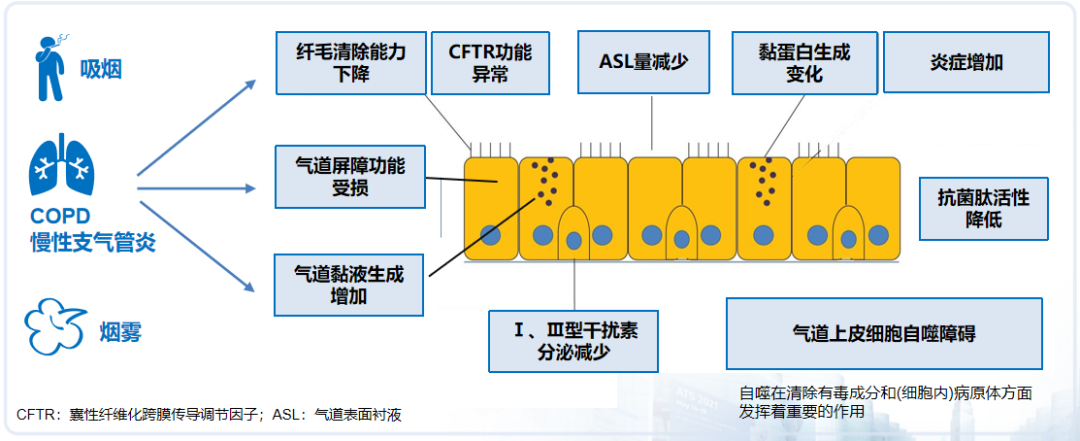
慢性气道疾病患者因吸烟、烟雾等危险因素的暴露,导致气道表面黏膜结构受损,这种损伤表现为纤毛清除能力减弱,黏蛋白生成异常,以及炎症反应加剧。此外,气道屏障功能受损使黏液生成增多,干扰素分泌减少,气道上皮自噬功能障碍,从而降低气道屏障保护作用。这进一步削弱了纤毛清除能力,减少了抗菌肽和干扰素的分泌,导致整体上皮固有防御能力下降。简单来说,一系列影响因素的综合效应导致气道上皮免疫功能和防御功能受损,使疾病不断进展。[18-20]
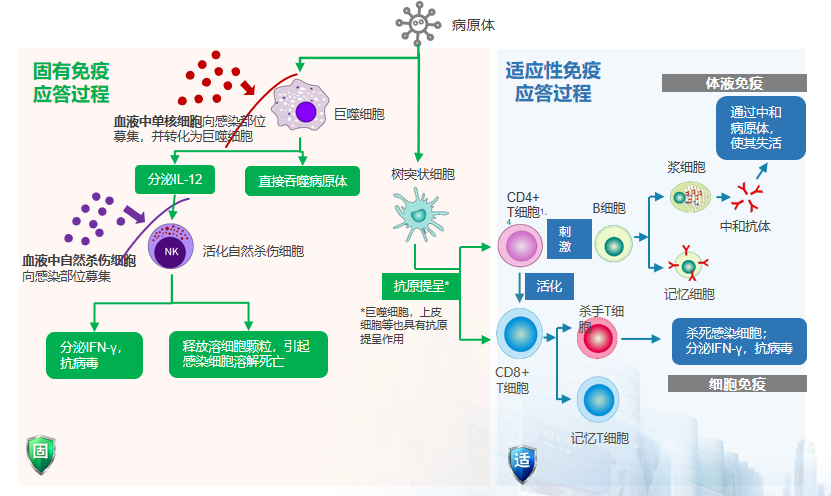
通常情况下,当健康人群遭受感染时,人体具有固有免疫和适应性免疫,这两重免疫可以迅速清除病原体,对人体造成的损伤较小。例如,当病毒或病原体侵入人体后,人体的固有免疫应答过程中,血液中的单核细胞开始向感染部位聚集,转化为巨噬细胞,直接吞噬病原体。同时,这些巨噬细胞还分泌白介素12等炎症因子,以进一步清除病原菌。血液中部分自然杀伤细胞也会向感染部位募集,进而分泌相应因子,并通过释放溶细胞颗粒等物质,导致感染细胞溶解死亡,从而实现清除病原体的目的。适应性免疫应答过程可通过一系列细胞免疫,如CD4阳性T细胞、B细胞的激活等途径,产生抗体并消灭部分病原体。因此,在健康人群感染病原体时,固有免疫与适应性免疫可通过上述方式协同作用,实现病原体的清除。[21-24]
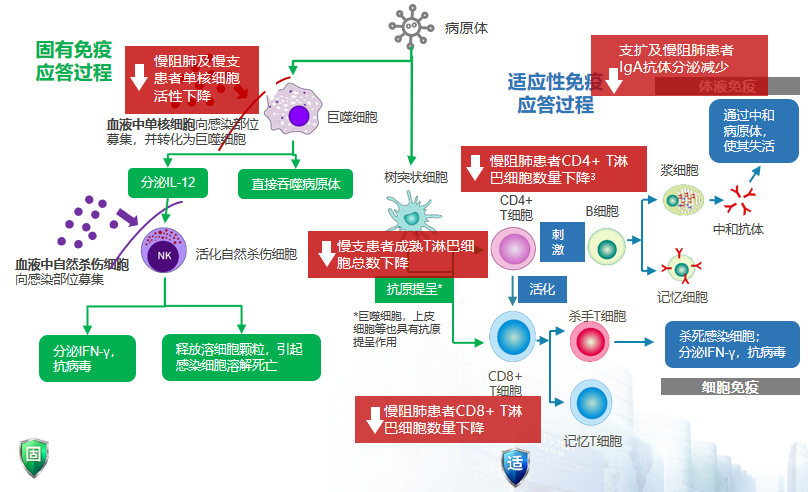
若患者并非健康人群,而是患有慢性气道疾病,例如已出现免疫功能损伤及免疫屏障破坏的情况,病原体清除能力显著受到影响。相关研究已明确指出,慢阻肺病及慢性支气管炎等慢性气道疾病的患者,其单核细胞活性明显降低,CT4阳性细胞、T淋巴细胞、成熟T细胞总数及CD8阳性细胞淋巴数量均有所减少。此外,支气管扩张和慢阻肺病患者在抗体方面,IgA抗体分泌亦减少。这些免疫细胞和抗体正是正常人群在感染后,固有免疫和肾性免疫应答过程中所需。若在慢性气道疾病患者体内,这些免疫细胞和抗体明显降低,将导致免疫应答反应减弱,进而使病原体清除能力降低。因此,慢性气道疾病患者在感染后,病情往往较正常人群更为严重。这就是免疫损伤导致的慢性气道疾病患者感染加重现象。[25-30]
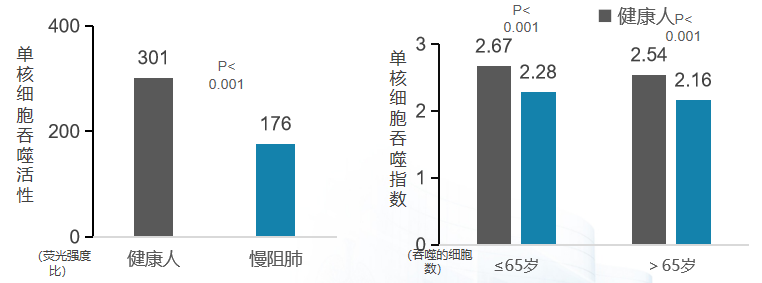
一项研究(图左)纳入60例慢阻肺病患者及50例健康志愿者,观察基线状态下慢阻肺病患者外周血单核细胞细胞的吞噬活性及相应药物的改善作用。黑色柱线图代表的是健康人,蓝色柱线图代表的是慢阻肺病患者。可以看到,显示慢阻肺病患者外周血单核细胞吞噬活性相比健康人群显著降低;另一项研究(图右)纳入89例慢性支气管炎及89例健康志愿者,收集外周血,分离出单核细胞,比较两组患者单核细胞活性。同样,黑色柱线图代表的是健康人,蓝色柱线图代表的是慢性支气管炎患者。可以看到,显示慢性支气管炎患者外周血单核细胞吞噬指数相比健康人群显著降低。两项研究结果说明,相比健康人,慢阻肺病患者外周血单核细胞吞噬活性显著下降,相比同年龄组健康人,慢支患者外周血单核细胞吞噬指数显著下降。[25、26]
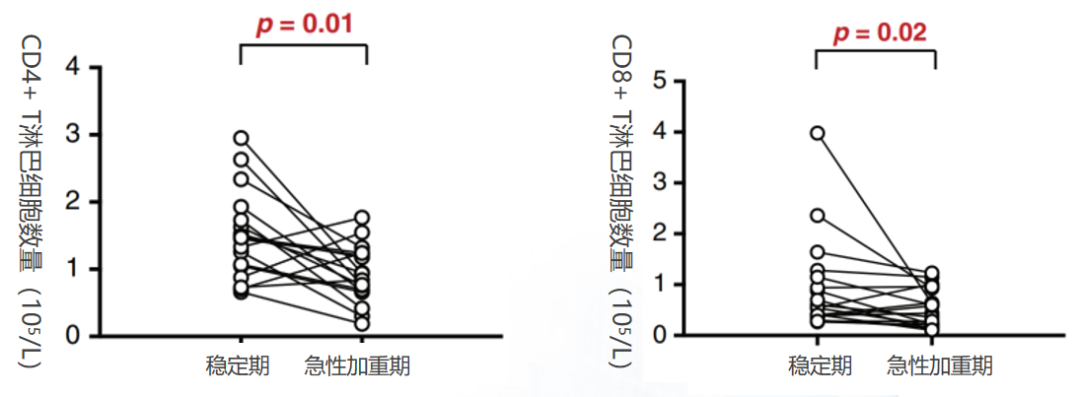
一项前瞻性队列研究,纳入13例慢阻肺病稳定期患者,在研究期间发生18次急性加重时间,分析CD4阳性及CD8阳性T细胞在急性加重期间的变化等。图左是急性加重期外周血CD4阳性T淋巴细胞数量变化,图右是急性加重期外周血CD8阳性T淋巴细胞数量变化。结论显示,相比稳定期患者,慢阻肺病急性加重患者外周血CD4阳性及CD8阳性T淋巴细胞数量显著下降。表现趋势是一样的,而且都出现了统计学差异。这也意味着和稳定期的慢阻肺病患者相比,一旦出现急性加重,这些患者的CD4阳性T淋巴细胞和CD8阳性T淋巴细胞的数量都表现为明显下降。[27]
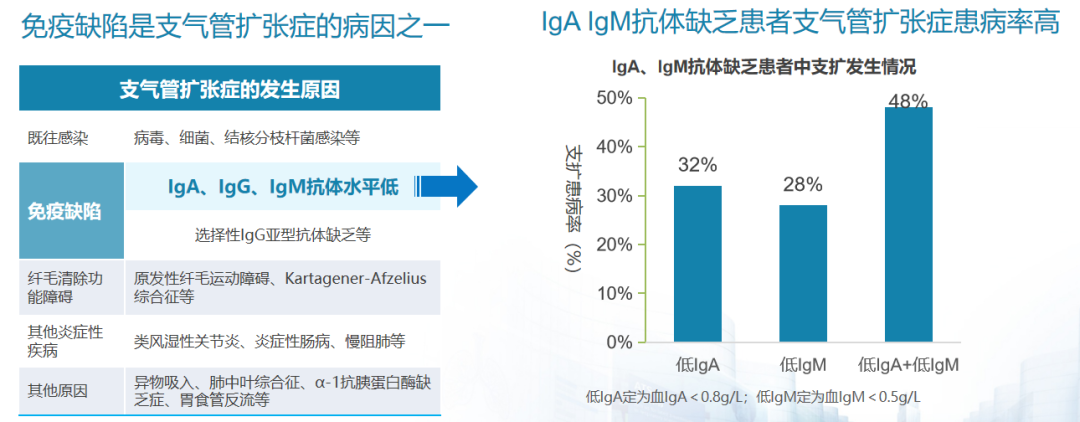
从支气管扩张症的抗体角度进行分析。众所周知,IgA、IgG、IgM抗体缺乏是导致支气管扩张症的一个重要因素。根据左图所示,免疫缺陷在支气管扩张症的发生中主要表现为IgA、IgG、IgM抗体水平下降。进一步观察右图的柱状图表,IgA、IgM抗体联合存在缺陷的患者中,支气管扩张症的患病率分别为32%、28%、48%。这些研究均表明,IgA、IgM抗体缺乏,尤其是联合缺乏,将显著增加支气管扩张症患者的患病风险。[30、31]
小结:通过上述所有数据可以看出,慢性呼吸系统疾病患者存在免疫功能受损和炎症增强。无论是慢阻肺病、慢支、支气管扩张症,还是吸烟引起的慢性气道炎症,都可引起气道上皮免疫防御损伤,表现为气道上皮细胞损伤及结构改变,黏液-纤毛清除功能受损;都可引起固有免疫细胞功能受损,表现为吞噬细胞吞噬功能减弱,炎症因子和细胞激活,气道炎症增强;都可引起适应性免疫功能受损,表现为调节性T细胞和效应T细胞数量及功能下降,B细胞减少,免疫球蛋白水平降低。[30、32-39]
慢阻肺病患者气道菌群失衡进一步增加急性加重风险
在基础免疫功能受损情况下,慢性气道疾病尤其是慢阻肺病患者气道菌群失衡对于急性加重风险的影响有哪些呢?有研究提示:肽聚糖受体NOD2和脂多糖受体TLR4是一类可以识别微生物抗原的模式识别受体(PRR),慢阻肺病和吸烟患者NOD2和TLR4减少,导致患者单核细胞对细菌的免疫识别降低,进而增加细菌的易感性;GM-CSF和TNFα是具有感染防御功能的细胞因子,细菌感染后吸烟慢阻肺病患者单核细胞释放的细胞因子(如GM-CSF和TNFα)减少,说明在预防细菌感染时慢阻肺病患者的单核细胞功能活性下降,对细菌感染易感;IL-10是在细菌感染清除后抑制细胞因子表达的调节因子,可预防慢性炎症的产生。慢阻肺病患者中IL-10水平下降,导致慢性炎症的产生。结论:慢阻肺病患者对细菌的免疫反应存在缺陷,导致细菌感染的易感性增加,而呼吸道细菌感染会增加慢阻肺病急性加重风险。(注:GM-CSF:粒细胞-巨噬细胞集落刺激因子;TNFα:肿瘤坏死因子α。)[40]
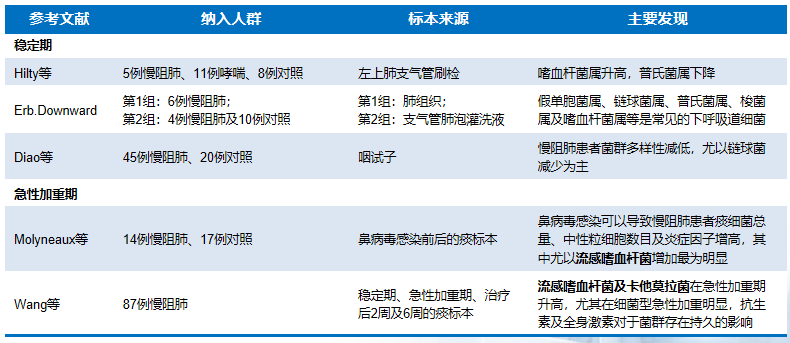
针对慢阻肺病患者在稳定期与急性加重期气道菌群分布的差异,多项临床研究进行了深入探讨。从已有图表数据看,不同研究团队得出了相似的结论。在稳定期,无论是刷检、肺组织、支气管肺泡灌洗液或咽拭子来源的标本,均显示气道菌群中嗜血杆菌属明显升高,普氏菌属则有所下降。同时,部分慢阻肺病患者的菌群多样性降低,尤其是链球菌属的数量减少。综合分析可得出结论:稳定期慢阻肺病患者气道内菌群多样性相较于正常人有所降低,链球菌属、普氏菌属、莫拉菌属及嗜血杆菌属可能成为主导菌群。这意味着,在稳定期,慢阻肺病患者气道内菌群的重要性相对较低。然而,一旦病情进入急性加重期,气道内菌群状况发生显著变化,痰中细菌总量、中性粒细胞数量以及炎症因子水平明显上升,其中流感嗜血杆菌的增加尤为明显。另一项研究针对87例慢阻肺病患者,也发现流感嗜血杆菌及卡他莫拉菌在急性加重期明显升高,意味着从稳定期进入到急性加重期,整个菌群的改变也是明显变化的,流感嗜血杆菌的增加占主体地位更明显,所以菌群比例失调也更为明显。
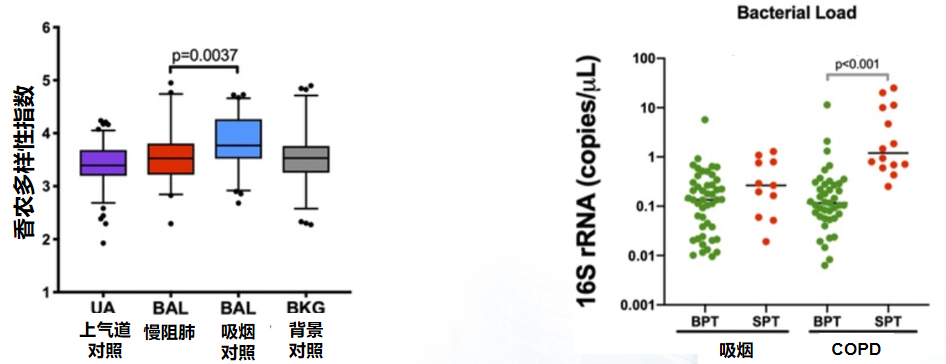
另一项研究纳入26例GOLD1-2级的慢阻肺病患者和31例吸烟者作为对照,利用16S rRNA基因测序和数字PCR对下呼吸道微生物群落分布和细菌载量进行检测,旨在描述早期慢阻肺病患者上下呼吸道微生物群的特征。从图左可见,与吸烟对照组相比,慢阻肺病患者下呼吸道菌落多样性较低(注:α-多样性:主要关注局域均匀生境下的物种数目,是反映微生物群落多样性的指标;香农多样性指数:用来估算群落多样性的指数,可以反映α-多样性指数。值越大,群落多样性越高。);图右是整个的基因测序情况,可见,与吸烟对照组相比,慢阻肺病患者下呼吸道细菌负荷较高,主要为细菌负荷(注:SPT:声门上优势菌群;BPT:背景对照优势菌群)。因此可证明,早期慢阻肺病下呼吸道微生物多样性降低,细菌负荷增高。[41]
气道微生物群失衡与慢阻肺病有何关系呢?事实证明,可能引发慢阻肺病急性加重。1.首先是慢阻肺病急性加重患者的气道微生物群失衡。慢阻肺病MAP研究显示:41%慢阻肺病急性加重存在微生物群失衡;2.肺部微环境中的微生物群和慢阻肺病的严重程度有关。特定的肺部微生物群联合代谢物可以预测肺功能和CAT评分;丰富的普雷沃菌,链球菌,巴氏杆菌和紫单胞菌,是与肺功能(FEV1/FVC或FEV1)呈负相关的特异性特征;链球菌感染率与CAT评分呈正相关;3.细菌感染引起慢阻肺病急性加重。26%的慢阻肺病急性加重是由细菌引起,27%的慢阻肺病急性加重是由细菌和病毒共同引起的。因此结论是:慢阻肺病患者在疾病临床进展和临床表型上具有异质性,慢阻肺病患者肺内微生物群失衡/异常可能影响慢阻肺病患者的临床结局 。气道疾病状态下微生物过度繁殖,可导致慢性呼吸系统疾病的进展或急性加重。[41-43]
小结:慢性气道疾病患者的免疫功能受损情况以及气道微生物变化。慢性气道疾病患者的免疫功能受损;慢阻肺病患者气道菌群失调,同时对细菌感染的易感性增加;呼吸道感染易诱发急性加重,影响慢阻肺病患者的临床结局。[40、41、43、44]
预防呼吸道感染是慢阻肺患者治疗中的重要措施之一
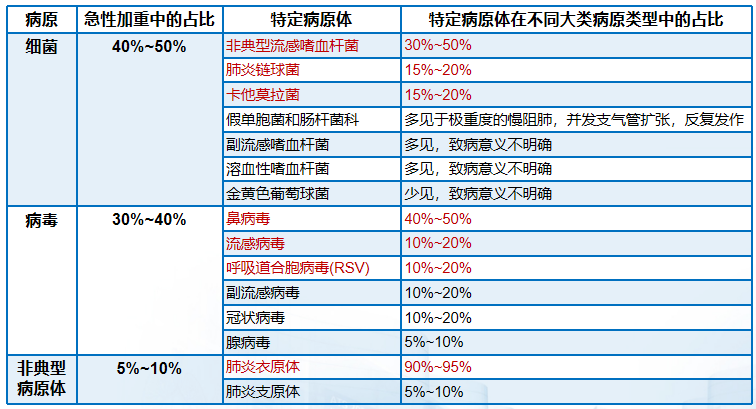
细菌和病毒感染是慢阻肺病急性加重的主要原因。已有很多指南,包括临床研究都提示:50%-70%慢阻肺病急性加重、80%慢性支气管炎急性加重由呼吸道病毒、细菌等感染引起;支气管扩张症急性加重一般都是定植菌群引起;慢阻肺病急性加重最常见的细菌病原体为流感嗜血杆菌、卡他莫拉菌和肺炎链球菌,最常见病毒病原体为鼻病毒、呼吸道合胞病毒和流感病毒。[6-8、45、46]
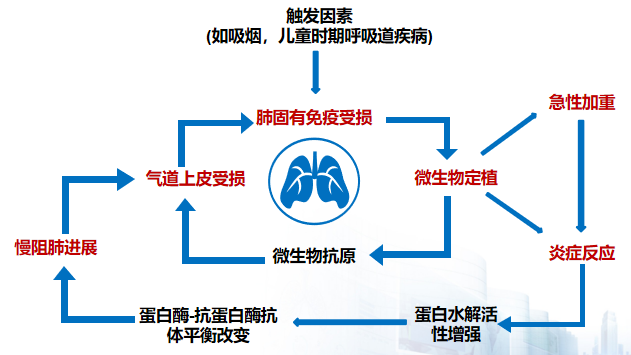
以上这些病菌、病原体在近些年来也常常被大家关注到,在不同的情况下,这些细菌和病毒感染是慢性病病急性加重的主要原因。一旦出现了这样的触发因素,导致肺的固有免疫功能受损,气道上皮功能受损,微生物定植,再加上感染的易感性增加,如果出现反复呼吸道感染,就会促进蛋白酶-抗蛋白酶抗体的失衡,蛋白水解活性增强等等一系列导致炎症反应的明显增加,促进慢阻肺病的进展。而慢阻肺病本身的进展又会进一步使得肺部气道上皮的免疫损伤增加,微生物的定植和微生物的菌群失调,进而导致炎症反应的增强,促进急性加重的发生再出现一个恶性循环。因此,慢阻肺病导致呼吸道感染增加,形成急性加重的恶性循环。[7]
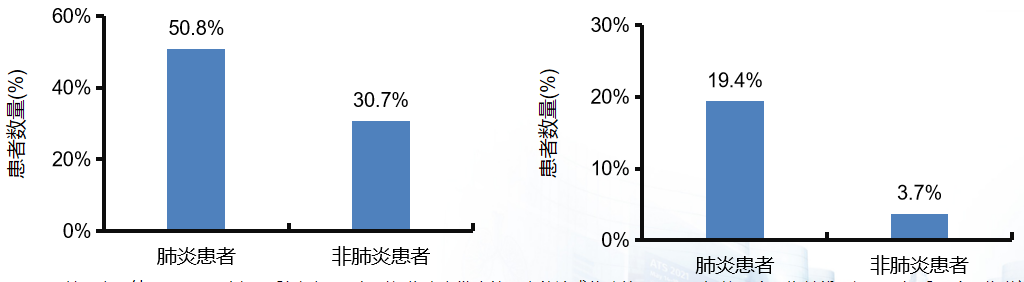
美国真实世界研究提示:肺炎患者发生慢阻肺病急性加重的风险明显高于非肺炎患者。这项回顾性研究,纳入3154745例慢阻肺病患者,入组时间为患者发生第一次就诊或住院的日期,入组前12个月为基线期间,入组后12个月为随访期,观察随访期肺炎和急性加重事件,旨在描述肺炎和慢阻肺病的急性加重的关系。从图左可见,肺炎患者更容易在随访期发生慢阻肺病急性加重 OR 2.33,95%CI(2.31-2.34);图右可见,肺炎患者更容易发生需要住院的重度慢阻肺病急性加重 OR 6.28,95%CI(6.22-6.34)。结论:所有发生肺炎的慢阻肺病患者中,69.7%一年发生一次肺炎,20.2%发生2次,10.1%发生≥3次肺炎,且其中51.4%为需要住院的重症肺炎;肺炎患者随访期内发生慢阻肺病急性加重和发生需住院的重度慢阻肺病急性加重风险均显著高于非肺炎患者。[41]
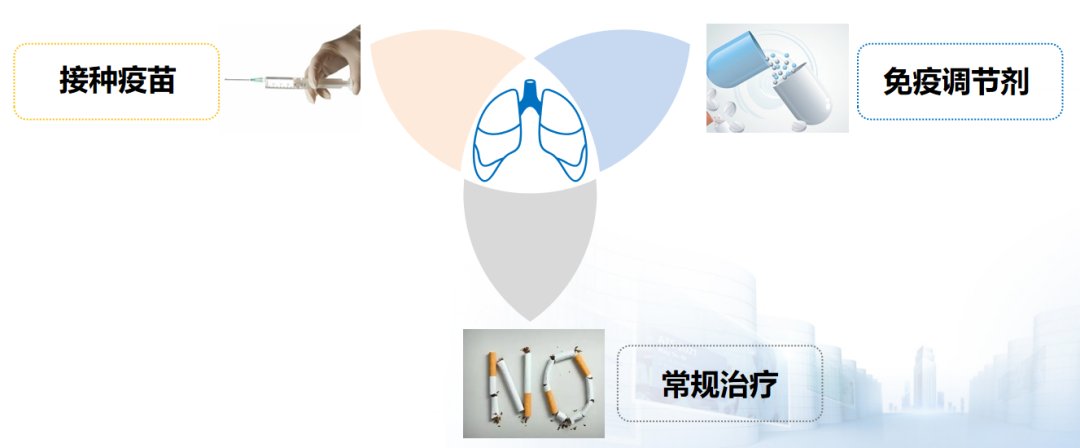
预防呼吸道感染是慢阻肺病长期疾病管理中重要的一环。不同指南都推荐了呼吸道感染预防措施,主要包括三个方面:常规治疗;免疫调节剂;接种疫苗。这三方面均是预防呼吸道感染强力推荐的措施。[47]
具体分析慢阻肺病预防呼吸道感染的常规治疗/非药物治疗:1.戒烟:戒烟是所有吸烟慢阻肺病患者的关键干预措施,应该强烈鼓励和支持所有吸烟者戒烟;2.肺康复计划:所有有相关症状和/或急性加重高风险的患者都有指征做康复;3.氧疗:对于在静息时仍有严重低氧血症的患者中,有指征应用长期氧疗;4.营养:慢阻肺病营养不良患者中应给予营养支持;5.教育和自我管理;6.呼吸支持:在严重慢性高碳酸血症和曾因急性呼吸衰竭住院治疗的患者中,可考虑长期无创通气;7.排痰:可通过祛痰药物、吸痰、物理排痰痰治疗(如刺激咳嗽、叩击胸部、体位引流)等方式辅助气道痰液清除;8.补充维生素D。[45、47、48]
具体分析疫苗预防。指南推荐接种疫苗预防慢阻肺病急性加重:1.流感疫苗接种。ATS和CTS推荐所有慢阻肺病患者每年接种流感疫苗预防慢阻肺病急性加重(推荐等级:1B级);我国批准上市的流感疫苗均为三价灭活流感疫苗(TIV);2.肺炎球菌疫苗。ATS和CTS推荐对于慢阻肺病患者管理中使用23价肺炎球菌疫苗,但还没有足够证据表明肺炎球菌疫苗接种可以预防慢阻肺病急性加重(推荐等级:2C级);我国批准上市的肺炎链球菌疫苗有两种,即PCV7(7价肺炎球菌结合疫苗)和PPV23(23价肺炎球菌多糖疫苗);我国《肺炎链球菌性疾病相关疫苗应用技术指南(2012)》说明:PPV23主要用于成年人和2岁以上高危人群的肺炎链球菌性疾病;我国≥40岁慢阻肺病患者5年内肺炎疫苗接种率为0.8%,接种率极低;3.流感疫苗和肺炎球菌疫苗的联合接种能降低慢阻肺病患者的感染性、急性加重风险和老年人院内肺炎死亡风险。[49-52]
具体分析免疫治疗。多部指南推荐使用免疫调节剂治疗慢阻肺病急性加重。1.GOLD2021的推荐描述是:减少慢阻肺病急性加重的严重程度和频率。推荐药物:提及两项使用免疫调节剂治疗慢阻肺病患者的随机对照研究;2.中国:慢性阻塞性肺疾病诊治指南(2021年修订版)的推荐描述是:降低慢阻肺病急性加重的严重程度和频率,在有反复呼吸道感染的慢阻肺病患者中建议使用。推荐药物是常见呼吸道感染病原菌裂解成分生产的免疫调节药物;3.中国:慢性阻塞性肺疾病急性加重(AECOPD)诊治中国专家共识(2017年更新版)的推荐描述是:减少AECOPD的发生频率和住院次数。推荐药物是免疫调节剂;4.中国:成人支气管扩张症诊治专家共识(2021版)的推荐描述是:减少支气管扩张急性加重的合并用药。推荐用药是免疫调节剂;5.中国:上-下气道慢性炎症性疾病联合诊疗与管理专家共识(2017)的推荐描述是:治疗支气管扩张症。推荐药物同样也是免疫调节剂。因此,慢阻肺病患者免疫功能受损,免疫治疗也是良好的选择。[45、48、53-55]
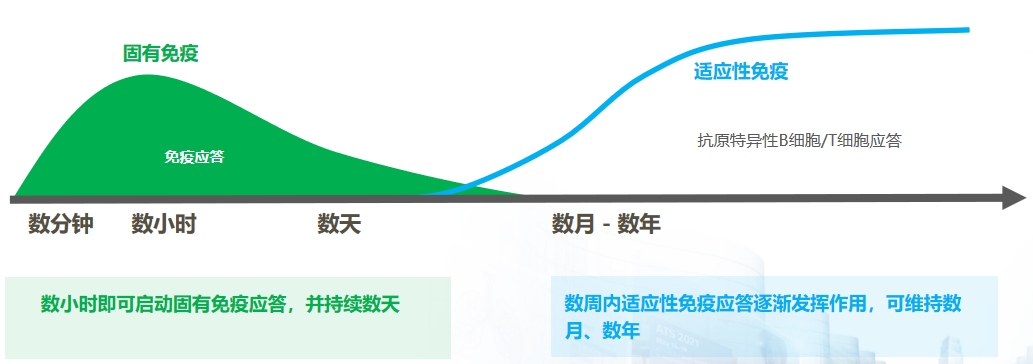
免疫治疗药物通过刺激机体产生自然免疫反应,增强适应性免疫反应,提升预防病原体感染的能力。正常情况下,人体在接触病原/抗原后数分钟内固有免疫应答就会被启动,并持续数天;而随后发生的适应性免疫应答可持续数周乃至数年。免疫治疗药物通过模仿机体对病原体的自然免疫反应,增强适应性免疫反应,提升预防病原体感染的能力。[56]
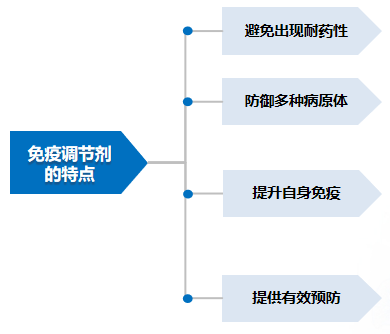
免疫调节剂可调节机体对多种病原的防御。免疫调节剂可提供非特异性的免疫调节,意味着固有免疫和适应性免疫中免疫应答的更普遍变化,从而导致宿主对许多不同抗原的反应性发生改变。其特点有:1.避免出现耐药性。不直接影响微生物,因此可以避免耐药性快速出现的问题;2.防御多种病原体。免疫调节剂可提供针对细菌、病毒和真菌疾病的广谱防御能力。出现罕见病原体时提供非特异性的紧急治疗方案;3.提升自身免疫。与疫苗协同使用增强或调节患者的固有免疫应答,非特异性诱导人体进入“预警”状态,增强整体免疫应答水平,对抗多种病原,适用于呼吸道感染的复杂病原谱;4.提供有效预防。对于反复呼吸道感染,预防策略是临床管理的基石,因为预防能帮助终止微生物感染的恶性循环。通过防止后续的感染,对患者的长期预后产生有益的影响。[57、58]
常见免疫调节剂的作用机制和适用人群有哪些?1.微生物制剂(细菌溶解产物):作用机制-固有免疫:提升吞噬细胞杀灭病原体活性,刺激单核细胞活性,促进非特异性免疫;刺激Toll样受体,提高抗原递呈细胞的活性。适应性免疫:促进T细胞转化,增加调节T细胞数量和活性,调节Th1/Th2向Th1飘移;激活B细胞,增加免疫球蛋白的含量。适用人群-6个月及6个月以上的儿童及成人。2.化学制剂(匹多莫德):作用机制-固有免疫:增强巨噬细胞、中性粒细胞吞噬活性和趋化性,激活NK细胞;适应性免疫:促进T细胞增殖,纠正辅助性T细胞/抑制性T细胞比值,增加IL-2和IFN-γ。适用人群-3岁及3岁以上的儿童及成人。3.生物制剂(胸腺肽、脾腺肽):胸腺肽作用机制-适应性免疫:促进胸腺淋巴细胞分化、发育和成熟,调节CD4+/CD8+平衡;间接调节B淋巴细胞,提供免疫球蛋白的含量。适用人群-适用于成人,儿童及老年患者慎用。脾腺肽作用机制-适应性免疫:增强细胞免疫功能,纠正Th1/Th2的不平衡,提高血IL-4和IFN-ϒ水平,使CD4+ /CD8+比值上升。适用人群:适用于成人,儿童及老年患者疗效及安全性尚不明确。(备注:Th:辅助T细胞;IFN:干扰素;IL:白介素)[59-63]
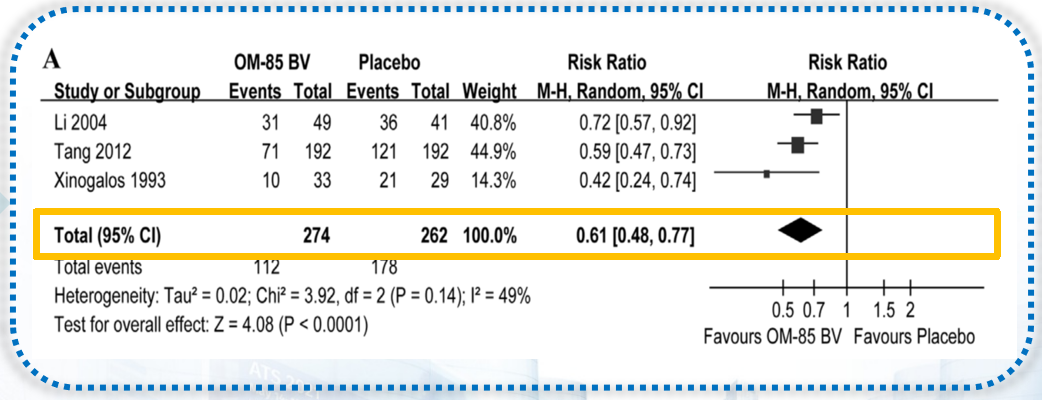
一项系统性回顾和荟萃分析,纳入5项随机对照研究工1190例慢阻肺病患者,观察OM-85对慢阻肺病患者的疗效及安全性,其中4篇研究评估了OM-85的安全性。研究结果显示,OM-85可使慢阻肺病急性加重率显著降低20% (RR = 0.80; 95%CI 0.65 - 0.97; P<0.03)。
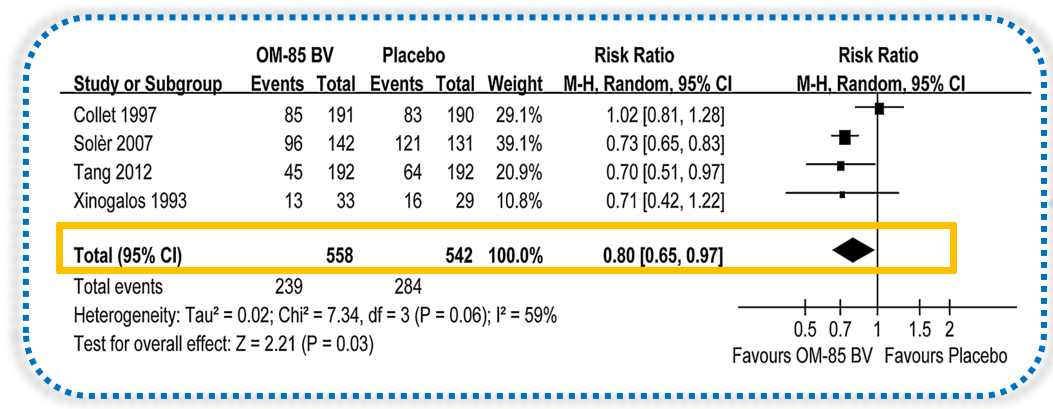
研究结果显示,OM-85可使慢阻肺病患者抗生素使用率显著降低39% (RR=0.61,95%CI 0.48 - 0.77; P<0.0001)。因此,以慢阻肺病为例的Meta分析显示,细菌溶解产物OM-85可大幅降低患者的急性加重率和抗生素使用率。[64]
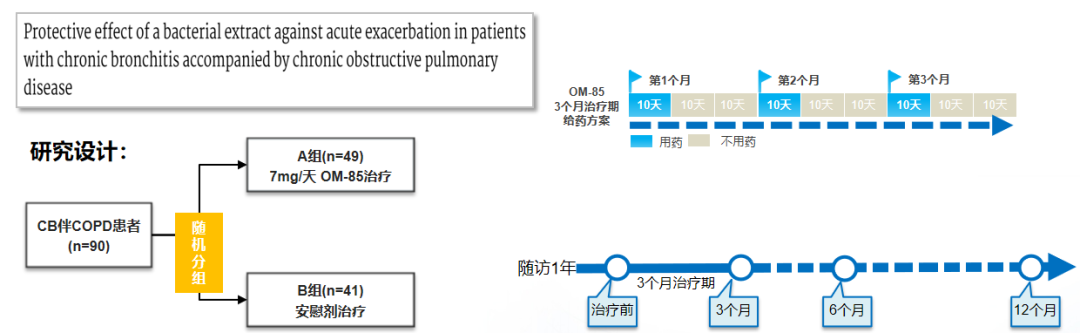
这是OM-85在慢支伴慢阻肺病患者中的多中心RCT研究。它是随机、双盲、安慰剂对照的多中心研究,纳入90例55-82岁慢支(CB)伴慢阻肺病(COPD)患者。所有患者同时接受常规治疗:口服茶碱、糖皮质激素;呼吸困难时吸入支气管扩张剂;急性呼吸道感染时抗生素治疗,增加支气管扩张剂的剂量,加用黏液溶解剂。结果显示,急性加重:发作次数、间隔时间和严重程度、用药情况(抗生素、支气管扩张剂、黏液溶解剂等);症状评分:咳、痰、呼吸困难以及肺部听诊情况等;肺功能:FVC、FEV1;细菌清除率:前3个月未使用抗生素时的痰培养结果。[65]
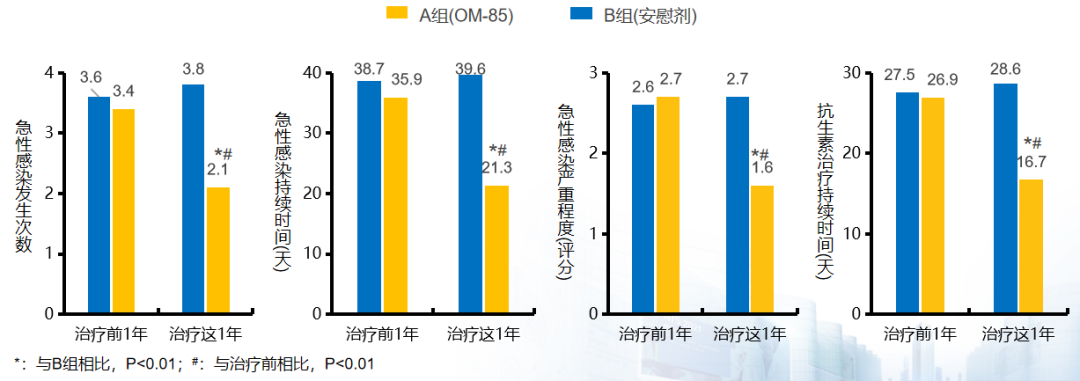
从左到右这4组数据分别代表的是急性感染的发生次数,急性感染的持续时间,急性感染严重程度的评分以及抗生素治疗持续时间,每一组左右两边分别代表的是治疗前一年和治疗一年的随访情况。蓝色代表的是安慰剂组,黄色代表的是OM-85组。急性加重:相比安慰剂,OM-85治疗3个月后,慢支伴慢阻肺病患者在随访1年内的急性加重发生率,持续时间和严重程度均显著降低(P<0.01),并且抗生素治疗持续时间也明显缩短(P<0.01)。结果显示:OM-85显著降低慢支伴慢阻肺病患者急性加重的发生和严重程度。[65]
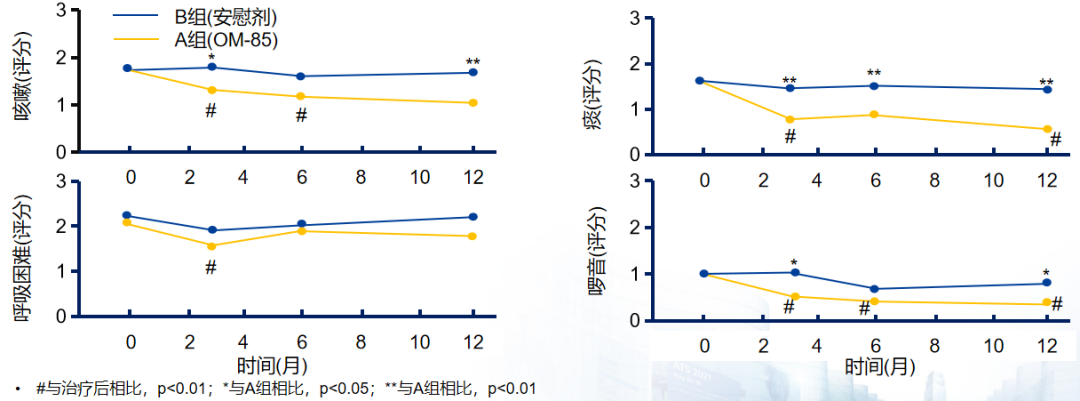
OM-85显著改善慢阻肺合并慢支患者呼吸症状评分。将90例慢性支气管炎合并慢阻肺病患者随机分为A组(n=49)和B组(n=41),A组患者口服含7mg OM-85,B组患者接受相似的安慰剂胶囊,为期3个月,记录年急性加重率、症状评分和肺功能。与安慰剂治疗(B组)相比,OM-85(A组)治疗后患者的咳嗽、痰液、呼吸困难及胸部听诊症状评分均有显著改善(P<0.05)。[65]

OM-85提升慢支伴慢阻肺病患者的痰液细菌清除率。细菌清除:相比安慰剂,OM-85治疗3个月后,期间未接受抗生素治疗的患者痰液中细菌清除率也显著更高(P<0.01)。OM-85治疗后,16例未接受抗生素治疗的患者中有11例的痰培养转阴。安慰剂治疗后,所有患者痰培养均未转阴。[65]
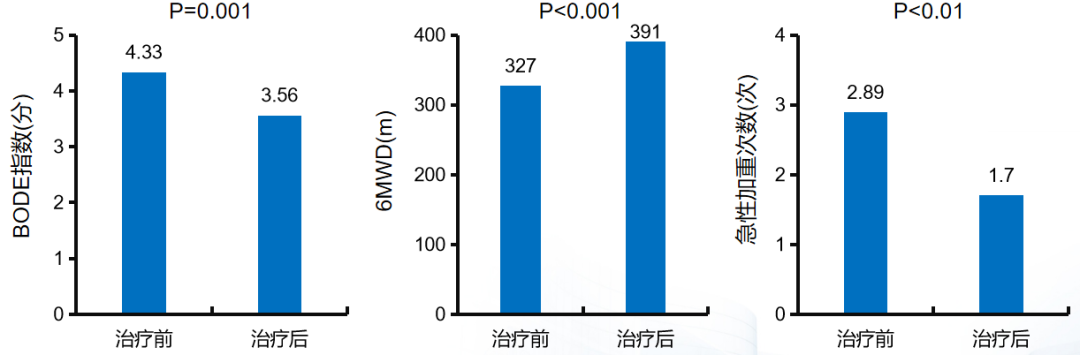
再看看另一个免疫调节剂匹多莫德。BODE指数评分:为四种因素参与的多维评价系统,即体质量指数、气流阻塞程度、呼吸困难及运动能力,分数越高,患者状况越差;6MWD:患者于6分钟内尽可能快地在室内一条长30m的道路上往返的距离。一项研究纳入27 例有长期吸氧指征的慢阻肺病稳定期患者,在常规治疗基础上予以匹多莫德800 mg,1 次/d,共60d,联合每日家庭氧疗,共治疗1年,观察匹多莫德联合长期氧疗治疗1年后的慢阻肺病急性加重和症状较治疗前的变化。开始治疗1年后,匹多莫德联合长期氧疗组慢阻肺病患者的症状和活动能力相比治疗前得到改善,急性加重的次数减少。结论显示,匹多莫德可改善稳定期慢阻肺病症状、减少急性加重的发作次数。[66]
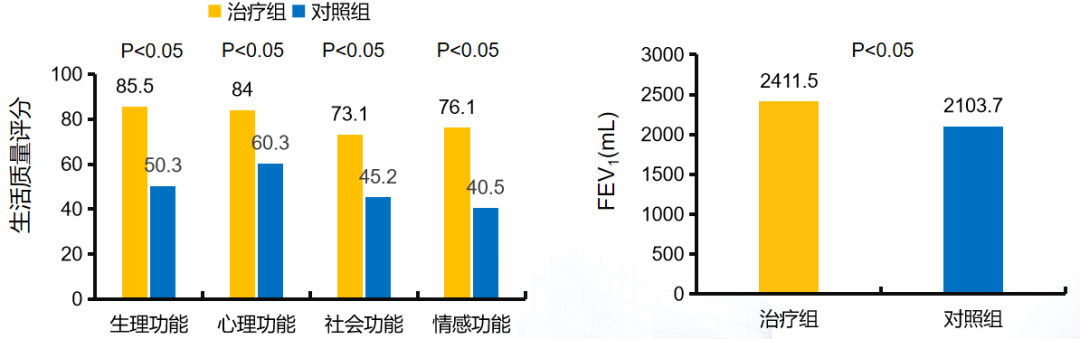
胸腺肽也有助于改善老年慢阻肺患者的肺功能和生活质量。图左的研究选取2015年1月2017年1月老年慢阻肺急性加重期患者40例作为研究对象,将其随机分为两组,各20例,其中对照组采用抗生素治疗,治疗组采取胸腺肽联合抗生素治疗,观察两组患者的治疗效果。说明,胸腺肽α1联合抗生素组的老年慢阻肺病患者生活质量显著高于对照组。图右的研究纳入60例老年慢阻肺病急性加重期患者,根据治疗方案不同分为对照组与治疗组,每组30例。对照组患者接受常规对症治疗,治疗组患者在对照组基础上同时给予胸腺肽α1辅助治疗,旨在探讨老年慢阻肺病急性加重患者在对症治疗基础上辅以胸腺肽α1对病情的干预效果。结果显示,胸腺肽α1辅助治疗组的老年慢阻肺病患者肺功能显著高于对照组。[67、68]
总结:呼吸道是人体免疫系统的最前沿,慢性呼吸系统疾病患者存在固有和适应性免疫功能受损,易诱发呼吸道感染;慢阻肺患者的免疫失衡导致对细菌感染的易感性增加,同时慢阻肺患者常常合并气道菌群失调,增加急性加重风险;细菌和病毒感染是慢阻肺患者急性加重的主要诱因,预防呼吸道感染是慢阻肺长期管理中重要的一环;免疫治疗有效针对慢阻肺患者的免疫功能受损,可显著减少COPD急性加重,改善呼吸道症状、肺功能和生活质量。[25-30、40-43、47、64、66、67]
参考文献
1. Wang C, Xu J, Yang L, etal. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study): a national cross‐sectional study[J]. Lancet, 2018, 391(10131): 1706‐1717.DOI: 10.1016/S0140‐6736(18)30841‐9.
2. 周玉民, 王辰, 姚婉贞, 等.我国7省市城区40岁及以上居民支气管扩张症的患病情况及危险因素调查 [J] . 中华内科杂志,2013,52( 05 ): 379-382.DOI: 10.3760/cma.j.issn.0578-1426.2013.05.006
3. Zhang H, Dong L, Kang Y K, et al. Epidemiology of chronic airway disease: results from a cross-sectional survey in Beijing, China[J]. Journal of Thoracic Disease, 2018, 10(11): 6168.
4. Li L, Liu Y, Wu P, et al. Influenza-associated excess respiratory mortality in China, 2010–15: a population-based study [J]. The Lancet Public health, 2019, 4(9): e473 e81. DOI:10.1016/S2468-2667(19)30163-X.
5. Lina B, Georges A, Burtseva E, et al. Complicated hospitalization due to influenza: results from the Global Hospital Influenza Network for the 2017-2018 season [J]. BMC Infect Dis, 2020, 20(1): 465. DOI:10.1186/s12879-020-05167-4.
6. 慢性阻塞性肺疾病急性加重抗感染治疗中国专家共识编写组. 慢性阻塞性肺疾病急性加重抗感染治疗中国专家共识[J]. 国际呼吸杂志, 2019, 39(17):1281-1296.
7. Sethi S. Infectious etiology of acute exacerbations of chronic bronchitis[J]. Chest, 2000, 117(5): 380S-385S.
8. 成人支气管扩张症诊治专家共识[J]. 中华结核和呼吸杂志, 2012, 35(007):485-492.
9. Lim S, Lam D C L, Muttalif A R, et al. Asia Pacific family medicine, 2015, 14(1): 4.
10. Cui Y, Dai Z, Luo L, et al. Journal of thoracic disease, 2019, 11(4): 1303.
11. Feeney A S, Fendrick A M, Quintiliani R. The American journal of managed care, 2004, 10: 689-696.
12. Chalmers J D, Goeminne P, Aliberti S, et al. American journal of respiratory and critical care medicine, 2014, 189(5): 576-585.
13. Donaldson G C, Seemungal T A R, Bhowmik A, et al. Thorax, 2002, 57(10): 847-852.
14. Niewoehner D E. The American journal of medicine, 2006, 119(10): 38-45.
15. Soler-Cataluna J J, Martínez-García M Á, Sánchez P R, et al. Thorax, 2005, 60(11): 925-931.
16. Doll H, Grey-Amante P, Duprat-Lomon I, et al. Respiratory medicine, 2002, 96(1): 39-51.
17. Niederman M S, McCombs J S, Unger A N, et al. Clinical therapeutics, 1999, 21(3): 576-591.
18. Nurwidya F, et al. Tuberculosis and respiratory diseases, 2016, 79(1): 5-13.
19. Kim V, et al. American journal of respiratory and critical care medicine, 2013, 187(3): 228-237.
20. Hiemstra P S, et al. European respiratory journal, 2015, 45(4): 1150-1162
21. Moldoveanu B, Otmishi P, Jani P, et al. Inflammatory mechanisms in the lung[J]. Journal of inflammation research, 2009, 2: 1.
22. Gordon S B, Read R C. Macrophage defences against respiratory tract infections: The immunology of childhood respiratory infections[J]. British medical bulletin, 2002, 61(1): 45-61.
23. Brandstadter J D, Yang Y. Natural killer cell responses to viral infection[J]. Journal of innate immunity, 2011, 3(3): 274-279.
24. Chen K, Kolls J K. T Cell–mediated host immune defenses in the lung[J]. Annual review of immunology, 2013, 31: 605-633.
25. PRIETO A, REYES E, BERNSTEIN E D, et al. Defective natural killer and phagocytic activities in chronic obstructive pulmonary disease are restored by glycophosphopeptical (inmunoferon)[J]. American journal of respiratory and critical care medicine, 2001, 163(7): 1578-1583.
26. Fietta A, Merlini C, De Bernardi P M, et al. Non specific immunity in aged healthy subjects and in patients with chronic bronchitis[J]. Aging Clinical and Experimental Research, 1993, 5(5): 357-361.
27. Freeman C M, Martinez C H, Todt J C, et al. Acute exacerbations of chronic obstructive pulmonary disease are associated with decreased CD4+ & CD8+ T cells and increased growth & differentiation factor-15 (GDF-15) in peripheral blood[J]. Respiratory research, 2015, 16(1): 94.
28. 陈小青, 何建如, 缪群. 慢性支气管炎患者急性发作和缓解期 T 淋巴细胞亚群的数量变化及意义[J]. 浙江医学, 2002, 24(2): 69-70.
29. Polosukhin V V, Cates J M, Lawson W E, et al. Bronchial secretory immunoglobulin a deficiency correlates with airway inflammation and progression of chronic obstructive pulmonary disease[J]. American journal of respiratory and critical care medicine, 2011, 184(3): 317-327.
30. Whitters D, Stockley R. Immunity and bacterial colonisation in bronchiectasis[J]. Thorax, 2012, 67(11): 1006-1013.
31. Hodkinson J P, Bangs C, Wartenberg-Demand A, et al. Low IgA and IgM is associated with a higher prevalence of bronchiectasis in primary antibody deficiency[J]. Journal of clinical immunology, 2017, 37(4): 329-331.
32. Guo-Parke H, et al. Frontiers in Immunology, 2020, 11.
33. Rovina N, et al. Mediators of Inflammation, 2013, 2013: 413735.
34. 韦佳, 付秀华. 世界最新医学信息文摘, 2018, v.18(16):96-97.
35. 张秋蕊, 等. 国际呼吸杂志, 2013, 33(1):44-47.
36. Bhat T A, et al. Annals of the American Thoracic Society, 2015, 12 Suppl 2(Suppl 2): S169-S175.
37. 程克斌, 等. 国际呼吸杂志, 2019, 39(6):457-461.
38. 李佩琼, 等. 国际呼吸杂志, 2007, 027(012):948-951.
39. Qiu F, et al. Oncotarget, 2017, 8(1): 268.
40. Knobloch J, et al. J Mol Med (Berl). Jun;97(6):817-828.
41. 2021 ATS abstract-A1391-Lower Airway Microbial Signatures in Early COPD
42. Wang Z, et al. Thorax, 2018:thoraxjnl-2017-210741.
43. Cukic V. The Mater Sociomed. 2013 Dec;25(4):226-9.
44. 刁文琦, 等. 中华结核和呼吸杂志, 2018, 041(012)982-985.
45. 慢性阻塞性肺疾病急性加重诊治专家组.慢性阻塞性肺疾病急性加重(慢阻肺急性加重)诊治中国专家共识(2017年更新版)[J]. 国际呼吸杂志, 2017, 37(14): 1041-1057.
46. Siddiqi A, Sethi S. Optimizing antibiotic selection in treating 慢阻肺 exacerbations[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2008, 3: 31-44.
47. GOLD 2023
48. 慢性阻塞性肺疾病诊治指南(2021年修订版)
49. Chest, 2015, 147(4): 883-893.
50. 中国成人流行性感冒诊疗规范急诊专家共识 [J] 中华急诊医学杂志,2019,28(10): 1204-1217.
51. 肺炎链球菌性疾病相关疫苗应用技术指南(2012版)[J].中华流行病学杂志,2012,33(11):1101-1110.
52. 樊静, 丛舒, 王宁, 吕学莉, 等. 2014-2015年中国40岁及以上慢性阻塞性肺疾病患者肺炎疫苗接种状况. 中华流行病学杂志, 2020, 41(7): 1028-1033
53. GOLD 2021
54. 成人支气管扩张症诊治专家共识(2021版)
55. 上-下气道慢性炎症性疾病联合诊疗与管理专家共识(2017)
56. Didierlaurent A M, Laupèze B, Di Pasquale A, et al. Adjuvant system AS01: helping to overcome the challenges of modern vaccines[J]. Expert review of vaccines, 2017, 16(1): 55-63.
57. Dhama K, et al. International Journal of Pharmacology, 2015, 11(4): 253-290.
58. Curr Opin Allergy Clin Immunol, 2018, 18(3): 198-209.
59. Kearney S C, et al. Ann Allergy Asthma Immunol, 2015, 114(5): 364-9.
60. 洪建国. 中国实用儿科杂志, 2013,28(03): 165-168.
61. 各类药物说明书(略)
62. 王丽英等.中国全科医学. 2009,6:489-90.
63. 王爱飞等.中国药物与临床.2012,12(11):1457-58.
64. Pan L, et al. The Journal of Clinical Pharmacology, 2015, 55(10): 1086-1092.
65. Li J, et al. Chin Med J (Engl). 2004;Jun;117(6):828-834.
66. 唐拂晓. 中国实用医药, 2014(17).
67. 武兆山. 临床医药文献电子杂志 2018,5(14),153
68. 董慧君. 中国实用医药, 2018, v.13(24):14-16.
69. Yao S, Qin R, Song X, et al. Bacterial lysate add-on therapy in adult and childhood asthma: a systematic review and meta-analysis[J]. 2023.
专家介绍

王玮
教授、主任医师,博士生/博士后导师;中国医科大学附属一院呼吸与危重症医学科主任,中华医学会呼吸分会常委,中国医师协会呼吸医师分会副会长,中国老年医学学会睡眠分会副会长,辽宁省医学会呼吸分会主任委员,辽宁省医师协会内科医师分会副会长,辽宁省新冠肺炎医疗救治专家组组长,辽宁省特聘教授,辽宁省青年名医,兴辽英才计划百千万人才领军人才,辽宁省优秀科技工作者,辽宁省三八红旗手,辽宁省最美医务工作者,全国五一劳动奖章获得者,中国好医生抗疫特别人物。
*审批编号CN-130080 过期日期2025-2-17
*本材料由阿斯利康提供,仅供医疗卫生专业人士进行医学科学交流,不用于推广目的
本文由《呼吸界》编辑 冬雪凝 整理
本文完
责编:Jerry


