
很高兴与大家一起探讨关于《破解呼吸道感染后咳嗽的治疗困境》。我将分别从感染后咳嗽的疾病负担、导致长期咳嗽的几大重要因素,以及常规治疗效果和新思路几个角度为大家进行阐述,欢迎大家批评指正。
每当谈及咳嗽话题,我的内心都可用“忐忑”二字形容……讲在前面
我做临床工作的30多年里,如果要把我最怕见到的情况分成几个阶段来举例:一、在急诊科工作时,我最惧怕的是急腹症的鉴别诊断;二、担任内科住院医师期间,我最惧怕的是走进院里的感染内科病房,那里有很多发热待查的患者。尽管如今诊断技术已有了长足进步,但当时这些病例在短时间内无法明确诊断,甚至有时在诊断尚未明确的情况下患者就不幸去世,我们不得不进行尸检来确立诊断;三、从整个医疗领域角度看,我最惧怕的恰好就是呼吸内科的咳嗽症状,因为面对患者咳嗽,我们往往缺乏特效药物来缓解。
事实上,我们在感染后咳嗽的治疗方面正面临困境,尽管医学界已了解咳嗽的机制及其引发原因,但在治疗过程中,患者对治疗的反应各异,这种治疗异质性使病情变得更为复杂,严重影响到患者的生活质量。因此,每当我谈及咳嗽话题时,我的内心都可以用“忐忑”二字来形容。做临床工作,正因每个人有这么多的“惧怕”,我们才知道深入研究和解决疑惑的重要性。
为何咳嗽如此难以缓解和治疗,总是让我们陷入困境?研究发现,咳嗽是一种最常见的呼吸道症状,不仅关乎呼吸系统(从鼻腔到肺泡末端),还包括各类原因引发的咳嗽,心血管系统、甚至腹部因素(如胃食管反流、反流性胃食管炎)也可能引发咳嗽。归根结底,咳嗽是由于多种因素作用于气道,导致气道粘膜发生水肿/充血的变化,这种现象的出现源于呼吸系统与其他系统存在特殊差异。
我们知道,为了完成氧气吸入和二氧化碳排出的过程,呼吸系统在静息状态下需每3-5秒与外界进行气体交换,除外皮肤这个最大的器官,呼吸系统就是人体与外界接触最为密切的器官,它极易受到各类外部因素的影响,如感染、非感染,以及化学性刺激等,其病因繁多,恢复过程也相对较慢。
因此,在讲呼吸道感染后咳嗽这个话题之前我很想再次强调,也作为自我警醒:一、当我们在治疗咳嗽病例时,必须在明确病因后再进行治疗,避免因治疗不当导致病情更加复杂,加剧症状,从而陷入恶性循环;二、在治疗过程中,对潜在的病因(诱发因素)进行深入了解,在此基础上遵循科学的方法,避免滥用药物,确保治疗的有效性。
呼吸道病毒流行不止,感染后导致的咳嗽疾病负担沉重
众所周知,今年冬季呼吸道感染病例的特点尤为鲜明,咳嗽症状尤为明显。结合我个人的临床经验和去年新冠疫情放开后的观察,许多新冠感染病例在今年冬季呈现出的症状,以及当前冬季呼吸道病毒的流行(如甲流、乙流等)均值得高度关注。当前正值流感的流行期,因咳嗽就诊的病患日益增多,感染后引发的咳嗽现象愈发明显。
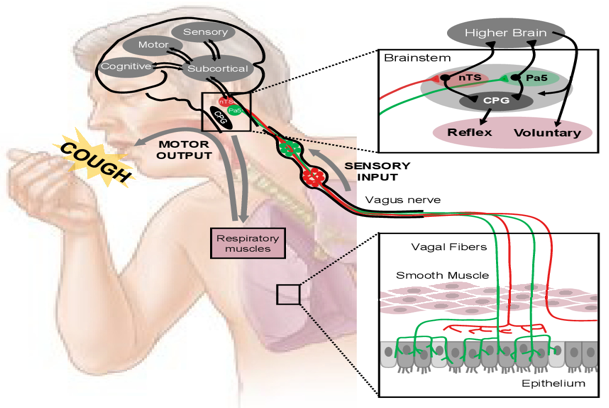
咳嗽首先是机体重要的防御性反射。咳嗽分为两种情况:正常情况下,它防御外界刺激,简单理解,它是机体的生理功能,这种机体的重要防御性反射有利于清除呼吸道分泌物和有害因子(如花粉、粉尘等),人体就会通过咳嗽将其清除出气道。这都源于我们的呼吸道内存在一层薄薄的“粘液毯”,其下有正常摆动的纤毛,以及完整的气道上皮,所以在正常生理状态下的咳嗽现象中,例如吸入某些物质,通过上气道黏膜、粘液毯以及纤毛的摆动,就能够将这些体内不需要的物质通过相应机制排出体外,就是以咳嗽的方式排出。[1]
但疾病状态下的咳嗽可以反映出机体的病理变化,我前面讲到的咳嗽是呼吸专科门诊和社区门诊患者最常见的症状,如感冒后得咳嗽,这种咳嗽说明机体可能出现了呼吸道感染。病理状态下的情况就大不相同了,在病毒感染高发、负荷沉重的情况下,有害刺激会导致气道上皮的损伤性的变化。[1]
气道上皮发生损伤性的变化,这种咳嗽的动作又是怎样的呢?这一点很值得我们弄清楚:气道上皮的损伤变化以及粘液的增多,这都是一种反射性机制,这种损伤变化通过传入神经元系统(包括感觉神经元),再传递至大脑,大脑通过高级中枢处理这些信号,就会促使腹腔压力升高。腹腔压力升高时,身体就会通过有力地收缩动作(咳嗽)这一生理反应来排出多余的气体。在正常情况下,气道要保持清洁,无需过多的分泌物以维持通畅的呼吸道环境,但在病理状态下,我们持续不断地受到各种刺激,加之如气道上皮粘液明显增多等因素,就会使得病毒刺激的负担加重。因此,这时我们气道上皮承受的压力就会变得非常大。这样的咳嗽现象不同于生理性质的正常的防御性反射,而表现为疾病症状,反映出疾病程度的加重,同时大量的分泌物也对患者的日常生活产生显著影响。
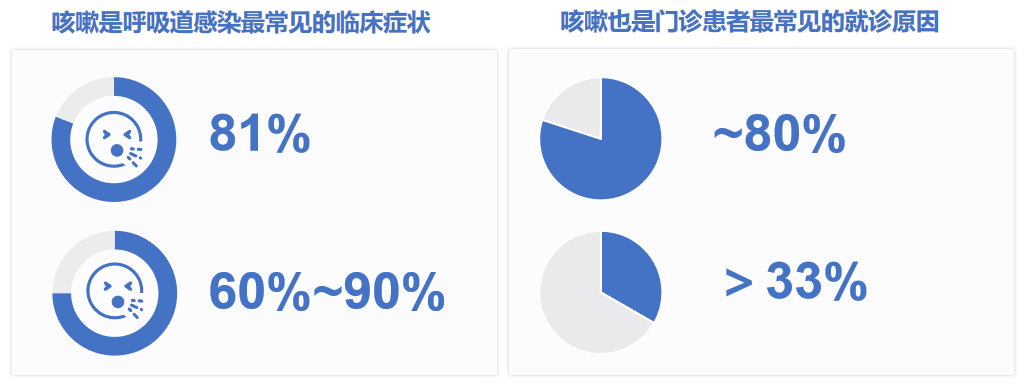
注意看这几个数据:约81%的急性上呼吸道病毒感染患者有咳嗽症状;60%-90%的感冒患者伴有咳嗽症状;约80%呼吸科门诊患者都有咳嗽的症状;我国呼吸专科门诊中,慢性咳嗽患者占比超过三分之一。[2-5]
因此当我们仔细回忆,咳嗽真可谓是呼吸内科最常见的疾病和症状,其症状简单且易于识别。我们在撰写病历时,无论是门诊病历还是住院病历,频繁出现的关键词大都包含有“咳嗽”、“咳痰”和“伴有喘息”。[3]

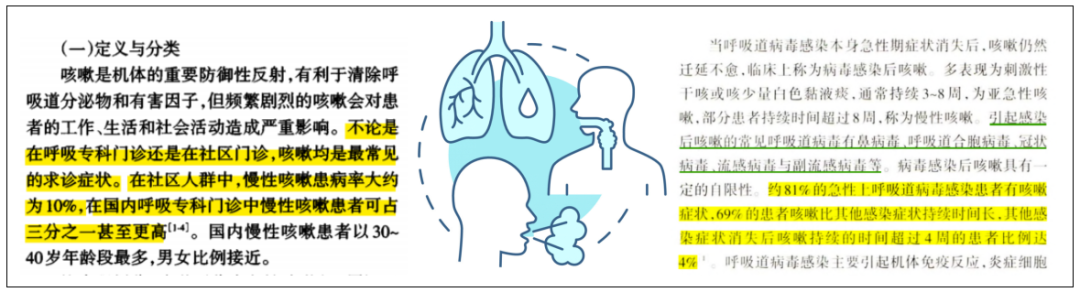
刚才提到我国呼吸专科门诊中慢性咳嗽患者占比超过三分之一,感染急性期后,相当一部分患者仍有咳嗽症状,这些我们称为感染后咳嗽(PIC)。2021年咳嗽的诊断与治疗指南PIC定义如下:“当呼吸道感染的急性期症状消失后,咳嗽仍然迁延不愈,持续 3-8 周,X线胸片(或CT)检查无明显异常者称之为 PIC。”[3、6]
PIC的特征:1.未见X线胸片(或CT)异常;2.表现为刺激性干咳;3.或咳少量白痰;4.多在8周内缓解。实际上我个人的临床体验是近两三年来感觉PIC在8周之内缓解的患者数量与再早几年相比较更少,也就是说更多PIC患者的症状在8周之后甚至更长的时间才能逐渐缓解。有相关研究也是针对新冠前的统计,PIC的发生率:上呼吸道感染患者中为11-25%;肺炎支原体和百日咳流行季,为25-50%。[6-8]
什么样的原因可以引起PIC呢?我们知道,PIC以病毒性感冒引起的咳嗽最为常见,又称为“感冒后咳嗽”。多种呼吸道病原体都与PIC相关:包括呼吸道病毒(包括鼻病毒、冠状病毒、 流感病毒、呼吸道合胞病毒、副流感病毒等)、肺炎支原体、肺炎衣原体、卡他莫拉菌和百日咳杆菌等。[3、6、9]
从病毒类型和占比来区分引起PIC的常见病毒病原体,鼻病毒占比最高,为30%-50%,其次是冠状病毒,占比是10%-15%。流感病毒占比5%-15%,呼吸道合胞病毒和副流感病毒占比均为5%,腺病毒占比<5%,而人偏肺病毒占比不明。可导致PIC的其他呼吸道病原体,感染后长时间持续咳嗽较常见的如百日咳杆菌、肺炎支原体、肺炎衣原体。流感嗜血杆菌、肺炎链球菌、卡他莫拉菌在婴儿、老年人和易感患者中较常见。因此,PIC可以说是横跨病毒、非典型病原体、典型细菌。可由多种呼吸道病原体引起。[9]
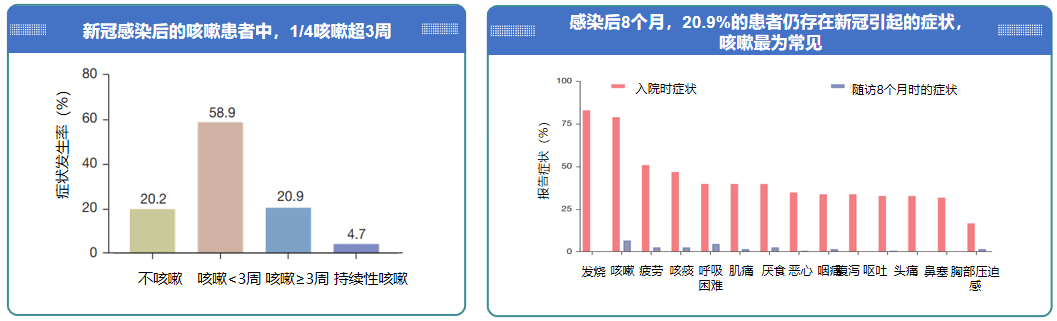
我国一项观察性研究,纳入2020年1-5月129名在荆州市第一人民医院和襄阳中心医院确诊新冠的患者,患者的年龄从19至84岁,随访时间为患者自出院后的8个月。研究分析了新冠感染后咳嗽患者的患病率和危险因素。结果显示,1/4新冠患者咳嗽超3周,8个月时咳嗽仍是最常见症状。[10]

图左这项研究纳入136名感染后慢性咳嗽患者,PCR检测显示58人H1N1阳性,78人H1N1检测呈阴性,19人使用症状问卷、高渗盐水激发和咳嗽监测进行详细临床调查,研究H1N1 流感后慢性咳嗽的患病率、特征和机制。结果显示,感染流感病毒后,持续性咳嗽的发生率为43%,高于非流感患者。[11]
图右是一项前瞻性调查研究,纳入2006年7月-2008年6月的咳嗽患者,咳嗽持续3-8周,但胸部X光片未见异常,研究肺炎支原体、肺炎衣原体和百日咳博德特氏菌血清抗体的阳性率。结果显示,肺炎支原体、肺炎衣原体和百日咳杆菌引发成人长期咳嗽的占比为5.5%、4.1%和9.2%。[12]
这说明,流感病毒、肺炎支原体等感染后亦可导致咳嗽长期不愈。在流感病毒、肺炎支原体、肺炎衣原体、百日咳杆菌等引起的上呼吸道感染后发生的咳嗽,可在急性感染后引发长期咳嗽,甚至可持续8周以上。
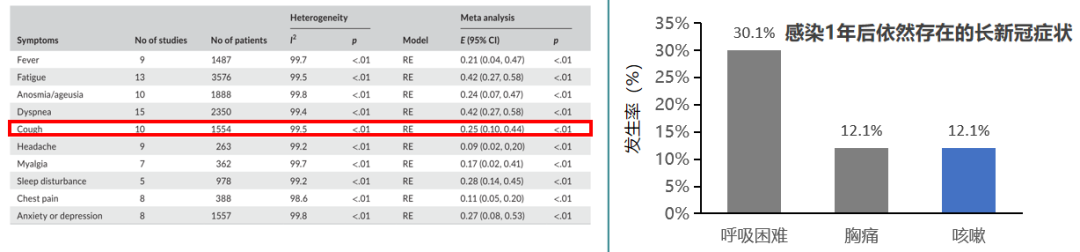
图左一项荟萃分析,纳入了2019年至2021年8月的16项研究共8756名长新冠患者,分析了长新冠患者的症状和持续时间。研究结果表明,长新冠患者中25%存在持续性咳嗽。[13]
图右是一项单中心回顾性研究,纳入欧洲大流行期间,在拉巴斯大学医院确诊为新冠感染的3500名哮喘患者,分析了患者基线数据,实验室检查结果,症状持续情况等。结果显示,哮喘患者感染1年后仍有12.1%存在持续性咳嗽。[14]
因此说明,对于合并呼吸基础疾病的患者,感染后咳嗽迁延不愈的发生风险高。也进一步证明,尤其是新冠感染后咳嗽可迁延不愈,对于存在严重哮喘等呼吸系统基础疾病的患者要更加谨慎,因为这类人群风险更高。
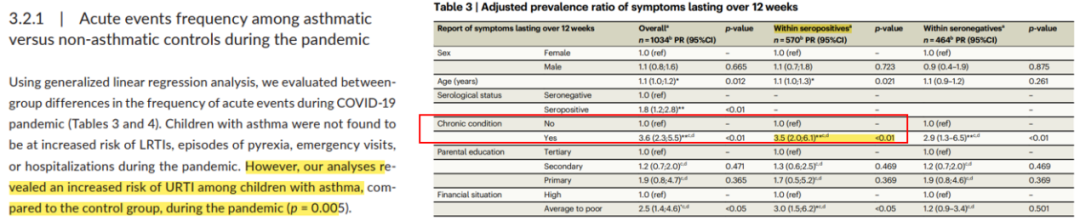
这是澳大利亚的一项回顾性横断面研究,纳入1034例在2021.12-2022.2期间出现类似新冠后遗症症状的6个月-17岁患者。所有受试者接受血清新冠抗体检查,其中55.1%抗体阳性。通过临床信息、临床症状、症状持续时间等信息探究新冠后遗症患病率和危险因素。结果显示,在新冠患者(抗体血清学阳性)中,有哮喘等慢性疾病患者“长新冠”的发生率是没有慢性疾病患者的3.5倍。因此说明,患有哮喘等慢性疾病的患者出现“长新冠”症状的风险更大。[15]
咳嗽长期持续会为患者带来巨大的身心伤害,然而这些伤害现在被普遍低估。慢性咳嗽可引起多种严重并发症,包括晕厥,心律失常,尿失禁,肋骨骨折等。慢性咳嗽患者可出现多种心理健康问题,包括厌烦情绪,焦虑,尴尬,担心受歧视等。[16-19]

根据EQ-5D-3L评分表(欧洲生命质量学会研发的测量健康状态的标准化量表,共包括5个维度,分别是行动能力,自我照顾,日常活动,疼痛和焦虑),满分为1分(完全健康),研究显示,慢性咳嗽患者EQ-5D-3L评分较非慢性咳嗽患者显著降低(0.79 vs. 0.86, p < 0.001),同时研究显示,慢性咳嗽患者抑郁发生率可达53-91%。不仅如此,感染后咳嗽的长期持续可造成严重经济负担。[1、20]
气道和神经炎症、咳嗽高敏感性是导致长期咳嗽的重要因素
讲到PIC的发生机制,无外乎三大块,两个直接的机制和一个间接的机制。
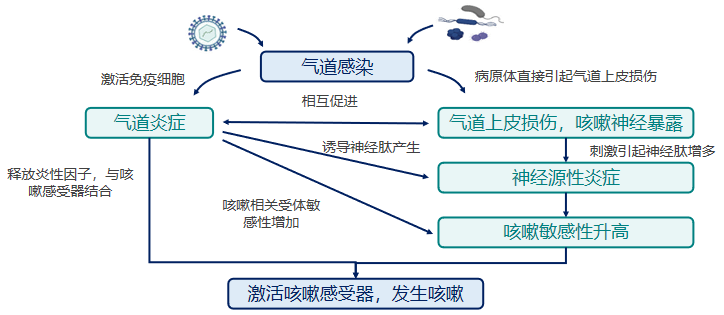
首先我们可以看到,气道受到感染之后的第一个直接的机制就是无论病毒、细菌,病原体感染后它一定要激活免疫细胞,气道的巨噬细胞,一旦被激活之后,加上气道上皮本身的生物防御功能,就会释放细胞因子。细胞因子一旦要释放,会导致气道更多的炎症细胞从血液循环里吸引到气道里,发生气道炎症。这些炎症因子与咳嗽感受器结合就发生咳嗽。病原微生物(尤其病毒)还有一个特点,它除了激发人体的免疫效应之外,会直接导致气道上皮的完整性发生破坏,因此更多的病原体容易通过气道上皮侵及到气道粘膜下进入血循环。另外还有一个方面,在相对大的气道里,咳嗽神经会裸露出来,神经一旦裸露出来就非常容易直接受到病原体的刺激,释放更多的神经肽,导致神经源性的炎症,使咳嗽敏感度增高,咳嗽阈值降低。这二者之间是相互促进的。[21-23]
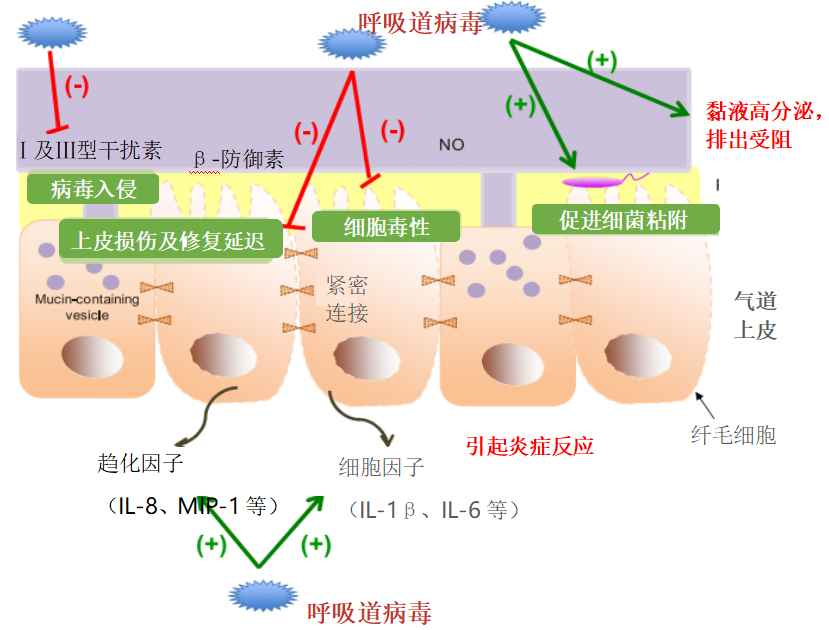
从这张图更能清晰地看到病毒感染对气道上皮的损伤作用:一,完整性破坏。病毒导致上皮细胞凋亡,细胞间紧密连接遭到破坏;二、黏液高分泌,排出受阻。刺激黏液分泌,影响纤毛摆动,导致黏液聚集;三、影响气道免疫反应。减少干扰素的合成,诱导炎症趋化因子和细胞因子生成,抑制气道免疫反应,引发炎症反应;四、促进细菌定植。促进细菌粘附在气道上皮,帮助细菌突破上皮屏障。[24]
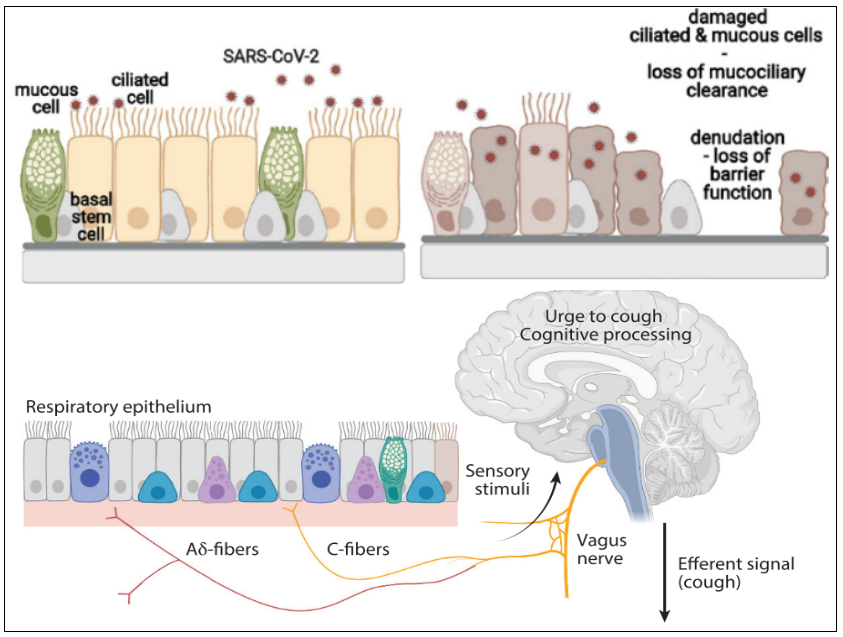
刚才提到的气道上皮损伤导致外周咳嗽神经暴露。图中Aδ-纤维快适应感受器(RAR)刺激阈值低,传导速度快,是诱发咳嗽的主要纤维。C纤维是无髓鞘的迷走传入神经,在整个呼吸道均匀分布。我们以新冠病毒感染为例:新冠可感染表达ACE2的气道上皮纤毛细胞,随后复制并感染邻近细胞;受感染的气道上皮细胞脱落,导致气道上皮屏障严重受损;上皮屏障损伤后,直接暴露气道上皮下的咳嗽感受器,包括Aδ纤维和C纤维,引起咳嗽高敏感性。[3、21、25]
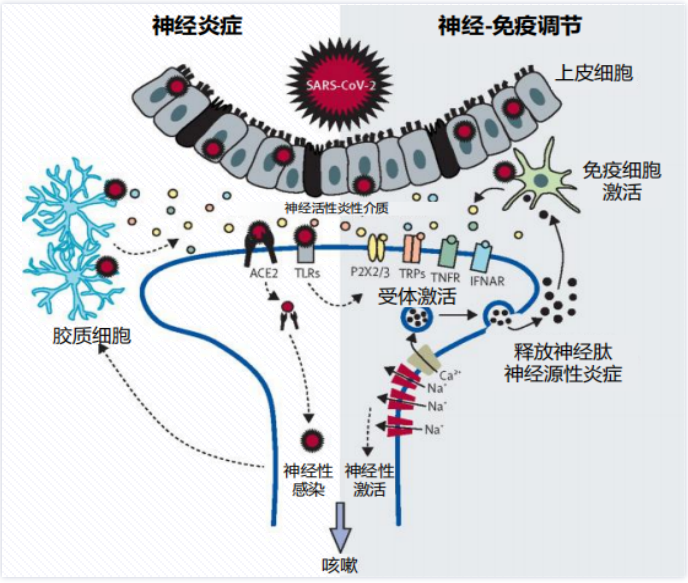
同样这也是以新冠病毒为例的感染诱导神经源性炎症的机制。一、新冠病毒直接侵蚀迷走神经。感觉神经元亦存在ACE2受体(血管紧张素转化酶2,新冠病毒主要依靠其表面的S蛋白上的受体结合域识别宿主细胞ACE2,并与之结合感染宿主细胞),因此新冠病毒可能侵袭迷走神经的感觉神经元与神经胶质细胞等,诱发神经肽与炎性介质释放,从而引起咳嗽;二、引起局部神经炎症。参与新冠病毒感染与识别的上皮细胞及炎症细胞(如巨噬细胞、中性粒细胞、淋巴细胞等)可以释放多种细胞因子与炎性介质;三、持续神经炎症导致咳嗽高敏感性。神经肽与神经炎性介质可进一步招募和激活免疫细胞,导致肺部与气道炎症,增强咳嗽敏感性。进一步说明,病毒可激活神经源性炎症,导致咳嗽敏感性升高。[26]
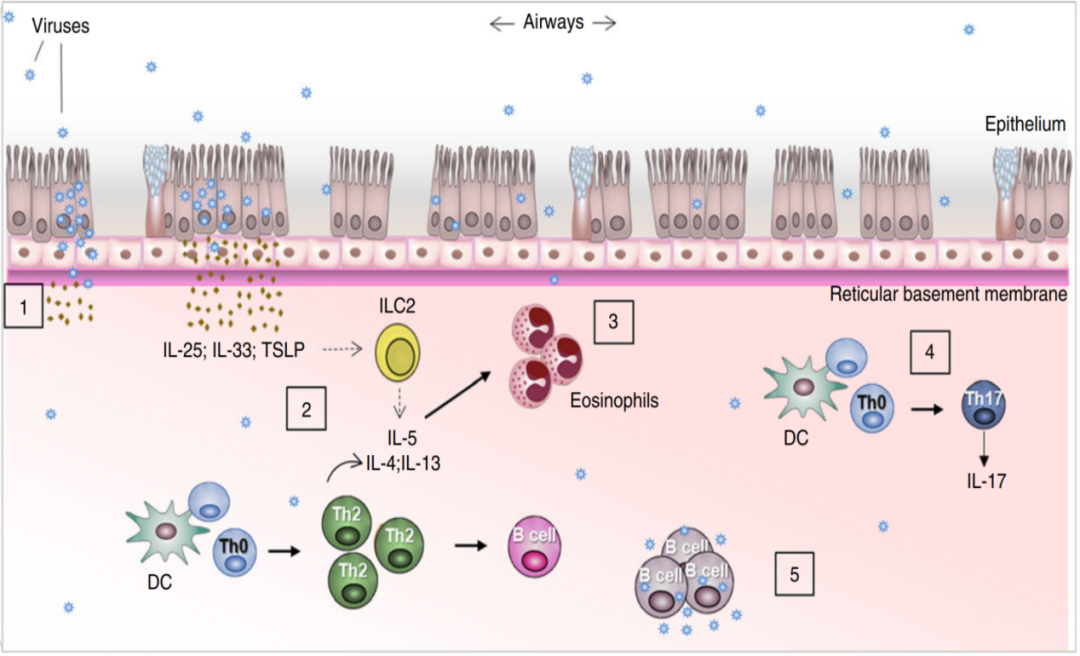
病毒感染呼吸道引发的气道炎症反应普遍存在。重点讲讲图中2、3、4、5标注的病毒感染诱发过度炎症反应。标注2表示的是促炎症因子的产生增加,如IL-25、IL-33和TSLP等,严重时可产生细胞因子风暴;标注3表示的是诱导免疫细胞激活,如ILC2s细胞、树突状细胞(DCs)、嗜酸性粒细胞、Th2细胞等,增强Th2型炎症反应;标注4表示的是IL-17表达上调(由Th17细胞分泌的促炎细胞因子),可诱导炎症、黏液高分泌和促进 Th2 炎症反应;标注5表示的是病毒可感染免疫细胞,如B细胞、巨噬细胞或T细胞,有助于病毒的复制和传播。[27]
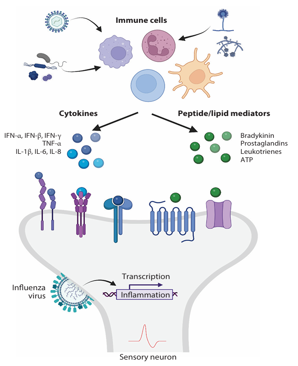
病毒在气道里诱发的是气道炎症,而气道炎症的多种炎性因子/介质可与咳嗽感受器结合,激发咳嗽。比如:病原体激活免疫细胞,释放炎性因子以及肽类和脂类炎性介质;炎性因子与细胞因子受体结合,刺激咳嗽产生;肽类和脂类炎性介质可与感觉神经上的G蛋白偶联受体,离子通道结合,刺激咳嗽产生;流感病毒可直接感染迷走神经,导致迷走神经炎症。[21]
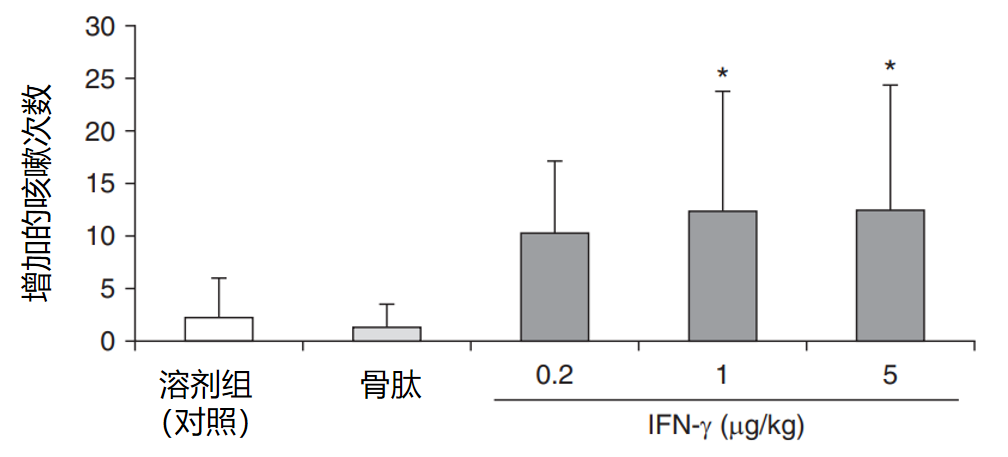
病毒感染后产生炎性因子IFN-γ可引发咳嗽高敏感性。IFN-γ有一个非常有意思的特点。我们知道,咳嗽感觉神经元经病毒侵袭后,可释放大量细胞因子,同时触发局部神经-免疫反应,进一步募集炎症细胞,释放更多细胞因子,其中包括IFN-γ。而肺部聚集的T淋巴细胞可以释放IFN-γ等细胞因子,刺激IFNγ诱导蛋白10(IP‑10)、IFN‑γ诱导单核细胞因子(MIG)的表达与分泌,进一步募集活化的T淋巴细胞,再分泌IFN-γ等细胞因子,形成炎症正反馈,引起持续性咳嗽。IFN‑γ可通过JAK/STAT‑PKA‑AMPA 途径诱导迷走神经元Ca2+内流和膜电位去极化,使神经纤维的静息电位更加接近阈电位,从而增加气道的咳嗽敏感性。而这项动物研究对豚鼠先给与雾化柠檬酸诱导咳嗽,测得基线咳嗽次数,7天后在豚鼠气管内滴入单独溶剂(生理盐水)或含药物溶剂0.2ml,5小时后再次给与雾化柠檬酸诱导咳嗽,获得增加的咳嗽次数。(* 可骨肽组相比,p<0.05)。研究显示,IFN-γ可增强豚鼠咳嗽敏感性。[23、28、29]
前面提到过,病毒感染后气道上皮一旦发生损伤,除了产生炎症反应之外还有一点就是病毒侵入到了细胞里面,相对而言就很难清除掉,它可能在呼吸道中存在很长时间,所以这也就能够解释患者为什么持续咳嗽可以长达8周、12周以上甚至半年、1年也不足为奇,尽管这样的例子少见但一定存在。这就让我们要去分析为什么感染过去了咳嗽还长期存在。
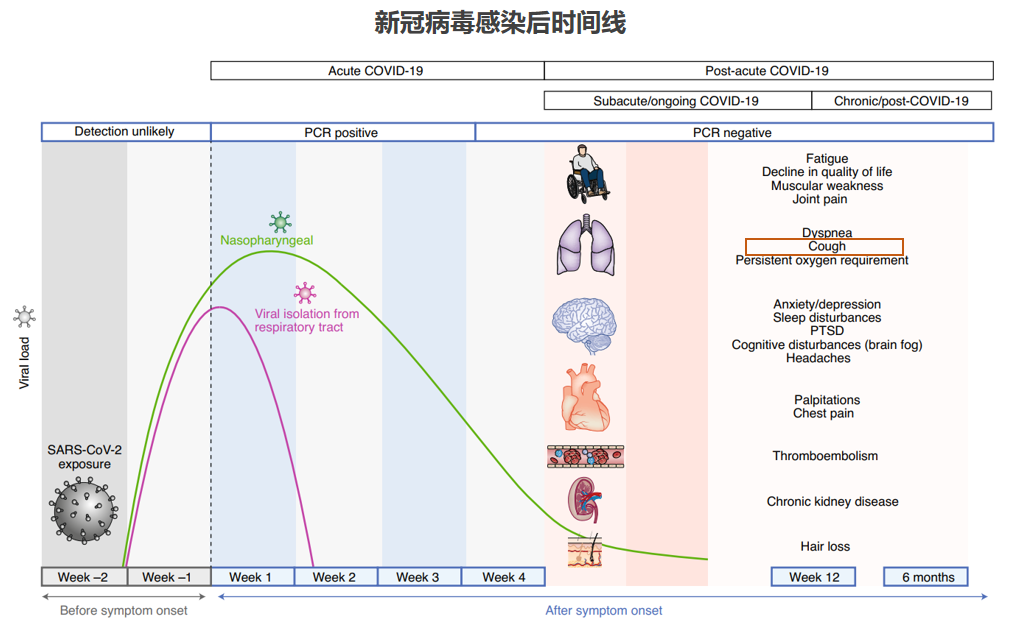
依然以新冠感染为例,新冠病毒感染后,鼻咽部的病毒可长时间存在超过4周以上。病毒的存在,可持续性产生气道上皮损伤和气道炎症、持续刺激迷走神经产生神经源性炎症,从而产生咳嗽高敏感性。咳嗽症状可持续12周,甚至6个月以上。[30]
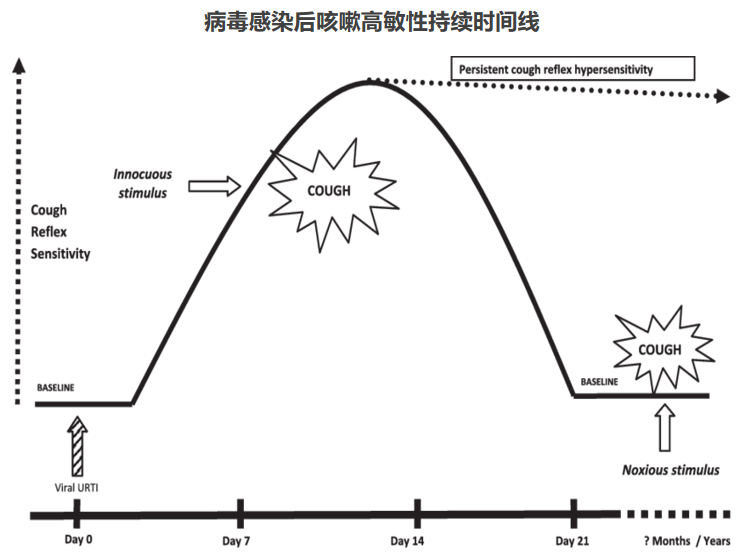
多种因素可导致咳嗽高敏感性持续存在。病毒感染后,咳嗽反射过度反应,咳嗽高敏感性会在一段时间内(2-3周)持续激活,在此期间内,多种无害刺激(如,气味、气溶胶、气温和环境变化等)也可以引起咳嗽。通常咳嗽高敏感性在持续3周后,多数患者中会发生下降,咳嗽反射反应恢复到基线状态。在某些情况下,咳嗽高敏感性可持续很长时间,导致慢性咳嗽状态,包括:吸烟、哮喘、慢性阻塞性肺疾病(COPD)、胃食管返流(GORD)、血管紧张素转化酶抑制剂(ACEI)治疗、过敏等。[31]

感染后咳嗽的持续原因另一个方面是过量炎症因子持续表达,刺激气道高反应性。以肺炎支原体为例:感染引起气道高反应的可能机制。一、Th1/Th2 比例失衡。MP感染导致Th1/Th2比例失衡,使Th2细胞因子(如IL-4、IL-5、IL-6等)占主导优势,这些细胞因子同时在支气管哮喘中也有所表达;二、Th17/Treg比例失衡。MP感染后引起的Notch通路异常及Th17/Treg比例的失衡均可通过其特殊的途径引起气道高反应性,参与哮喘的发生与发展过程;三、其他因素。MP感染后TNF-ɑ水平明显增加,加重气道高反应性;MPP患儿VEGF水平比不伴喘息症状者显著增加,VEGF在气道高反应性的发生过程至关重要;MPP发生后引起的ICAM-1表达量的增加也会引起气道高反应性。[32]
上图右是乙酰甲胆碱雾化激发后MP小鼠和对照组的气道高反应性比较。在BALB/c小鼠鼻腔接种MP一次,分别于接种后109、150、245、368和530天取样,530天后,78%的MP小鼠表现出异常的组织病理学,其特征是支气管周围和血管周围的单核细胞浸润。体积描记法结果显示:MP小鼠在第245天时,气道高反应性显著高于对照组(P=0.03),在 530 天时有气道高反应性增加的趋势 (P=0.07)2。[33]
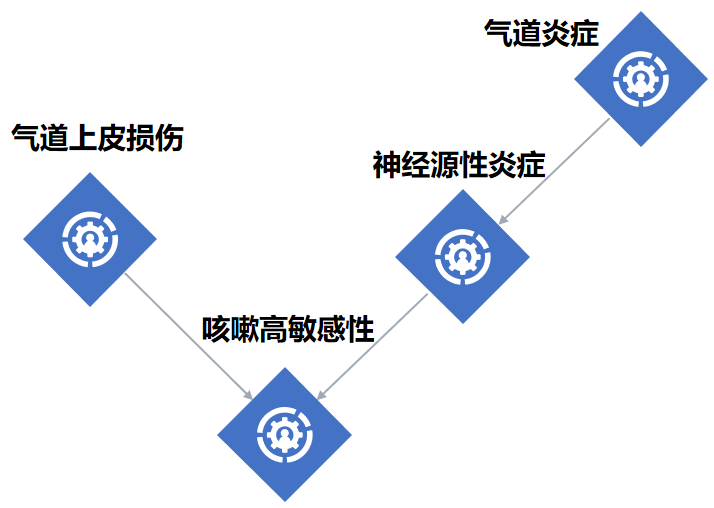
小结 [21-23]
气道上皮损伤、神经炎症及咳嗽高敏感性长期存在,是导致感染后咳嗽迁延不愈的重要因素。
气道上皮损伤和气道炎症是感染后咳嗽(PIC)的核心发病机制。
气道上皮损伤:病毒感染呼吸道,可导致气道上皮细胞损伤,暴露咳嗽神经暴露,激活神经源性炎症,导致咳嗽敏感性升高。同时,气道上皮细胞损伤还引发气道炎症反应。
气道炎症:多种炎性因子/介质可与咳嗽感受器结合,激发咳嗽;诱导神经肽产生,导致神经源性炎症;刺激咳嗽相关受体敏感性增加;促进气道上皮损伤,导致咳嗽敏感性升高。
神经源性炎症:释放的神经肽与神经炎性介质可进一步招募和激活免疫细胞,导致肺部与气道炎症,增强咳嗽敏感性。
咳嗽高敏感性:是PIC发生的主要原因,气道炎症、神经源性炎症和气道上皮损伤是基础。
PIC常规治疗效果有限,抗炎及降低咳嗽敏感性提供新思路
对于PIC的治疗,我们主要还是以经验性治疗为主,但同时也要知道,有时候经验性治疗的效果也比较有限。首先要明确咳嗽是否继发于先前的呼吸道感染再进行经验性治疗。经验性治疗包括:1.镇咳药:外周镇咳药物疗效差,不建议选用;咳嗽症状明显者建议选用中枢性镇咳药物,如可待因、右美沙芬、海罂粟碱等;2.抗组胺药及减充血剂:咳嗽症状明显的患者建议短期应用。指南指出,复方甲氧那明治疗有一定效果(2C);3.抗菌药物:不建议常规使用;但对于肺炎支原体、肺炎衣原体、百日咳造成的PIC,应及早应用大环内酯类抗生素;4.其他。[3、6]
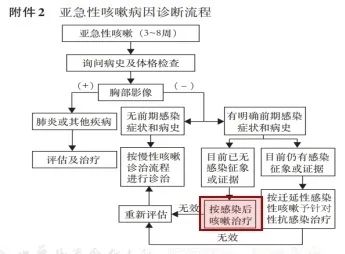
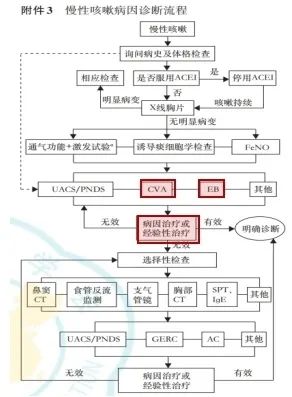
图:咳嗽的诊断与治疗指南
经验治疗无效者,考虑其他病因并参考慢性咳嗽诊断流程进行诊治。一、单纯依靠感冒或上呼吸道感染的病史和咳嗽症状诊断,可能会造成CVA,EB的漏诊;二、对于按PIC常规治疗无效的亚急性咳嗽,建议有条件时应进行支气管激发试验、诱导痰细胞学检查等,或进行其他病因的经验性治疗。[6、34]
可针对慢性咳嗽的常见病因进行相应经验性治疗,其中包括:[6]
病史推测:
1.主要夜间或凌晨刺激性咳嗽:可先按咳嗽变异性哮喘(CVA)进行治疗;
2.咳嗽伴有明显反酸、暖气、胸骨后烧灼感:考虑胃食管反流性咳嗽(GERC)的治疗;
3.咳嗽伴流涕、鼻塞、鼻痒、频繁清喉及鼻后滴流感:可先按上气道咳嗽综合征/鼻后滴流综合征(UACS/PNDS)进行治疗。
临床特征:
1.分为激素敏感性咳嗽(包括CVA、EB及AC)、UACS和GERC进行经验治疗;
2.怀疑激素敏感性咳嗽:可使用小剂量激素治疗;
3.UACS/PNDS、AC和PIC等:可使用镇咳药、抗组胺药及减充血剂等经验治疗。

防患未然,使用免疫调节剂预防反复呼吸道感染,也是减少PIC的措施。免疫调节剂可增强机体对多种病原的防御:提供非特异性的免疫调节,意味着固有免疫和适应性免疫中免疫应答的更普遍变化,从而导致宿主对许多不同抗原的反应性发生改变。免疫调节剂不直接影响微生物,因此可避免耐药性快速出现的问题;同时,免疫调节剂可提供针对细菌、病毒和真菌疾病的广谱预防反复感染能力,出现罕见病原体时提供非特异性的紧急治疗方案;与疫苗协同使用,可增强或调节患者的固有免疫应答。能非特异性诱导人体进入“预警”状态,增强整体免疫应答水平。最主要的是,对于反复呼吸道感染,预防策略才是临床管理的基石,因为预防能减少感染的反复发作。通过防止后续的感染,对患者的长期预后能产生有益的影响。[35、36]

注明:Th(辅助T细胞);IFN(干扰素);IL(白介素)
临床有哪些常用免疫调节剂呢?微生物制剂如细菌溶解产物,这是现在医院用得最多的免疫调节剂,其作用机制-固有免疫:提升吞噬细胞杀灭病原体活性,刺激单核细胞活性,促进非特异性免疫;刺激Toll样受体,提高抗原递呈细胞的活性。适应性免疫:促进T细胞转化,增加调节T细胞数量和活性,调节Th1/Th2向Th1飘移;激活B细胞,增加免疫球蛋白的含量。适用人群是6个月及6个月以上的儿童及成人。[37-39]
化学制剂如匹多莫德,作用机制-固有免疫:增强巨噬细胞、中性粒细胞吞噬活性和趋化性,激活NK细胞;适应性免疫:促进T细胞增殖,纠正辅助性T细胞/抑制性T细胞比值,增加IL-2和IFN-γ。适用人群是3岁及3岁以上的儿童及成人。[38、39]
生物制剂分胸腺肽和脾氨肽。胸腺肽的作用机制-适应性免疫:促进胸腺淋巴细胞分化、发育和成熟,调节CD4+/CD8+平衡;间接调节B淋巴细胞,提供免疫球蛋白的含量。适用于成人,但儿童及老年患者慎用。脾氨肽的作用机制-适应性免疫:增强细胞免疫功能,纠正Th1/Th2的不平衡,提高血IL-4和IFN-ϒ水平,使CD4+ /CD8+比值上升。适用于成人,儿童及老年患者疗效及安全性尚不明确。[39-41]
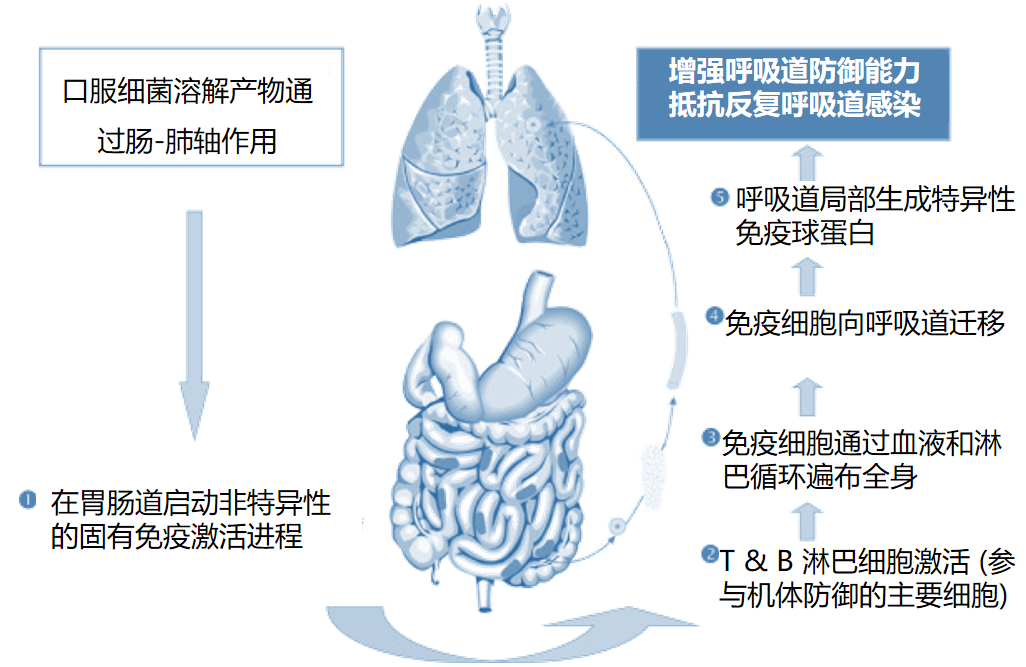
细菌溶解产物是增强呼吸道免疫防御,预防反复呼吸道感染。口服细菌溶解产物通过M细胞进入小肠内派尔集合淋巴结,激活黏膜免疫。活化后免疫细胞及免疫球蛋白通过血液循环和淋巴循环进入肺部,分布到支气管相关淋巴组织(BALT)。在呼吸道局部生成特异性免疫球蛋白,增强免疫力以抵抗反复呼吸道感染。[42、43]
还有OM-85。一项系统性回顾和荟萃分析,纳入5项随机对照研究工1190例慢阻肺病患者,观察OM-85对慢阻肺病患者的疗效及安全性,其中4篇研究评估了OM-85的安全性。[44]
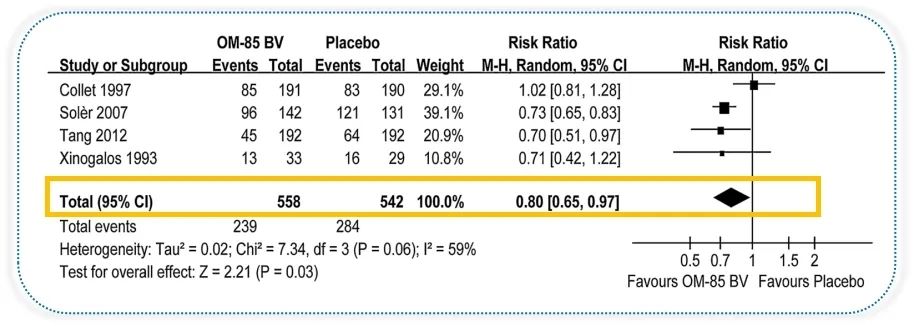
研究结果显示,OM-85可使慢阻肺病急性加重率显著降低20% (RR = 0.80; 95%CI 0.65 - 0.97;P<0.03)。[44]

OM-85可使慢阻肺病患者抗生素使用率显著降低39% (RR=0.61,95%CI 0.48 - 0.77;P<0.0001)。[44]
Meta分析显示,细菌溶解产物OM-85可大幅降低慢阻肺病患者急性加重率和抗生素使用。[44]
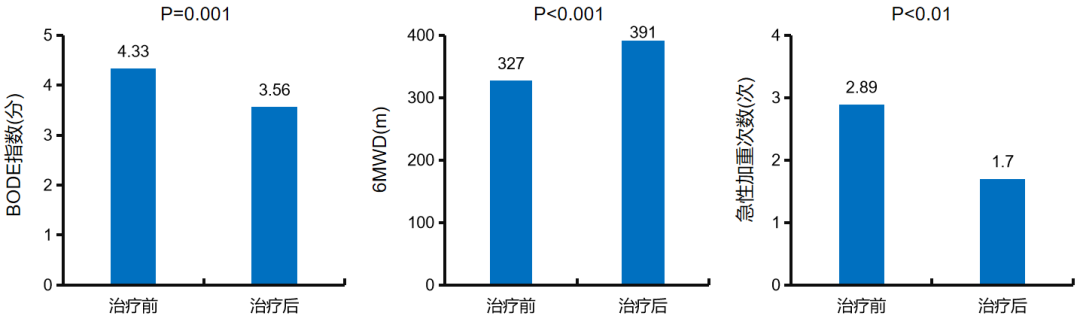
一项研究纳入27 例有长期吸氧指征的慢阻肺病稳定期患者,在常规治疗基础上予以匹多莫德800 mg,1 次/d,共60d,联合每日家庭氧疗,共治疗1年,观察匹多莫德联合长期氧疗治疗1年后的慢阻肺病急性加重和症状较治疗前的变化。BODE指数评分:为四种因素参与的多维评价系统,即体质量指数、气流阻塞程度、呼吸困难及运动能力,分数越高,患者状况越差;6MWD:患者于6分钟内尽可能快地在室内一条长30m的道路上往返的距离。开始治疗1年后,匹多莫德联合长期氧疗组慢阻肺病患者的症状和活动能力相比治疗前得到改善,急性加重的次数减少。因此,匹多莫德可改善稳定期慢阻肺病症状、减少急性加重的发作次数。临床上,匹多莫德更多用于小孩比较多。[45]
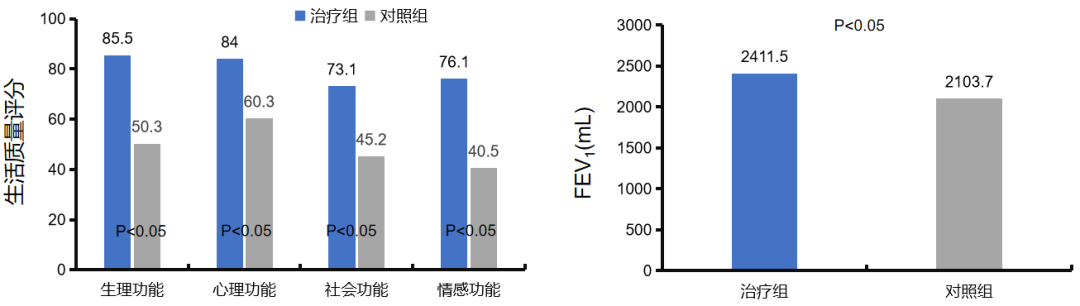
同样也有研究表明,胸腺肽有助于改善老年慢阻肺病患者的肺功能和生活质量。图左选取2015年1月2017年1月老年慢阻肺病急性加重期患者40例作为研究对象,将其随机分为两组,各20例,其中对照组采用抗生素治疗,治疗组采取胸腺肽联合抗生素治疗,观察两组患者的治疗效果。研究显示,胸腺肽α1联合抗生素组的老年慢阻肺病患者生活质量显著高于对照组。[46]
图右纳入60例老年慢阻肺病急性加重期患者,根据治疗方案不同分为对照组与治疗,每组30例。对照组患者接受常规对症治疗,治疗组患者在对照组基础上同时给予胸腺肽α1辅助治疗,旨在探讨老年慢阻肺病急性加重患者在对症治疗基础上辅以胸腺肽α1对病情的干预效果。研究显示,胸腺肽α1辅助治疗组的老年慢阻肺病患者肺功能显著高于对照组。[47]
总而言之,我们在使用免疫调节剂时一定要根据患者的临床实际情况而定,比如打胸腺肽我个人就有些犹豫,尽管从文献上看它对于慢阻肺病患者而言在肺功能的改善方面有一定帮助,但以我自己的经验来讲我更多是用OM-85。对于PIC的治疗,我们不但要注意到它的咳嗽机制,还有引起它发生的原因,治疗时,在为患者提供止咳、化痰的同时,一定不要乱用药物。还有很重要的一点就是在治疗时也要变换思路,比如通过免疫调节剂来提高呼吸道上皮的完整性,加固“大堤”,这样才能加速恢复的进程,避免下一次的咳嗽急性加重和呼吸道感染造成的急性加重。
参考文献
1. 中华医学会呼吸病学分会哮喘学组. 咳嗽的诊断与治疗指南(2021)[J]. 中华结核和呼吸杂志, 2022, 45(1): 13-46. doi:10.3760/cma.j.cn112147-20211101-00759.
2. Eccles R, Dicpinigaitis P, Turner R B, et al. Characterization of urge to cough and cough symptoms associated with the common cold: results of a US internet survey[J]. Postgrad Med, 2016, 128(5): 485-91. doi:10.1080/00325481.2016.1185376.
3. 赖克方, 聂怡初. 感染后咳嗽发病机制、诊断与治疗研究进展[J]. 中华肺部疾病杂志(电子版), 2014, 7(5): 1-5. doi:10.3877/cma.j.issn.1674-6902.2014.05.001.
4. 邓伟吾. 慢性咳嗽的诊断和治疗[J]. 国际呼吸杂志, 2005, 25(1):70-72.
5. Lai K, Pan J, Chen R, et al. Epidemiology of cough in relation to China[J]. Cough, 2013, 9(1): 18.
6. 中华医学会呼吸病学分会哮喘学组. 咳嗽的诊断与治疗指南(2021)[J]. 中华结核和呼吸杂志, 2022, 45(1): 34
7. Jiang W, Qi J, Li X, et al. Post-infectious cough of different syndromes treated by traditional Chinese medicines: A review[J]. Chin Herb Med, 2022, 14(4): 494-510. DOI:10.1016/j.chmed.2022.09.002
8. 林江涛, 张晓岩. 勿将感染后咳嗽诊断为咳嗽变异性哮喘[J]. 中华结核和呼吸杂志, 2019, 42(3): 3
9. Braman S S. Postinfectious Cough: ACCP Evidence-Based Clinical Practice Guidelines[J]. Chest, 2006, 129(1): 138S-146S. doi:10.1378/chest.129.1_suppl.138S.
10. Chen Y, Zhang X, Zeng X, et al. Prevalence and risk factors for postinfectious cough in discharged patients with coronavirus disease 2019 (COVID-19)[J]. Journal of Thoracic Disease, 2022, 14(6): 2079.
11. Ryan N M, Vertigan A E, Ferguson J, et al. Clinical and physiological features of postinfectious chronic cough associated with H1N1 infection[J]. Respir Med, 2012, 106(1): 138-44. doi:10.1016/j.rmed.2011.10.007.
12. Ishida T, Yokoyama T, Iwasaku M, et al. [Clinical investigation of postinfectious cough among adult patients with prolonged cough][J]. Nihon Kokyuki Gakkai Zasshi, 2010, 48(3): 179-85.
13. Rochmawati E, Iskandar A C, Kamilah F. Persistent symptoms among post‐COVID‐19 survivors: A systematic review and meta‐analysis[J]. Journal of Clinical Nursing, 2022.
14. Laorden D, Domínguez-Ortega J, Carpio C, Barranco P, Villamañán E, Romero D, Quirce S, Álvarez-Sala R; ASMA@COVIDHULP group. Long COVID outcomes in an asthmatic cohort and its implications for asthma control. Respir Med. 2022 Dec 16;207:107092.
15. Dumont R, Richard V, Lorthe E, et al. A population-based serological study of post-COVID syndrome prevalence and risk factors in children and adolescents. Nat Commun. 2022;13(1):7086. Published 2022 Nov 29. doi:10.1038/s41467-022-34616-8
16. 张亦南, 王涛, 刘德行, et al. 慢性咳嗽的研究进展[J]. 中华结核和呼吸杂志, 2021, 44(7): 645-650.
17. 李斌恺, 赖克方, 王法霞, et al. 慢性咳嗽患者的生活质量调查[J]. 国际呼吸杂志, 2011, 31(5):3.
18. Dicpinigaitis PV, Tso R, Banauch G. Prevalence of depressive symptoms among patients with chronic cough. Chest. 2006 Dec;130(6):1839-43.
19. Won H-K, Song W-J. Impact and disease burden of chronic cough[J]. Asia Pacific Allergy, 2021, 11(2).
20. 梁瀚文,易芳,陈玥晗,等. 中国慢性咳嗽流行病学调查的现状与展望[J]. 中华结核和呼吸杂志,2022,45(1):100-106.
21. Naqvi K F, Mazzone S B, Shiloh M U. Infectious and Inflammatory Pathways to Cough[J]. Annu Rev Physiol, 2022. DOI:10.1146/annurev-physiol-031422-092315
22. 叶新民, 刘春丽, 钟南山, et al. 感染后咳嗽及其神经源性炎症机制研究进展[J]. 中华哮喘杂志(电子版), 2010
23. 李凤英, 邓政. 病毒感染后咳嗽发病机制的研究进展[J]. 中华结核和呼吸杂志, 2022, 45(2): 5
24. Vareille M, Kieninger E, Edwards M R, et al. The airway epithelium: soldier in the fight against respiratory viruses[J]. Clinical microbiology reviews, 2011, 24(1): 210-229.
25. Bridges J P, Vladar E K, Huang H, et al. Respiratory epithelial cell responses to SARS-CoV-2 in COVID-19[J]. Thorax, 2022, 77(2): 203-209.
26. Song W-J, Hui C K, Hull J H, et al. Confronting COVID-19-associated cough and the post-COVID syndrome: role of viral neurotropism, neuroinflammation, and neuroimmune responses[J]. The Lancet Respiratory Medicine, 2021, 9(5): 533-544.
27. Dawre S, Maru S. Human respiratory viral infections: Current status and future prospects of nanotechnology-based approaches for prophylaxis and treatment[J]. Life Sci, 2021, 278: 119561. doi:10.1016/j.lfs.2021.119561.
28. Kim Y C, Song W J. Neuro-Immune Interactions and IFN-gamma in Post-Infectious Cough[J]. Allergy Asthma Immunol Res, 2022, 14(6): 581-584.
29. Deng Z, Zhou W, Sun J, et al. IFN-γ Enhances the Cough Reflex Sensitivity via Calcium Influx in Vagal Sensory Neurons[J]. American Journal of Respiratory and Critical Care Medicine, 2018, 198(7): 868-879.
30. Nalbandian A, Sehgal K, Gupta A, et al. Post-acute COVID-19 syndrome[J]. Nat Med, 2021, 27(4): 601-615. doi:10.1038/s41591-021-01283-z.
31. Mcgarvey L P, Elder J. Future directions in treating cough[J]. Otolaryngol Clin North Am, 2010, 43(1): 199-211, xii. doi:10.1016/j.otc.2009.11.011.
32. 那颖,于少飞. 肺炎支原体感染引起儿童气道高反应性的研究进展[J]. 内蒙古医学杂志,2022,54(7):836-839,843. DOI:10.16096/J.cnki.nmgyxzz.2022.54.07.019.
33. Hardy RD, Jafri HS, Olsen K, Hatfield J, Iglehart J, Rogers BB, Patel P, Cassell G, McCracken GH, Ramilo O. Mycoplasma pneumoniae induces chronic respiratory infection, airway hyperreactivity, and pulmonary inflammation: a murine model of infection-associated chronic reactive airway disease. Infect Immun. 2002 Feb;70(2):649-54. doi: 10.1128/IAI.70.2.649-654.2002.
34. 中华医学会呼吸病学分会, 国家呼吸医学中心. 新型冠状病毒感染咳嗽的诊断与治疗专家共识[J]. 中华结核和呼吸杂志, 2023, 46(3): 217-227. doi:10.3760/cma.j.cn112147-20230109-00010.
35. Dhama K, Saminathan M, Jacob S S, et al. Effect of immunomodulation and immunomodulatory agents on health with some bioactive principles, modes of action and potent biomedical applications[J]. International Journal of Pharmacology, 2015, 11(4): 253-290.
36. Schaad US, et al. Arch Pediatr Infect Dis. 2016 January;4(1):e31039.
37. Kearney S C, et al. Ann Allergy Asthma Immunol, 2015, 114(5): 364-9.
38. 洪建国. 中国实用儿科杂志, 2013,28(03): 165-168.
39. 相关药物说明书(略).
40. 王丽英等.中国全科医学. 2009,6:489-90.
41. 王爱飞等..中国药物与临床.2012,12(11):1457-58.
42. Rossi G A, Pohunek P, Feleszko W, et al. Viral infections and wheezing-asthma inception in childhood: is there a role for immunomodulation by oral bacterial lysates?[J]. Clinical and translational allergy, 2020, 10: 17-17.
43. De Benedetto F, Sevieri G. Prevention of respiratory tract infections with bacterial lysate OM-85 bronchomunal in children and adults: a state of the art[J]. Multidiscip Respir Med, 2013, 8(1): 33.
44. Pan L, Jiang X G, Guo J, et al. Effects of OM‐85 BV in patients with chronic obstructive pulmonary disease: A systematic review and meta‐analysis[J]. The Journal of Clinical Pharmacology, 2015, 55(10): 1086-1092.
45. 唐拂晓.匹多莫德联合长期氧疗治疗慢性阻塞性肺疾病稳定期的效果观察[J].中国实用医药, 2014(17):2.DOI:CNKI:SUN:ZSSA.0.2014-17-010.Jessica-崔煦洁:http://www.zgsyyy.cn/
46. 武兆山. 胸腺肽联合抗生素对老年慢阻肺急性加重期的治疗效果[J]. 临床医药文献电子杂志,2018,5(14):153. DOI:10.3877/j.issn.2095-8242.2018.14.121.
47. 董慧君. 胸腺肽α1辅助治疗方案对老年慢阻肺患者急性加重期的临床疗效探析[J]. 中国实用医药,2018,13(24):10-12. DOI:10.14163/j.cnki.11-5547/r.2018.24.005.
专家介绍

高金明
北京协和医学院特聘教授,协和学者,北京协和医院呼吸内科主任医师、博士生导师。1991年毕业于天津医学院医学系,在中国协和医科大学先后获得硕士、博士学位,在哈佛医学院完成博士后训练。在北京协和医院历任内科住院和总住院医师、呼吸内科主治医师、副主任医师和主任医师。主要临床和研究方向慢性肺部炎症性疾病。作为第一完成人获2009年中华医学科技奖三等奖(课题:支气管哮喘的基础和临床研究);2006年入选“教育部新世纪优秀人才支持计划”;是国家科技奖评审专家;连续获得国家自然和北京自然科学基金等多项科研基金的资助,在 JBC,Thorax,Blood,Respiratory Research,Respiration等杂志发表多篇研究论文。
审批编号CN-129858 过期日期2025-2-4
*本材料由阿斯利康提供,仅供医疗卫生专业人士进行医学科学交流,不用于推广目的
本文由《呼吸界》编辑 冬雪凝 整理
本文完
责编:Jerry


