
很高兴与大家一起分享《呼吸道感染与免疫治疗》的相关内容。众所周知,感染、免疫与炎症关系密切,感染的发生源于局部或全身免疫状况的改变。我将从三方面为大家介绍:成人呼吸道感染的现状;成人呼吸道感染易感人群及其免疫应答特点;免疫调节剂是否成为治疗呼吸道感染的新方法。
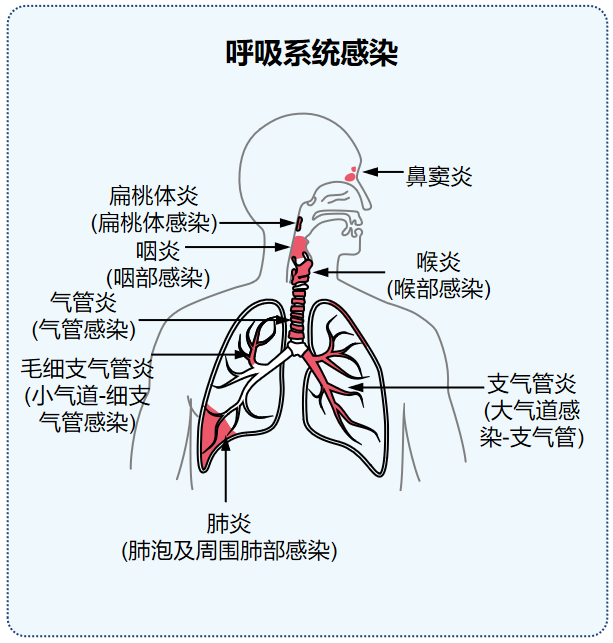
成人呼吸道感染在临床是一种常见且多发的疾病,以上呼吸道感染为例,成人每人年均发病次数为2-4次,堪称全球发病率最高的疾病,没有其他任何疾病能在发病次数上与之相提并论。
呼吸系统感染(RTI)是由细菌、病毒、支原体、真菌和寄生虫等多种微生物引发的感染性疾病。在这些微生物中,部分在人体上呼吸道定植,另一部分则未定植于上呼吸道而是来源于外界。我们通常所指的感染,是指病原体从原本的位置移位至上呼吸道或下呼吸道,或者是局部的病原体出现增生性的变化,并释放毒素,引起局部(如上皮细胞)的炎症反应。炎症反应可有局部的,也可全身引起患者的症状,出现发热、咳嗽、咳痰等上呼吸道症状。因此呼吸道感染是病原体与宿主之间的交互作用的结果。
成人呼吸道感染根据解剖部位的不同分为上呼吸道感染和下呼吸道感染。上呼吸道感染是指涉及气管(声门)以上部分,包括鼻炎、咽炎、鼻窦炎、喉炎和扁桃体炎;下呼吸道感染则指声门以下部分,包括气管、支气管、细支气管和肺组织的炎症,如支气管炎和肺炎等。在临床诊断过程中,仅区分上呼吸道感染和下呼吸道感染是不够的,还需进行精确定位。例如,社区活动性肺炎为主要肺实质疾病,咽炎、扁桃体炎等虽均属上呼吸道感染,但在具体影响解剖部位方面,仍需进一步区分。
呼吸道感染发病率高,是全球第三大最常见的死亡原因……呼吸道感染同样也是呼吸疾病住院患者的主要病因
呼吸道感染发病率高,包括WHO将呼吸道感染作为全球第三大最常见死亡原因。在美国,每年约发生5亿次上呼吸道感染;全球每年约25万至50万人因流感导致死亡;2015年,全球下呼吸道感染约发生2.918亿次;2015年,全球下呼吸道感染导致约274万人死亡,其中70岁以上老年人约127万人。可见,在新冠病毒暴发之前,人们每年秋冬季节均需面对诸如H1N1、H7N9等流感病毒的威胁。因此,尽管新冠病毒给全球带来了巨大冲击,但不可忽视的是,秋冬季节的主要感染因素依然是流感病毒。总体而言,呼吸道感染性疾病的发生频率及其所致后果均表明,该类疾病是全球人类生命健康的重要威胁。深入认识其类型、实施恰当的诊断以及积极的治疗,对于改善整体呼吸健康和促进人类福祉具有重大意义。

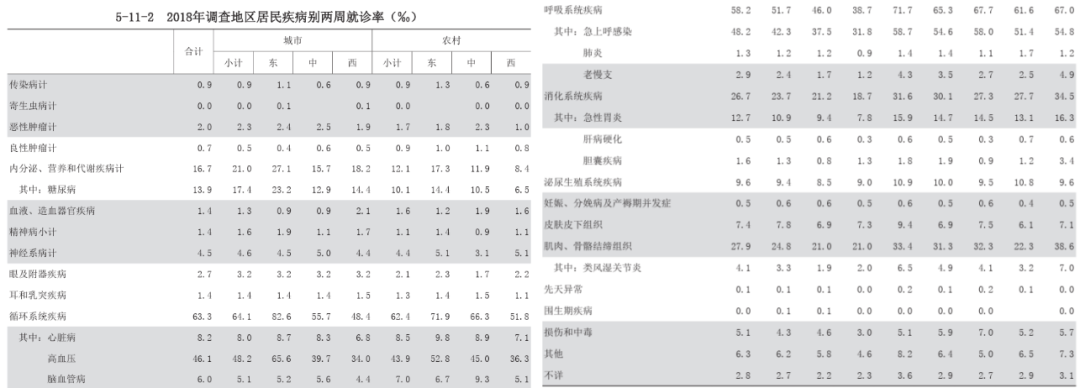
在我国,急性上呼吸道感染就诊率最高。根据2021年我国居民疾病别两周就诊率流行病学数据,当时正值疫情防控期,民众普遍佩戴口罩。在此背景下,急性上呼吸道感染、高血压及其他疾病的就诊率均有体现。值得注意的是,三年来的戴口罩习惯,急性上呼吸道感染、慢性阻塞性肺病急性加重及哮喘发作的发病率已明显降低,但急性上呼吸道感染仍居就诊率首位。此外,根据2018年调查地区居民疾病别住院率数据,急性上呼吸道感染仍是导致居民住院的主要呼吸疾病。
急性上呼吸道感染可引发多种并发症,如慢阻肺病急性加重、支扩、哮喘急性发作、心衰等,其在各类疾病中位列首位。尽管呼吸道感染并非重大疾病,但影响范围广泛,发病率极高,几乎每位公民每年都会遭遇。就影响后果而言,一般人群尚可承受,但部分儿童、老年人以及患有基础疾病的患者,可能会因此诱发其他基础疾病的急性发作,故而其潜在后果相对严重。
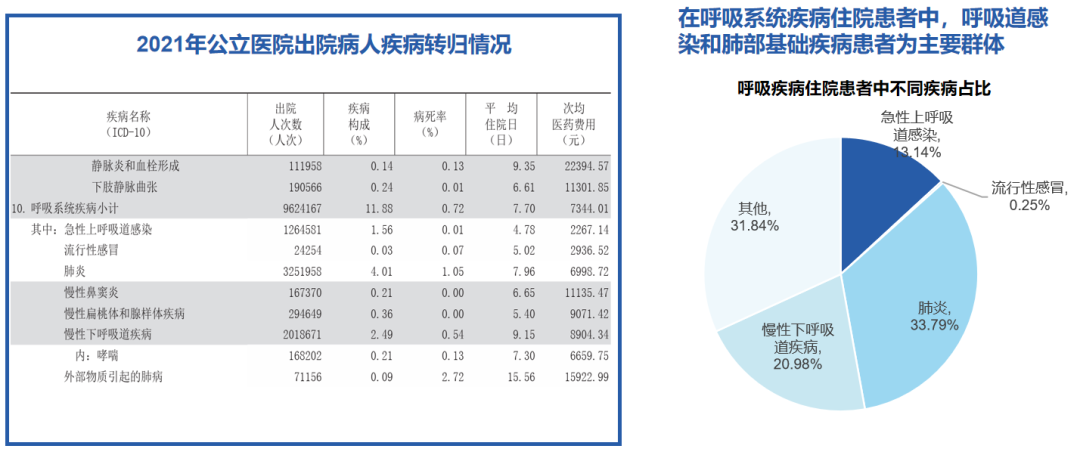
根据2021年公立医院出院病人疾病转归情况,呼吸道感染成为呼吸疾病住院患者的主要病因。在统计数据中,肺炎、慢性下呼吸道疾病以及急性上呼吸道感染等疾病占比已接近一半,同时还包括其他慢性下呼吸道疾病等。综合分析表明,在呼吸系统疾病患者中,呼吸道感染与肺部感染的占比显著较高。
“一老一小”是住院呼吸疾病患者的主要群体,儿童以急性上呼吸道感染和肺炎为主,老年人以肺炎和慢性下呼吸道疾病为主
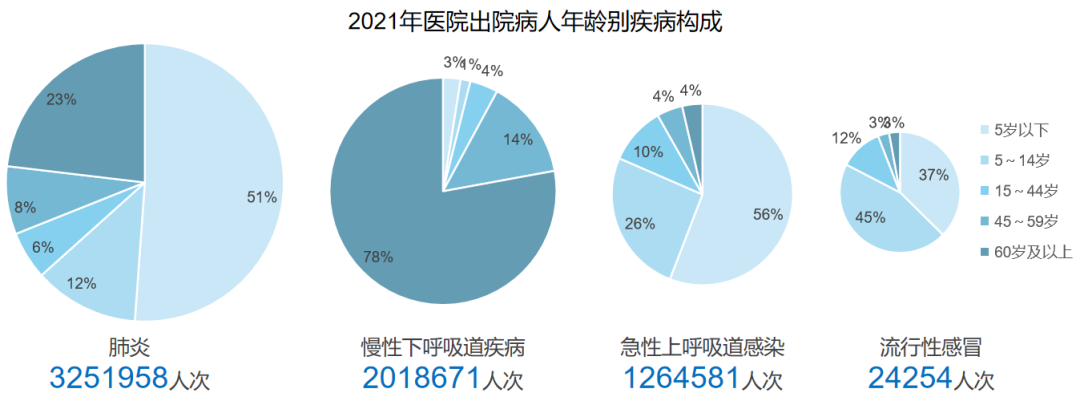
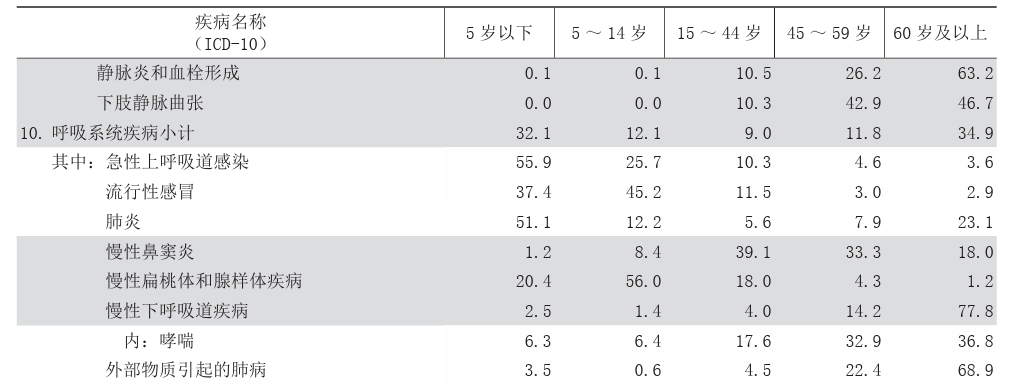
关于老年人群与儿童群体,呼吸道疾病发病率较高。根据2021年医院出院病人病种分布,肺炎患者达300多万人次,慢性下呼吸道疾病患者超过200万人次,急性上呼吸道感染患者约100万人次,流感患者近2万人次。然而,至2022年12月,相关数据相较2021年呈倍数增长,原因在于呼吸道感染性疾病及住院人数的增加。在此背景下,老年人和儿童成为呼吸系统疾病住院的主要群体。儿童易于感染的原因在于其免疫系统尚未完全发育,6个月后,母亲提供的抗体逐渐减少,从而容易患上上呼吸道感染和肺部感染;而老年人则因免疫功能缺陷,随着年龄增长,胸腺逐渐衰退,呼吸系统防御功能降低。因此,老年人和儿童是目前我国呼吸系统疾病住院的主要人群。
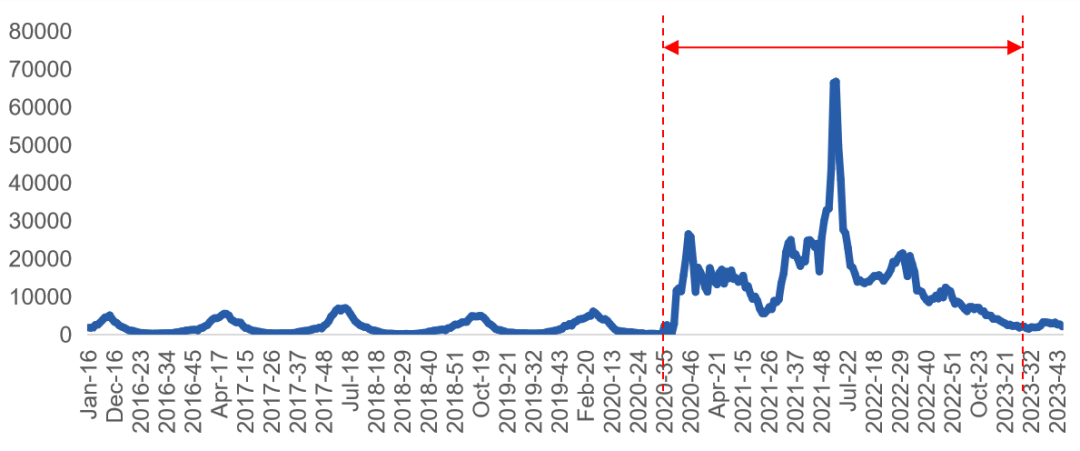
这是美国CDC监测的数据:2020年末-2023年初(2020/35周-2023/26周),美国出现了流感大暴发,流感持续高水平流行长达两年多。
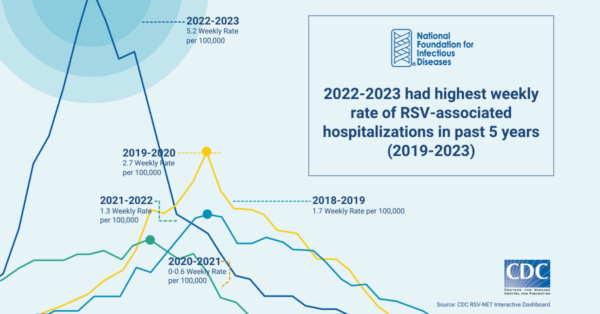
新冠疫情后,RSV的流行趋势被打破,全球多个国家发生反常季节的大暴发。美国CDC报告:新冠疫情管控措施取消后,2022-2023年RSV相关住院率在过去低流行的夏季达到过去5年以来的最高峰。
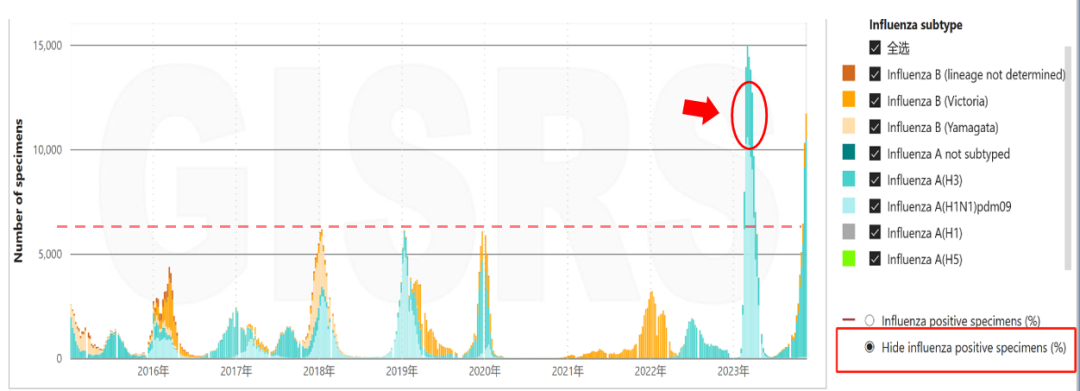
这是WHO公布的中国2015至今流感病例数量变化,从数据上看,2023年以来我国流感病毒呈现出异常高水平流行。

我国研究显示,2021年新冠疫情期间的RSV流行一反过去冬春季高发的惯例,出现了夏季和秋季高发的反季节流行现象。
这说明在当前形势下,多种呼吸道病原体呈现异常高水平流行,呼吸道感染防控形势更为严峻。相较于以往,当前的呼吸道病原体感染状况有所不同,这一点给大家留下了深刻印象。过去几年,得益于疫情防控政策的实施,如佩戴口罩等措施,各类呼吸道疾病的发生率显著降低。然而,近期口罩佩戴减少,尤其在过去的几个月内,不仅流感病例有所上升,支原体肺炎和呼吸道合胞病毒(RSV)感染也明显增加。这种现象较为容易理解,因为长期佩戴口罩使人们减少了与这些病原体的接触,从而对这些病原体产生了一定程度的易感性。以往每年冬季,流感总会发生,尽管病种、持续时间和患病人数有所不同,但流感流行的事实不容忽视。然而,在口罩佩戴减少的三年里,人们并未接触到这些病原体,如今一旦接触,感染反弹在所难免,且这一反弹现象与季节性因素不再完全吻合。
反季流行、报复性病例增加以及混合性感染情况的出现,是目前呼吸道感染疾病的一些显著特征……
在我国南方如上海等地,过去夏季流感病例较少,广州等地区夏季流感病例也较为罕见,这一现象与全球疫情防控措施及呼吸道病原体接触减少、封闭环境有一定关系。因此,在新冠疫情之后,如RSV感染等疾病,突破了以往的流行趋势,出现了“反季节暴发”等现象。同样,夏季流感的流行也成为了近几年呼吸道感染性疾病的特点。这些特点包括:反季流行、报复性病例增加以及混合性感染情况的出现。这是目前呼吸道感染疾病的一些显著特征。
呼吸道感染带来了沉重的社会经济负担:第一方面,上呼吸道感染是就医、病假的主要原因,美国每发生一次上呼吸道感染损失5.9小时的工作时间/周;第二方面,在发达国家,急性呼吸道感染占所有医疗咨询的20%,占所有抗生素处方的75%;第三方面,美国每年上呼吸道感染造成400亿的经济负担。我国下呼吸道感染患每人平均住院时间增加8天,住院费用增加2853.93美元。
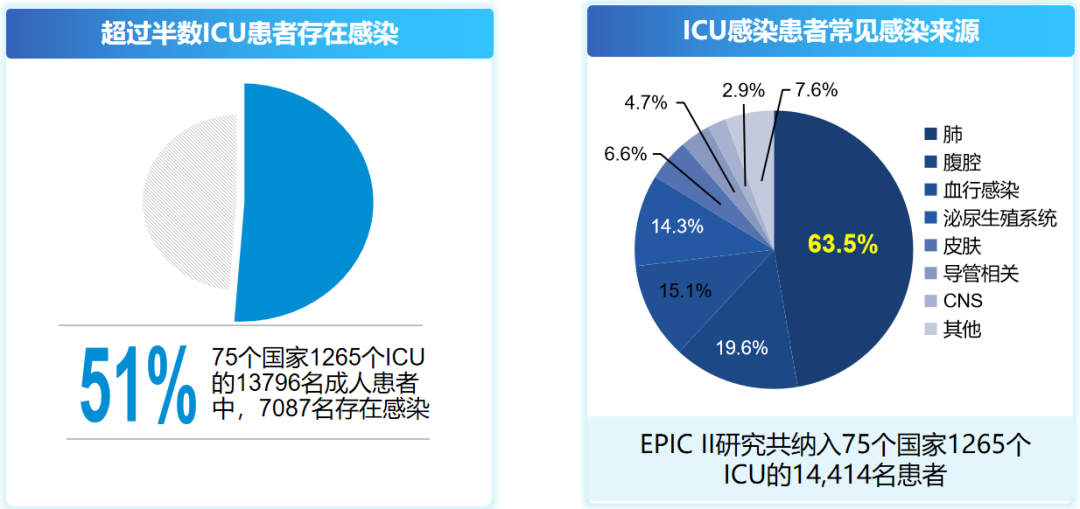
呼吸系统感染重症患者的救治是临床面临的艰巨挑战。ICU常见的感染部位包括呼吸道、泌尿道、血管内导管相关性感染、切口感染及烧伤创面感染等。其中,呼吸系统感染又是ICU感染患者最主要的来源。
呼吸道感染病患的症状、持续时间及严重程度因感染类型而异。多数呼吸道感染与病毒有关,特别是秋冬季节的感染,如病毒、合胞病毒、冠状病毒、腺病毒和流感病毒等。当然还有新冠病毒,各类病毒与细菌感染均与之交织在一起。
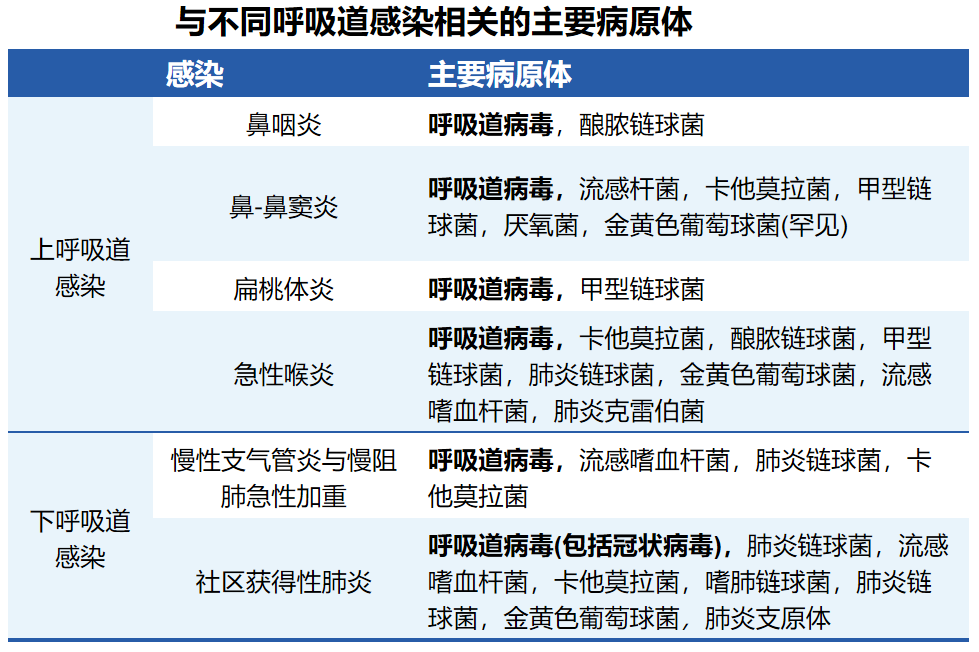
一些细菌种类(如金黄色葡萄球菌和肺炎链球菌) 是造成细菌重叠感染的原因,在急性病毒感染后很常见。不同类型的呼吸道感染病原体存在差异,≥80%的呼吸道感染由病毒引起,最常见的呼吸道病毒包括鼻病毒(HRV)、呼吸道合胞病毒(RSV)、冠状病毒、腺病毒和流感病毒。
非典型病原体感染较为普遍,我们应更加关注各类上呼吸道与下呼吸道感染以及不同部位的病原体差异。感染所涉及的病原体可能并非均为流行病学数据中的主要类型,因此,我们仍需关注患者的具体临床表现。
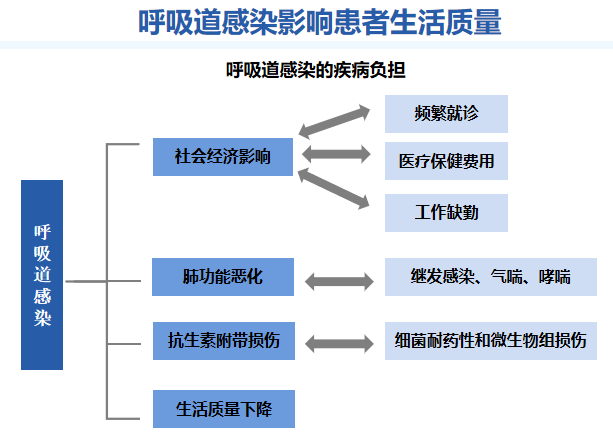
细菌感染与病毒感染的临床症状存在差异,呼吸道感染会对患者的生活品质产生负面影响,同时加重其经济负担。由于患者需请假就医,导致工作受阻,从而必然产生一定程度的社会经济影响。
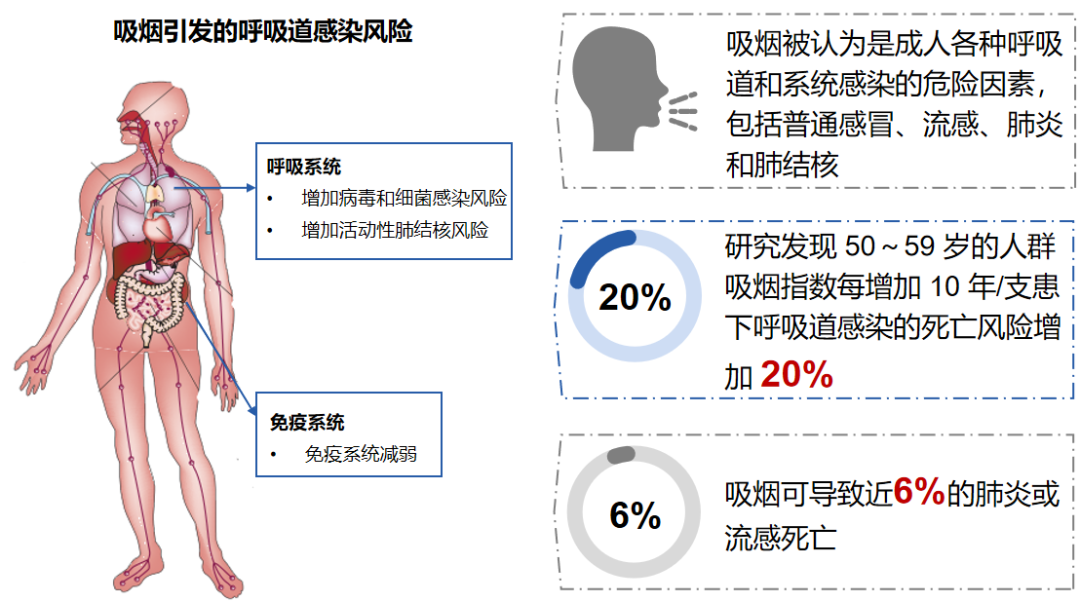
成人呼吸道感染易感/高危人群及其免疫应答特点:衰老造成固有和适应性免疫反应力不断下降……吸烟导致肺部免疫系统受损

上呼吸道感染在呼吸系统中是极为常见的病症,总体来看,它可被视为一种自限性疾病。然而,该疾病对社会、经济以及人体健康产生的影响却不容忽视。在成人呼吸道感染的高危人群中,老年人、长期吸烟者、患有基础疾病及慢性疾病的人群均存在不同程度的免疫异常。
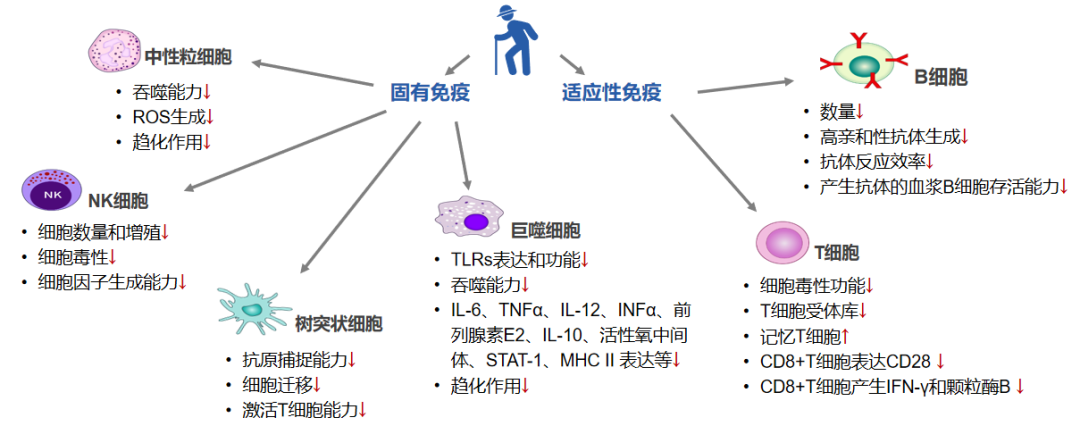
随着年龄的增长,人体内固有和适应性免疫细胞的数量和功能发生持续性变化,导致免疫力逐渐减弱。例如,当人们进入四十岁时,胸腺已基本不可见,其体积逐渐缩小。此外,老年人群中整体免疫细胞数量亦呈下降趋势。随着衰老过程的推进,包括中性粒细胞、NK细胞、树突状细胞、巨噬细胞、B细胞、T细胞等免疫细胞的功能均会因衰老而受到影响。
老年人呼吸道感染风险为何较高?在H7N9禽流感疫情暴发期间,我们关注到上海市出现了33例老年H7N9禽流感病例。老年人易感是因为他们较易接触到家禽市场吗?事实上,我们对这一问题进行了深入分析,发现老年人群体在基因表达及炎症因子释放方面存在异常增加,这是导致他们易感的原因。呼吸道感染相关的严重程度和发病率随着年龄的增长而增加,每年因流感死亡的90%以上发生在65岁以上的人群中,流感和肺炎是老年人的第五大死因;2014年,流感和肺炎占美国65岁或以上成年人死亡人数的2.3%,75岁以上的老年人在所有年龄组中与流感相关的死亡率最高;在65岁以上的老年患者中,呼吸道合胞病毒感染占肺炎住院的10.6%,慢阻肺住院的11.4%,充血性心力衰竭的5.4%,哮喘的7.2%。
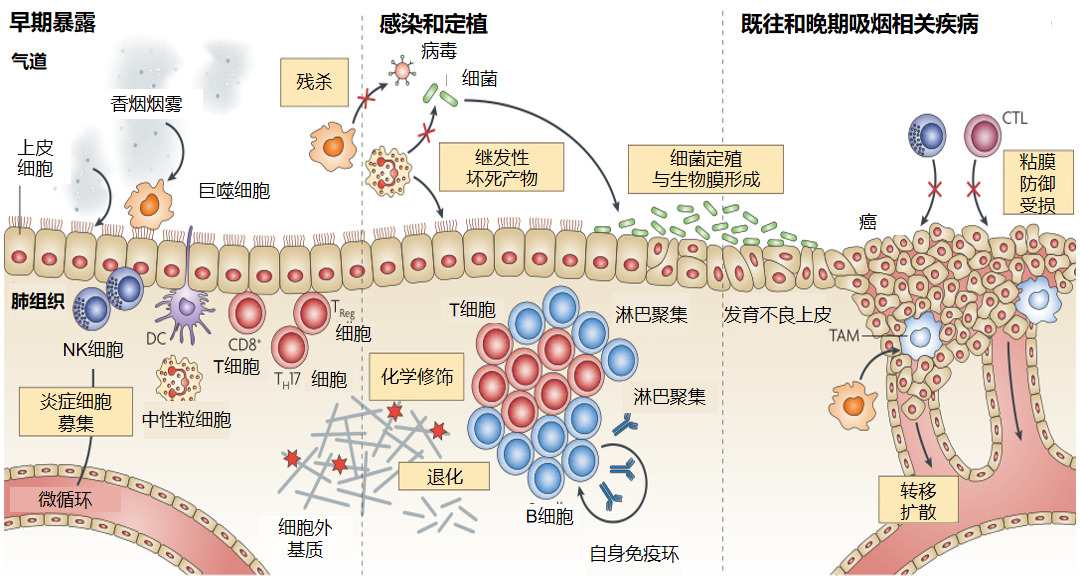
吸烟也会导致肺部免疫系统受损。香烟烟雾会对巨噬细胞、上皮细胞、树突状细胞(DC)以及自然杀伤细胞(NK)等先天防御机制产生损害,从而增加感染的风险、严重程度及持续时间。长期暴露于香烟烟雾中,肺部T细胞和B细胞区的淋巴聚集体会出现增加,进而产生致病性自身抗体。香烟烟雾不仅具有促炎作用,同时还具有免疫抑制作用,它对固有免疫机制产生损害,进一步增加感染的风险、严重程度和持续时间。此外,香烟烟雾还可导致致病性自身抗体的产生。
例如,针对患有上呼吸道感染的患者,大多数病例具有自限性,一周左右即可痊愈。然而,若患者同时存在吸烟习惯,吸烟本身将损害上呼吸道的上皮细胞,从而导致症状持续时间较长,上呼吸道的屏障功能短期内无法完全修复。因此,这两者相互影响,可能引发病情反复、迁延不愈等现象。迄今为止,我们都尚未发现吸烟能对人体产生任何有益的积极作用,唯有种种危害。因此,在各类呼吸道感染患者中,无论其疾病性质为急性或慢性、肿瘤或非肿瘤,若患者本身存在吸烟行为,我们均应积极劝阻并促使他们尽快采取戒烟措施。
分析一下香烟烟雾的主要成分对免疫系统的影响。它的主要成分尼古丁、烃类、一氧化碳、氧化剂和活性炭、NKK、丙烯醛(注:NKK:亚硝胺4-(甲基亚硝胺)-1-(3-吡啶基)-1-丁酮;NK:自然杀伤;TH2:辅助型T细胞2)。
尼古丁的靶细胞是内皮细胞、上皮细胞、淋巴细胞、巨噬细胞和中枢神经系统细胞,它产生的影响是使巨噬细胞偏向TH2型免疫反应,效应器功能降低;
烃类成分的靶细胞是内皮细胞、上皮细胞、淋巴细胞和巨噬细胞,它产生的主要影响是碱性环-螺旋-环蛋白介导的基因调控和代谢和生物转化酶的适应性增加;
一氧化碳的靶细胞是上皮细胞、淋巴细胞和巨噬细胞,它的影响是抑制效应器功能,增殖减少;
氧化剂和活性炭的靶细胞是上皮细胞、淋巴细胞、巨噬细胞、NK细胞和微血管内皮细胞,影响是DNA损伤,细胞衰老,脂质过氧化,基质修饰,细胞内信号成分的化学修饰,亚硝化和羰化;
NKK的靶细胞是细胞毒T细胞、NK细胞和NKT细胞,能使得细胞死亡效应器功能降低,增殖减少。
支气管扩张症患者急性加重期均合并呼吸道感染……支气管扩张症急性加重患者存在呼吸道感染

支气管扩张症患者的免疫也会因呼吸道感染而存在受损。支气管扩张患者存在慢性化脓性炎症,这导致其中性粒细胞吞噬能力下降,因为呼吸道微环境呈酸性。同时,炎症细胞释放炎症的能力浓度增加,产生促炎作用,进而造成组织损伤。因此,一方面炎症反应加剧,另一方面免疫功能减弱,包括巨噬细胞和中性粒细胞的吞噬功能降低,从而引发呼吸道反复化脓性感染。
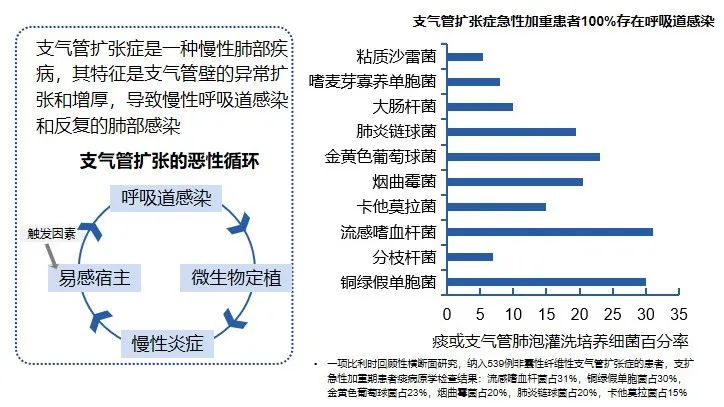
支气管扩张症患者往往面临反复急性加重的困境,这是众所周知的问题。这类患者在病毒和细菌清除方面能力较差,继发感染后易引发严重反应,损害呼吸道上皮功能,进而加重呼吸道感染。医学界应寻求方法破解这一恶性循环,阻止免疫功能持续呈“螺旋性下降”。
人体下呼吸道并非无菌,若支扩患者未能有效控制呼吸道感染,肺功能恶化感染将逐步加剧,反复发作最终导致严重并发症,甚至危及生命。因此,针对支扩患者,需充分认识呼吸道感染所导致的免疫功能整体失衡,免疫防御功能遭受严重损害。大部分支扩患者痰液中均存在不同程度的病原体定植,如肺炎链球菌、金葡菌、卡他莫拉菌等,因此在“痰培养”或二代测序中,可检测到大量病原微生物定植。
呼吸道感染的慢阻肺患者存在多种炎性细胞参与的慢性炎症性病变,同时又存在免疫功能紊乱,慢性炎症与免疫机制相互交织,相互促进
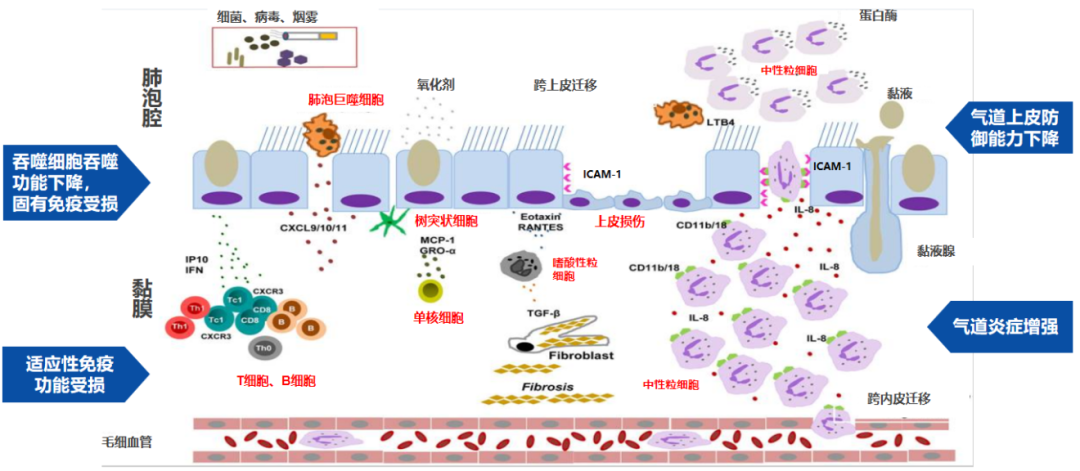
呼吸道感染的慢阻肺患者也存在免疫功能受损和肺部炎症增强。如导致吞噬细胞吞噬功能下降,固有免疫受损;气道上皮防御能力下降;适应性免疫功能受损;气道炎症增强。

肺泡腔及黏膜免疫功能受损现象普遍,既包括固有免疫受损,也涉及屏障功能减弱。因此,肺泡上皮细胞及呼吸道上皮细胞的完整性和屏障功能均受到不同程度的损害。呼吸道上皮细胞的柱状上皮细胞部分消失,转变为菱形上皮化生,类似皮肤。这种变化导致呼吸道上皮细胞功能减退,进而引发免疫功能受损、炎症加剧等问题。巨噬细胞数量及功能也发生复杂变化,肺泡灌洗时可见巨噬细胞数量增加。原因在于局部炎症反应、微环境酸化、病原微生物死亡导致的黏蛋白交织、炎症细胞死亡释放的炎症因子等。
慢性炎症反应导致组织上皮损伤,气道重塑,同时细胞死亡后释放的碳氢蛋白酶、胰蛋白酶等进一步损伤组织器官。因此,慢阻肺患者易于发生呼吸道感染,原因在于屏障功能受损、区域性免疫功能下降,以及固有免疫、适应性免疫、细胞免疫等受损。长期慢性炎症反应导致肺功能逐渐恶化。
这就是为什么呼吸道感染的慢阻肺患者存在多种炎性细胞参与的慢性炎症性病变,同时又存在免疫功能紊乱,慢性炎症与免疫机制相互交织,相互促进。
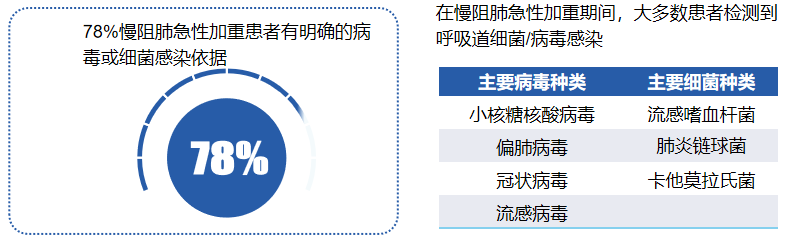
同时,慢阻肺患者也易发生呼吸道感染:GOLD 2021指出慢阻肺(COPD)目前仍是全球三大死因之一;慢性气道细菌感染通常发生在COPD患者中;呼吸道感染的存在增加了COPD的经济负担,导致临床结局恶化,增加死亡率;COPD患者的呼吸道持续感染导致慢性气道炎症,增加症状并加速肺功能的进行性丧失。
哮喘患者的免疫受损……受感染的上皮细胞和常驻免疫细胞对病毒病原体的识别引发先天免疫反应,然后再引发获得性免疫反应
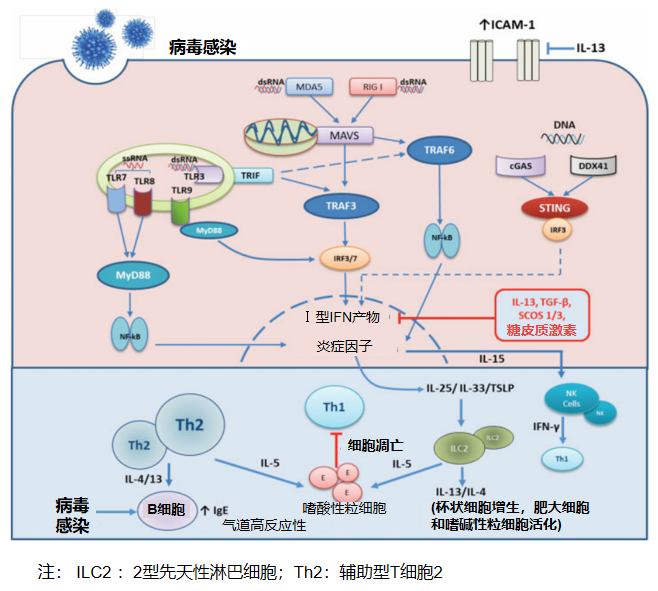
哮喘患者免疫功能受损的情况较为常见,其病原体主要包括呼吸道合胞病毒等。在感染过程中,这些受感染的上皮细胞和常驻免疫细胞会对病毒病原体的识别引发先天免疫反应,然后再引发获得性免疫反应。ILC2和Th2细胞增加;树突状细胞等天然免疫细胞对病毒感染的激活受损;粘附分子-1的表达增加,导致病毒复制增加。
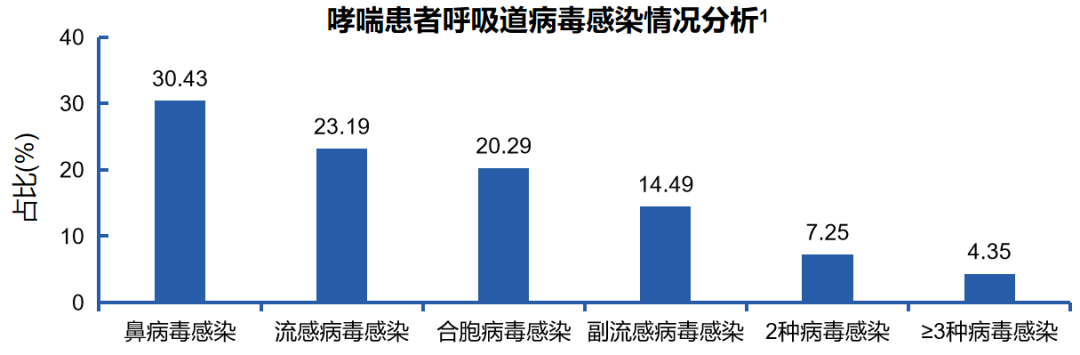
哮喘急性发作与呼吸道病毒感染密切相关。一项研究纳入了146例哮喘患者,根据是否合并呼吸道病毒感染将患者分为感染组69例和对照组77 例,旨在研究呼吸道病毒感染对支气管哮喘患者细胞免疫功能及病情的影响观察。
支气管哮喘是呼吸道黏膜变应性炎症引起的变态反应性疾病,Th2 细胞及其分泌的细胞因子在其中发挥着重要作用。固有免疫和适应性免疫相互作用,共同促进了疾病的发生和进展。约50%-80%患者哮喘急性发作与呼吸道病毒感染紧密相关。(注:Th2指辅助型T细胞2)
还有一些恶性肿瘤患者也易发生呼吸道感染。恶性肿瘤化疗患者是医院感染的高危人群,显著增加其治疗难度和病死率。根据我国的一项回顾性研究,纳入481例恶性肿瘤接受化疗的患者,其中26.61%发生医院感染,感染部位以呼吸道感染为主,占62.5%。以肺癌为例:肺癌患者的免疫受损。
1.遗传易感性。α1-抗胰蛋白酶缺乏,引起组织损伤;
2.免疫应答异常。免疫失调引起肺组织破坏,降低对肺癌细胞的清除能力;
3.慢性炎症反应。反复引起气道和肺部组织的损伤修复;
4.氧化应激。氧化-抗氧化系统失衡,引起炎症和DNA损伤修复。
导致肺癌患者出现呼吸道感染的两大因素:1.肺癌本身。肺癌本身可导致患者免疫力下降,患者易发感染;肺癌导致患者肺功能受限,增加呼吸道感染风险。2.肺癌的治疗。肺癌患者接受手术、放疗或化疗造成创伤、肺组织损伤、肺功能损害、粒细胞缺乏等,增加呼吸道感染风险。

小结:易感/高危人群普遍存在免疫降低,增加对病原体的易感性。
免疫调节剂显著降低慢支伴慢阻肺急性加重频率45%……免疫调节剂或可成为治疗呼吸道感染新方法
何谓免疫治疗?免疫治疗是通过调节机体的免疫功能,纠正免疫反应的异常,从而达到治病目的。正常情况下,人体在接触病原/抗原后数分钟内固有免疫应答就会被启动,并持续数天;而随后发生的适应性免疫应答可持续数周乃至数年。免疫治疗药物通过模仿机体对病原体的自然免疫反应,增强固有和适应性免疫反应,提升针对病原体感染的能力。
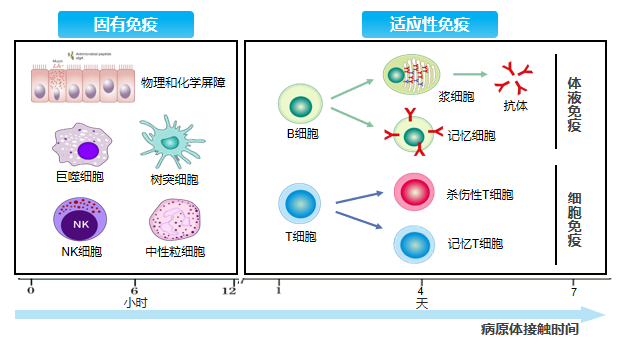
免疫系统包括固有免疫和适应性免疫。机体已发展出复杂的固有免疫和适应性免疫机制,能够识别并消除有害病原体,维持机体健康。

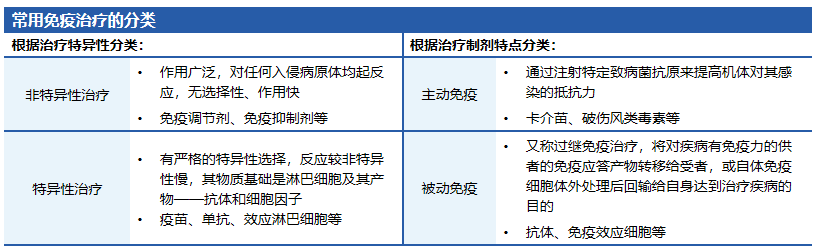
免疫调节剂可提供非特异性的免疫调节,意味着固有免疫和适应性免疫中免疫应答的更普遍变化,从而导致宿主对许多不同抗原的反应性发生改变。
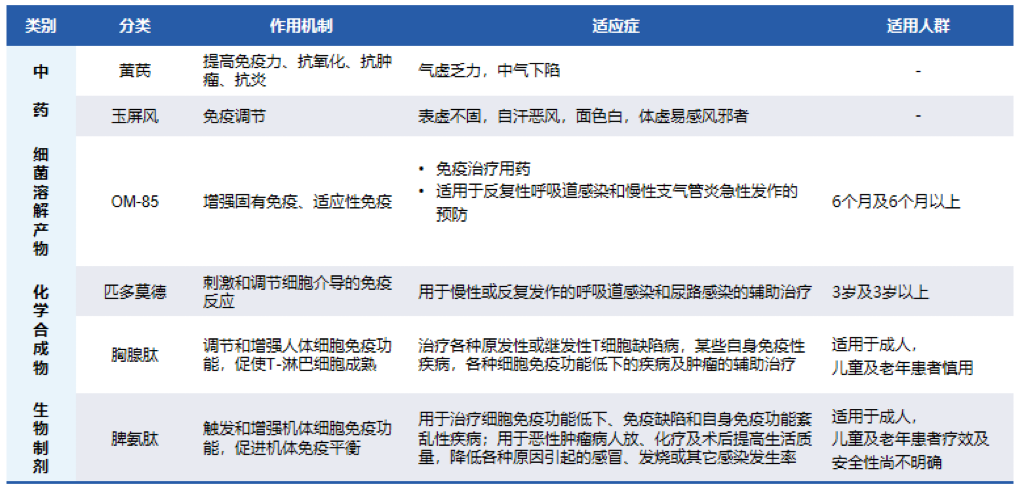
这是常见免疫调节剂的分类和作用机制。根据国内外指南和共识推荐:免疫调节剂可用于慢性气道疾病合并呼吸道感染的治疗和预防。
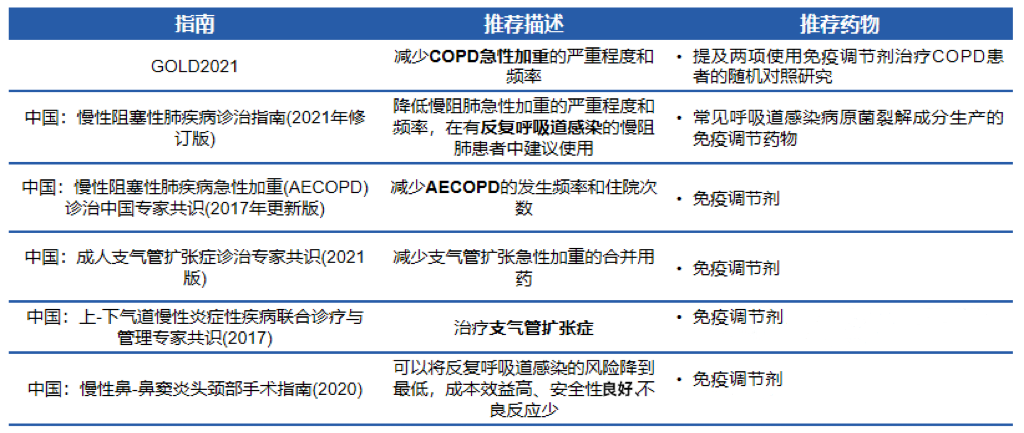
免疫调节剂应用于反复呼吸道感染的临床获益:1.预防呼吸道感染,降低呼吸道疾病急性发作风险;2.降低急性发作的严重程度,提高日常生活质量;3.减少抗生素的使用。
总结
1、呼吸道感染是呼吸科临床常见的一种多发疾病,影响患者生活质量,为患者带来沉重的社会经济负担;
2、老年,吸烟,支气管扩张症,慢阻肺/慢性支气管炎,哮喘,肿瘤等是成人呼吸道感染的危险因素;
3、免疫调节剂可用于减少慢阻肺和支气管扩张症的急性加重。
参考文献
1. 中国研究型医院学会呼吸病学专业委员会,等.中华结核和呼吸杂志.2020,43(09)
2. Grief SN. Prim Care. 2013 Sep;40(3):757-70.
3. Liu Y, et al. Front Pharmacol. 2019 Oct 31;10:1237.
4. https://patient.info/news-and-features/the-respiratory-system[Accessed February 2020]
5. Egilmezer E, et al. Rev Med Virol. 2018 Sep;28(5):e1995.
6. Rees JR, et al. Clin Infect Dis. 2013 Nov;57(10):1384-92.
7. GBD 2015 LRI Collaborators. Lancet Infect Dis. 2017 Nov;17(11):1133-1161.
8. 中国卫生统计年鉴2022
9. Global Influenza Programme (who.int)
10. Qiu W, Zheng C, Huang S, et al. Epidemiological Trend of RSV Infection Before and During COVID-19 Pandemic: A Three-Year Consecutive Study in China[J]. Infection and drug resistance, 2022, 15: 6829-6837. doi:10.2147/idr.S388231.
11. Somerville VS, et al. Adv Nutr. 2016 May 16;7(3):488-97.
12. Shann F et al. Clin Infect Dis 1999;28:189–91;
13. Yan T, et al. J Infect Public Health. 2018 Jul-Aug;11(4):507-513.
14. 何忠杰, 刘双庆. 重症医学感染的管理[J]. 中华普通外科学文献(电子版), 2011, 05(4): 1-3.
15. Vincent J-L, et al. JAMA, 2009, 302(21): 2323-2329.
16. Weiss SL, et al. American journal of respiratory and critical care medicine, 2015, 191(10): 1147-1157.
17. Schaad UB, Principi N. Eur Infect Dis 2012;6:111–5;
18. Esposito S et al. Eur J Clin Microbiol Infect Dis 2012;31:1637–45;
19. Hament JM et al. FEMS Immunol Med Microbiol 1999;26:189–95;
20. Anjos LM et al. Rev Soc Bras Med Trop 2014;47:409–13;
21. Scheid D, Hamm RM. Am Fam Physician 2004;70:1685–92;
22. Wood JM et al. BMJ 2014;349:g5827;
23. Brunton S et al. Am J Manag Care 2004;10:689–96;
24. Brown JS. Clin Med 2012;12:538-43.
25. Teasdale E, et al. BMC Public Health. 2014 Jun 11;14:589.
26. Mejza F et al. Eur Respir J 2017;50:1700621;
27. Dethlefsen L et al. PLoS Biol 2008;6:e280;
28. Linehan E, et al. Eur J Microbiol Immunol (Bp). 2015 Mar;5(1):14-24
29. Stämpfli MR, et al. Nat Rev Immunol. 2009 May;9(5):377-84.
30. Lommatzsch ST. Ther Adv Respir Dis. 2020 Jan-Dec;14:1753466620905272.
31. Perea L, et al. Respir Res. 2020 Jan 13;21(1):21
32. 邹永祎. 中国医学工程, 2020, v.28(11):86-88.
33. Ishigami J, et al. Clin Exp Nephrol. 2019 Apr;23(4):437-447
34. Egede LE, et al. Diabetes in America . 3rd ed. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases (US); 2018 Aug. CHAPTER 30.
35. 杨晓蕾,等. 中华医院感染学杂志, 2014, 000(024):6127-6128
36. Bulut O, Kilic G, Domínguez-Andrés J, et al. Overcoming immune dysfunction in the elderly: trained immunity as a novel approach[J]. International Immunology, 2020.
37. Bahadoran A, Lee S H, Wang S M, et al. Immune responses to influenza virus and its correlation to age and inherited factors[J]. Frontiers in Microbiology, 2016, 7: 1841.
38. Wardhana, et al. Acta Med Indones. 2011 Jul;43(3):185-90.
39. Kodama F, et al. Infect Dis Clin North Am.2017 Dec;31(4):767-790.
40. Falsey AR. Exp Lung Res. 2005 Sep;31 Suppl 1:77.
41. Garmendia J,et al.Eur Respir J.2012 Feb;39(2):467-77.
42. 戴晓,等. 实用预防医学.2021,28(01)
43. Huttunen R,et al.J Intern Med. 2011 Mar;269(3):258-69.
44. Daheshia M, et al. Pulm Med. 2012;2012:280528.
45. King PT. Biomed Res Int. 2018 Mar 18;20186802637.
46. 程克斌, 等. 国际呼吸杂志, 2019, 39(6):457-461.
47. Goeminne PC, et al. Respir Res. 2012 Mar 16;13(1):21.
48. Guo-Parke H, Linden D, Weldon S, et al. Mechanisms of Virus-Induced Airway Immunity Dysfunction in the Pathogenesis of COPD Disease, Progression, and Exacerbation[J]. Frontiers in Immunology, 2020, 11.
49. Rovina N, Koutsoukou A, Koulouris N G. Inflammation and Immune Response in COPD: Where Do We Stand?[J]. Mediators of Inflammation, 2013, 2013: 413735.
50. 韦佳, 付秀华. 慢性炎症及免疫机制在慢阻肺发生发展中的作用[J]. 世界最新医学信息文摘, 2018, v.18(16):96-97.
51. Nurwidya F, Damayanti T, Yunus F. The role of innate and adaptive immune cells in the immunopathogenesis of chronic obstructive pulmonary disease[J]. Tuberculosis and respiratory diseases, 2016, 79(1): 5-13.
52. Caramori G, Casolari P, Barczyk A, et al. COPD immunopathology[J]. Seminars in immunopathology, 2016, 38(4): 497-515.
53. Rovina N, Koutsoukou A, Koulouris N G. Inflammation and Immune Response in COPD: Where Do We Stand?[J]. Mediators of Inflammation, 2013, 2013: 413735.
54. Ahearn CP, et al. Pathog Dis. 2017 Jun 1;75(4):ftx042.
55. 慢性阻塞性肺疾病急性加重 (AECOPD) 诊治中国专家共识
56. Kherad O, et al. Chest. 2010 Oct;138(4):896-904
57. Papi A, et al. Proc Am Thorac Soc. 2006 May;3(3):245-51.
58. GOLD 2021
59. Wark PAB, et al. Semin Respir Crit Care Med. 2018 Feb;39(1):45-55.
60. 陈勃江,等. 中华结核和呼吸杂志. 2014; 37(4): 290-293.
61. Houghton AM, et al. Nat Rev Cancer. 2013 Apr;13(4)233-45.
62. Spiro SG et al. Semin Respir Crit Care Med 2008;29:302–318
63. Goulding J, et al. Proc Am Thorac Soc, 2007,4(8):618-25.
64. Lloyd C M, et al. Immunity, 2017,46(4):549-561.
65. 伦玉宁, 等. 中国医院协会;卫计委药事管理研究所, 2014.
66. Didierlaurent AM, et al. Expert Rev Vaccines. 2017 Jan;16(1):55-63.
67. 何维. 《医学免疫学》.人民卫生出版社.2010年第2版.
68. 曹雪涛主编.医学免疫学(第9版).北京人民卫生出版社,2017.
69. Dhama K, Saminathan M, Jacob S S, et al. Effect of immunomodulation and immunomodulatory agents on health with some bioactive principles, modes of action and potent biomedical applications[J]. International Journal of Pharmacology, 2015, 11(4): 253-290.
70. Schaad US, et al. Arch Pediatr Infect Dis. 2016 January;4(1):e31039.
71. 伦玉宁, 等. 中国医院协会;卫计委药事管理研究所, 2014.
72. 慢性阻塞性肺疾病诊治指南(2021年修订版)[J]. 中国结核和呼吸杂志, 2021,44(3): 170-204
73. 中国成人支气管扩张症诊断与治疗专家共识[J]. 中华结核和呼吸杂志, 2021, 44(04):311-321.
74. 上-下气道慢性炎症性疾病联合诊疗与管理专家共识[J]. 中华医学杂志, 2017, 97(26):2001-2022
75. Chinese Society of Allergy and Chinese Society of Otorhinolaryngology-Head and Neck Surgery Guideline for Chronic Rhinosinusitis. Allergy Asthma Immunol Res. 2020 Mar;12(2):176-237.
76. Chin Med J (Engl). 2004;117(6)_828-834.
77. 西部医学,2019,31(6):949-957
78. Eur Respir J. 1994 Mar;7(3):446-52.
79. Yan T, et al. J Infect Public Health. 2018 Jul-Aug;11(4):507-513.
80. 中国研究型医院学会呼吸病学专业委员会,等.中华结核和呼吸杂志.2020,43(09)
81. Grief SN. Prim Care. 2013 Sep;40(3):757-70.
82. Liu Y, et al. Front Pharmacol. 2019 Oct 31;10:1237.
83. https://patient.info/news-and-features/the-respiratory-system[Accessed February 2020]
84. Egilmezer E, et al. Rev Med Virol. 2018 Sep;28(5):e1995.
85. Rees JR, et al. Clin Infect Dis. 2013 Nov;57(10):1384-92.
86. GBD 2015 LRI Collaborators. Lancet Infect Dis. 2017 Nov;17(11):1133-1161.
87. 中国卫生统计年鉴2022
88. Global Influenza Programme (who.int)
89. Qiu W, Zheng C, Huang S, et al. Epidemiological Trend of RSV Infection Before and During COVID-19 Pandemic: A Three-Year Consecutive Study in China[J]. Infection and drug resistance, 2022, 15: 6829-6837. doi:10.2147/idr.S388231.
90. Somerville VS, et al. Adv Nutr. 2016 May 16;7(3):488-97.
91. Shann F et al. Clin Infect Dis 1999;28:189–91;
92. Yan T, et al. J Infect Public Health. 2018 Jul-Aug;11(4):507-513.
93. 何忠杰, 刘双庆. 重症医学感染的管理[J]. 中华普通外科学文献(电子版), 2011, 05(4): 1-3.
94. Vincent J-L, et al. JAMA, 2009, 302(21): 2323-2329.
95. Weiss SL, et al. American journal of respiratory and critical care medicine, 2015, 191(10): 1147-1157.
96. Schaad UB, Principi N. Eur Infect Dis 2012;6:111–5;
97. Esposito S et al. Eur J Clin Microbiol Infect Dis 2012;31:1637–45;
98. Hament JM et al. FEMS Immunol Med Microbiol 1999;26:189–95;
99. Anjos LM et al. Rev Soc Bras Med Trop 2014;47:409–13;
100. Scheid D, Hamm RM. Am Fam Physician 2004;70:1685–92;
101. Wood JM et al. BMJ 2014;349:g5827;
102. Brunton S et al. Am J Manag Care 2004;10:689–96;
103. Brown JS. Clin Med 2012;12:538-43.
104. Teasdale E, et al. BMC Public Health. 2014 Jun 11;14:589.
105. Mejza F et al. Eur Respir J 2017;50:1700621;
106. Dethlefsen L et al. PLoS Biol 2008;6:e280;
107. Linehan E,et al.Eur J Microbiol Immunol (Bp).2015 Mar;5(1):14-24
108. Stämpfli MR, et al. Nat Rev Immunol. 2009 May;9(5):377-84.
109. Lommatzsch ST. Ther Adv Respir Dis. 2020 Jan-Dec;14:1753466620905272.
110. Perea L, et al. Respir Res. 2020 Jan 13;21(1):21
111. 邹永祎. 中国医学工程, 2020, v.28(11):86-88.
112. Ishigami J, et al. Clin Exp Nephrol. 2019 Apr;23(4):437-447
113. Egede LE, et al. Diabetes in America . 3rd ed. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases (US); 2018 Aug. CHAPTER 30.
114. 杨晓蕾,等. 中华医院感染学杂志, 2014, 000(024):6127-6128
115. Bulut O, Kilic G, Domínguez-Andrés J, et al. Overcoming immune dysfunction in the elderly: trained immunity as a novel approach[J]. International Immunology, 2020.
116. Bahadoran A, Lee S H, Wang S M, et al. Immune responses to influenza virus and its correlation to age and inherited factors[J]. Frontiers in Microbiology, 2016, 7: 1841.
117. Wardhana, et al. Acta Med Indones. 2011 Jul;43(3):185-90.
118. Kodama F, et al. Infect Dis Clin North Am.2017 Dec;31(4):767-790.
119. Falsey AR. Exp Lung Res. 2005 Sep;31 Suppl 1:77.
120. Garmendia J,et al.Eur Respir J.2012 Feb;39(2):467-77.
121. 戴晓,等. 实用预防医学.2021,28(01)
122. Huttunen R,et al.J Intern Med. 2011 Mar;269(3):258-69.
123. Daheshia M, et al. Pulm Med. 2012;2012:280528.
124. King PT. Biomed Res Int. 2018 Mar 18;20186802637.
125. 程克斌, 等. 国际呼吸杂志, 2019, 39(6):457-461.
126. Goeminne PC, et al. Respir Res. 2012 Mar 16;13(1):21.
127. Guo-Parke H, Linden D, Weldon S, et al. Mechanisms of Virus-Induced Airway Immunity Dysfunction in the Pathogenesis of COPD Disease, Progression, and Exacerbation[J]. Frontiers in Immunology, 2020, 11.
128. Rovina N, Koutsoukou A, Koulouris N G. Inflammation and Immune Response in COPD: Where Do We Stand?[J]. Mediators of Inflammation, 2013, 2013: 413735.
129. 韦佳, 付秀华. 慢性炎症及免疫机制在慢阻肺发生发展中的作用[J]. 世界最新医学信息文摘, 2018, v.18(16):96-97.
130. Nurwidya F, Damayanti T, Yunus F. The role of innate and adaptive immune cells in the immunopathogenesis of chronic obstructive pulmonary disease[J]. Tuberculosis and respiratory diseases, 2016, 79(1): 5-13.
131. Caramori G, Casolari P, Barczyk A, et al. COPD immunopathology[J]. Seminars in immunopathology, 2016, 38(4): 497-515.
132. Rovina N, Koutsoukou A, Koulouris N G. Inflammation and Immune Response in COPD: Where Do We Stand?[J]. Mediators of Inflammation, 2013, 2013: 413735.
133. Ahearn CP, et al. Pathog Dis. 2017 Jun 1;75(4):ftx042.
134. 慢性阻塞性肺疾病急性加重 (AECOPD) 诊治中国专家共识
135. Kherad O, et al. Chest. 2010 Oct;138(4):896-904
136. Papi A, et al. Proc Am Thorac Soc. 2006 May;3(3):245-51.
137. GOLD 2021
138. Wark PAB, et al. Semin Respir Crit Care Med. 2018 Feb;39(1):45-55.
139. 陈勃江,等. 中华结核和呼吸杂志. 2014; 37(4): 290-293.
140. Houghton AM, et al. Nat Rev Cancer. 2013 Apr;13(4)233-45.
141. Spiro SG et al. Semin Respir Crit Care Med 2008;29:302–318
142. Goulding J, et al. Proc Am Thorac Soc, 2007,4(8):618-25.
143. Lloyd C M, et al. Immunity, 2017,46(4):549-561.
144. 伦玉宁, 等. 中国医院协会;卫计委药事管理研究所, 2014.
145. Didierlaurent AM, et al. Expert Rev Vaccines. 2017 Jan;16(1):55-63.
146. 何维. 《医学免疫学》.人民卫生出版社.2010年第2版.
147. 曹雪涛主编.医学免疫学(第9版).北京人民卫生出版社,2017.
148. Dhama K, Saminathan M, Jacob S S, et al. Effect of immunomodulation and immunomodulatory agents on health with some bioactive principles, modes of action and potent biomedical applications[J]. International Journal of Pharmacology, 2015, 11(4): 253-290.
149. Schaad US, et al. Arch Pediatr Infect Dis. 2016 January;4(1):e31039.
150. 伦玉宁, 等. 中国医院协会;卫计委药事管理研究所, 2014.
151. 慢性阻塞性肺疾病诊治指南(2021年修订版)[J]. 中国结核和呼吸杂志, 2021,44(3): 170-204
152. 中国成人支气管扩张症诊断与治疗专家共识[J]. 中华结核和呼吸杂志, 2021, 44(04):311-321.
153. 上-下气道慢性炎症性疾病联合诊疗与管理专家共识[J]. 中华医学杂志, 2017, 97(26):2001-2022
154. Chinese Society of Allergy and Chinese Society of Otorhinolaryngology-Head and Neck Surgery Guideline for Chronic Rhinosinusitis. Allergy Asthma Immunol Res. 2020 Mar;12(2):176-237.
155. Chin Med J (Engl). 2004;117(6)_828-834.
156. 西部医学,2019,31(6):949-957
157. Eur Respir J. 1994 Mar;7(3):446-52.
158. Yan T, et al. J Infect Public Health. 2018 Jul-Aug;11(4):507-513.
专家介绍

宋元林
复旦大学附属中山医院呼吸与危重医学科主任,博士生导师,上海市教委“东方学者”特聘教授,上海市肺部炎症与损伤重点实验室主任,上海市呼吸病研究所副所长,上海市优秀学术带头人,上海市领军人才;担任亚太呼吸病学会(APSR)感染学组组长,中华医学会呼吸病学分会常务委员,中国医师协会呼吸医师分会常务委员,上海市医学会呼吸病学专科分会候任主任委员,中国医师协会呼吸医师分会外事工作委员会主任委员,中国康复医学会呼吸康复专业委员会副主任委员;《Respirology》、《Clinical Respiratory Journal》副主编;主要研究领域为肺部感染与肺损伤的诊断和治疗;慢阻肺,支扩,哮喘等气道疾病的诊断和治疗,流感防治。主持国自然新冠专项,国自然面上项目(2项),科技部重点研发计划(牵头),科技部973子课题,上海市科委医学创新研究专项 、产学研医项目、医学重点项目、基础重点项目。发表SCI论文120余篇,申请到专利8项,转化3项,参与编写专著10余部,获上海市科技进步奖(二等奖)一项,上海市医学科技奖(二等奖)两项,中华医学奖(三等奖)一项,中国中医药研究促进会科学进步奖(一等奖)一项。
审批编号 CN-128931 有效期至:2024/4/20
* 本材料由阿斯利康提供,仅供医疗卫生专业人士进行医学科学交流,不用于推广目的
本文由《呼吸界》编辑 冬雪凝 整理
本文完
责编:Jerry


