
自从测序技术问世以来,既往我们认为的罕见病原学现在也并不“罕见”了,例如鹦鹉热衣原体、军团菌、厌氧菌(如坏死梭杆菌、齿垢密螺旋体等),以及非典型病原体(如肺炎衣原体、肺炎支原体等),在测序技术应用于临床之后,上述罕见病原体的检出率明显升高。
截至目前,全球社区获得性肺炎(CAP)的发病率为1~25/(1000人·年),大约有40%的患者需要住院治疗,其中重症社区获得性肺炎(SCAP)的年死亡率高达48%,这与各国的医疗救治水平直接相关,中非死亡患者数量位居首位。在全球CAP病因中,最常见是肺炎链球菌、流感嗜血杆菌和金黄色葡萄球菌。
欧美国家CAP病因主要为流感病毒、肺炎链球菌、军团菌和支原体,少有科克斯氏病原体及大肠杆菌感染;而中国和印度CAP病因则主要为肺炎支原体、肺炎链球菌、流感嗜血杆菌和肺炎衣原体,少见卡他莫拉菌及铜绿假单胞菌感染。在ICU,重症肺炎患者中超过一半来自于血液科、移植病房、风湿免疫科以及肿瘤科,这部分免疫功能低下患者一旦罹患CAP或医院获得性肺炎(HAP),也就意味着他们会有更高的死亡率。全球CAP患者免疫功能低下患病率为17.6%,南美洲为24.8%、北美洲为24.0%、大洋洲为20.0%。
与免疫功能正常患者相关CAP相同的呼吸道关键病原体,在革兰氏阳性菌中主要是肺炎链球菌、金黄色葡萄球菌,在革兰氏阴性菌中主要是流感嗜血杆菌、卡他莫拉菌;在非典型病原体中,主要为嗜肺军团菌和肺炎衣原体;在呼吸道病毒中主要是流感病毒和副流感病毒。此外,还有一部分常见病原体(除外关键病原体并可行抗微生物治疗的呼吸道病原体),包括大肠杆菌、非结核分枝杆菌、巨细胞病毒、曲霉、毛霉等,这些也是引起免疫功能低下相关CAP的病原体。
詹庆元教授团队开展的研究比较了免疫功能低下与免疫功能正常的CAP患者的病原学,结果发现:免疫功能受损,尤其是细胞免疫功能受损患者,CAP的首要病因为肺孢子菌,结核分枝杆菌相对少见。总体而言,免疫功能低下患者真菌感染更普遍。而免疫功能正常患者,CAP的首要病因是甲型流感病毒,巨细胞病毒少见。因此,对于免疫功能正常患者,流感病毒感染更普遍。
少见病原体重症肺炎
1、厌氧菌
1)坏死梭杆菌
Lemierre综合征(LS)是以法国医生Andre Lemierre的名字命名,他在1936年报告了20例由口咽感染引起的厌氧败血症。
(1)流行病学:在抗生素广泛应用的年代,LS的发病率急剧下降。自70年代后期口腔感染中经验性抗生素的使用减少,报告的病例数量稳步上升,被称为“被遗忘又重现的疾病”,发病率为每年1/10000000,通常为青少年和年轻人,即使使用适当的抗生素和治疗,报道死亡率也在5%~18%之间。
(2)致病菌:导致LS的致病菌通常为坏死梭杆菌(>70%),它是严格的专性厌氧革兰氏阴性杆菌。
(3)病理生理:首先由于细菌、病毒致咽部黏膜损伤,在此基础上出现坏死梭杆菌的二重感染:①感染至咽外侧间隙和颈部软组织,引起外源性压迫,出现炎症、水肿;②内源性闭塞,出现血管内凝血。在上述基础上发生颈内静脉脓毒性血栓形成;感染性栓子从任何一条静脉播散,都可能导致肺、胸膜、关节、骨骼、肌肉、肝、脾、肾等多处器官受累。
(4)临床特征:①口咽感染;②颈内静脉血栓性静脉炎感染延伸至颈部旁间隙;③脓毒性栓子播散引起菌血症、脓毒性休克。
(5)诊断:①血培养:培养时间需要6~8天,阳性率低;②分子生物学方法:快速且准确,有助于早期诊断;③BALF、m-ROSE、NGS等。
LS的Sinave诊断标准:①口咽部的原发感染;②脓毒败血症;③颈内静脉感染性栓塞;④远处脏器转移性化脓灶。
(6)治疗:①抗菌药物治疗:碳青霉烯类、β-内酰胺/β-内酰胺酶抑制剂联合甲硝唑是治疗LS最有效的药物。②抗凝治疗。③外科治疗。
2)齿垢密螺旋体
(1)定义:齿垢密螺旋体是一种螺旋形的革兰氏阴性厌氧菌,属解糖密螺旋体,与口腔以及牙周感染性疾病密切相关。
(2)流行病学:关于齿垢密螺旋体,近4年来仅有寥寥数篇报道,极为罕见。
(3)易患人群:长期卧床、生活无法自理导致口腔卫生较差、牙周状况不理想、免疫功能低下的老年人。
(4)临床症状:多为非特异性症状,可有吸入性肺炎的一系列临床表现,如咳嗽、咳痰、甚至咯血,也可有畏寒、发热等。
(5)诊断:肺穿刺组织或BALF宏基因组测序。
(6)治疗:目前仍按照密螺旋体属中常见人致病螺旋体进行治疗,首选为青霉素,其他如半合成青霉素、四环素类等药物亦有较好效果。
齿垢密螺旋体感染病例
患者男性,72岁。主诉:间断咳痰、咯血1月半余,发现肺结节1月余。患者2023年2月中旬无明显诱因出现间断咳痰,咳白黄痰,痰中带血,每天5~6次,无发热,无胸痛等不适,后出现咯鲜血,咯绿豆大小血块,4~5次/天,就诊于当地医院,胸部CT提示左肺上叶占位,予莫西沙星抗感染治疗约1周后症状好转,后就诊于我院。
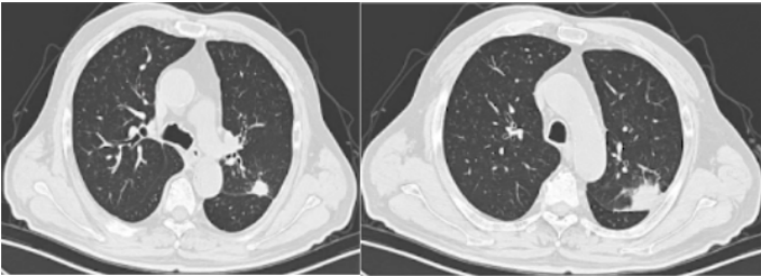
患者入院前胸部CT
入科后,予患者支气管镜下肺泡灌洗并将BALF送检mNGS,结果回报检出齿垢密螺旋体(序列数36条)。予哌拉西林他唑巴坦4.5 g q8h+米诺环素100 mg q12h抗感染,调整治疗方案为美罗培南1 g q8h,后期仅采用替加环素50 mg q12h治疗。抗感染治疗后,患者左肺上叶结节明显缩小。
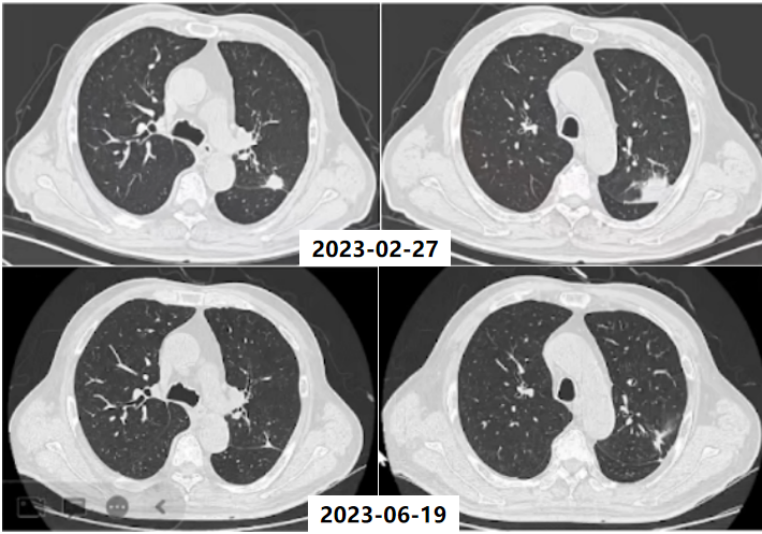
随访患者胸部CT
2、非典型病原体
非典型病原体是一种细胞内或细胞旁的细菌病原体,无法通过革兰氏染色和传统培养基进行识别,对β-内酰胺具有内在耐药性。2022年Microorganisms杂志发表的综述显示,在CAP病因中,非典型病原体占15%,这其中,肺炎支原体位居首位,其次是肺炎衣原体,然后是嗜肺军团菌以及鹦鹉热衣原体等。
1)嗜肺军团菌——军团菌肺炎
1976年夏天宾夕法尼亚州费城Bellevue-Stratford酒店举行的为期3天的美国退伍军人协会年度大会上,嗜肺军团菌感染首次被发现。
(1)流行病学:既往军团菌肺炎的病死率可达10%~15%,院内感染死亡率可达25%~50%。随着喹诺酮类药物的临床应用,该病病死率有所下降。该病发病具有季节性,全年均可发生,以6~10月发病最多。
(2)致病菌:军团菌肺炎的致病菌通常为嗜肺军团菌血清型1,约占90%,是一种需氧革兰氏阴性杆菌,细胞内寄生菌,双相生存周期。
(3)传播途径:军团菌广泛存在于自然界中,尤其是温暖潮湿的环境,如人工冷水、天然水源、潮湿土壤等。军团菌感染多通过吸入受污染的人造水源(如淋浴、管道、空调系统等)产生的含军团菌气溶胶。
(4)易患人群:>50岁、吸烟、免疫抑制(尤其是细胞免疫抑制)、合并慢性心肺疾病等。
(5)影像学表现:肺部变化通常为单侧,主要局限于下叶,但也可能出现在两侧,包括肺部的上下部分;肺部的炎症变化可表现为3种类型的浸润——肺泡型、间质型和局灶型。军团菌肺炎的胸部X线片和CT最具特征的表现是不规则形状的肺组织大面积固结,靠近肋和/或水平胸膜,有空气支气管造影征象和局灶性肺泡-间质磨玻璃样混浊。
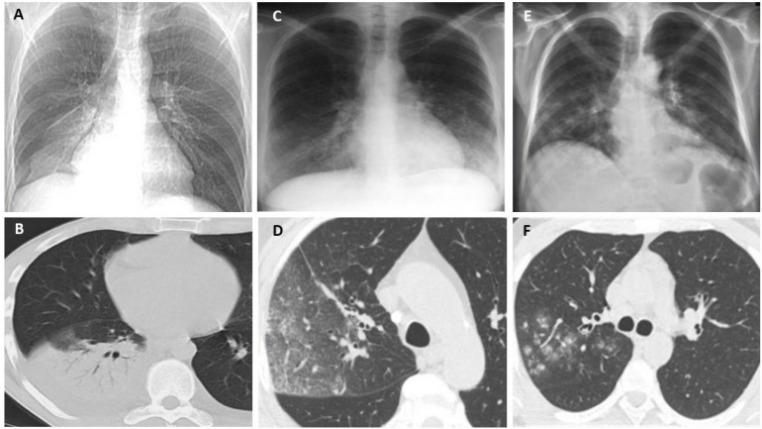
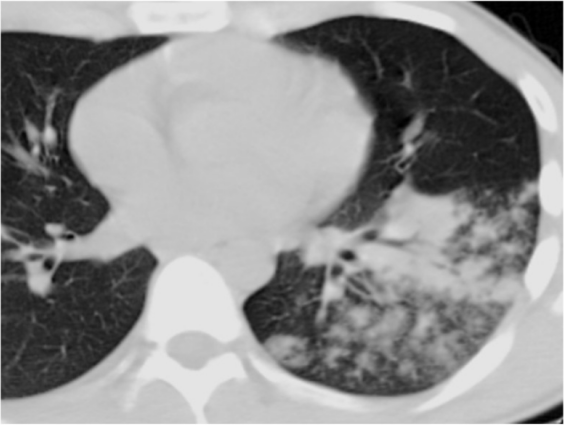
军团菌属引起的支气管肺炎的影像学表现
图源:J Clin Med, 2022, 11(20):6126.
(6)临床表现:男性多见,约90%的患者体温超过38.5°C;呼吸道症状主要有咳嗽、咳痰、气促;神经肌肉系统表现为头痛、肌痛、关节痛;会出现相对缓脉,多脏器损害。
(7)实验室指标:低钠血症,低磷血症,磷酸激酶、肝酶、ESR、CRP水平升高等。
(8)影像学检查:军团菌肺炎的影像学表现具有多样性,其较为特征的改变是磨玻璃影间混杂边界分明的实变区。
(9)病原学检测:分离培养(BALF培养阳性率最高)以及抗原抗体检测等(表1)。
表1 军团菌肺炎的筛查策略
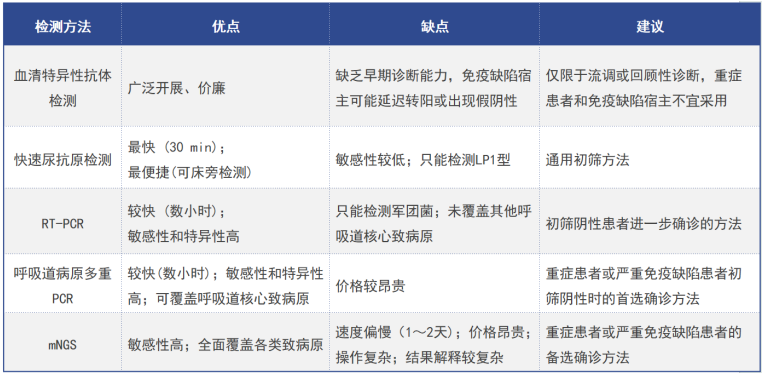
(10)治疗:①抗感染治疗:主要为经验性治疗,首选氟喹诺酮类抗生素。②尚未明确的治疗方式:药物联合治疗,如喹诺酮类+大环内酯类,以及糖皮质激素治疗,目前尚无指南共识推荐。③对于重症军团菌肺炎,可以联合ECMO(可以提高重症患者生存率)。
军团菌肺炎病例
患者,男,34岁,军人。主因“诊断慢性粒细胞白血病13年余,咳嗽6天,发热2天”于2022年7月16日收入血液科,后因喘憋加重于2022年9月1日转入我科。患者于2021年诊断亚临床甲减、桥本病,未治疗。既往有多次输血史。个人史及家族史无特殊。
2008年诊断慢性粒细胞白血病,口服伊马替尼治疗约1年,后未规律监测。2020年4月自行口服伊马替尼治疗至2022年7月。2022年7月初在外出差期间发现身上多发出血点,2022年7月9日查血常规提示白细胞升高、血小板降低,具体报告未见,自行口服达沙替尼治疗,后出现腹泻,自行停药。2022年7月11日出现咳嗽,进行性加重,夜间无法入睡,伴少量黄色黏痰。2022年7月14日因头晕、乏力、腹泻加重,就诊于我院急诊,体温38.7°C,完善血常规、生化、凝血、感染指标、胸部CT,考虑为慢性粒细胞白血病加速期、肺部感染、电解质紊乱、凝血功能异常。2022年7月16日收入我院血液科。
入院后相关检查显示:BALF细胞分类中性粒细胞占18%,细胞总数0.36×106。BALF GM试验1.146 μg/L。BALF及肺组织mNGS均回报嗜肺军团菌。经过抗感染治疗,患者病情好转。
2)鹦鹉热衣原体——鹦鹉热
鹦鹉热是一种人畜共患传染病。鹦鹉热衣原体是一种专性真核细胞寄生、具有独特的发育周期、革兰氏阴性的病原菌。
(1)流行病学:一年四季均可发病,秋冬季发病率升高。
(2)易患人群:主要发生于中老年人群,男性多于女性,50%以上有鸟类或家禽接触史。
(3)临床特征:鹦鹉热多为非特异性临床表现。
(4)诊断:①影像学检查(胸部X线片、胸部CT)最常见的表现为肺叶变化,常合并支气管充气征等。②动脉血气分析。③BALF NGS可以明确诊断。
(5)治疗:首选治疗方案为四环素类药物,包括盐酸四环素、多西环素、米诺环素。妊娠期或儿童患者可以使用大环内酯类抗生素治疗,如阿奇霉素和红霉素,疗程为7天。
鹦鹉热病例
患者女,51岁。主诉:发热6天,咳嗽、憋喘4天,于2019年11月27日入院。既往体健,近3个月经量增多,当地诊断子宫肌瘤、黏膜下肌瘤,宫颈病变。入我院1周前发现贫血予输血。体检示右肾囊肿。家族史:父母已故。家中养3只鸡。
患者于2019年11月21日无明显诱因出现发热,多于午后出现,波动在38.3°左右,就诊于当地医院。次日完善胸片示肺部感染,予哌拉西林他唑巴坦、氨曲南抗感染治疗(具体不详)。2019年11月23日出现憋喘、咳嗽,活动后憋喘明显加重,咳嗽为刺激性干咳,无咳痰。上述症状影响患者的工作及生活。患者因憋喘进行性加重于2019年11月26日转入我院急诊科,胸部CT:双肺感染性病变,右肺为著;双侧胸腔积液。急诊给予头孢哌酮舒巴坦3 g bid静滴等治疗。为进一步检查及治疗,以“肺部感染"收入我科。入院后予行气管镜检查,BALF和血NGS均检出鹦鹉热衣原体序列【对于无法耐受气管镜检查的重症患者,血NGS也是重要的诊断参考】。经过积极的抗感染治疗,患者病情得到缓解,肺部病变吸收明显。
3)惠普尔养障体——惠普尔养障体肺炎
惠普尔养障体是一种杆状的革兰氏阳性细菌,可以引起全身性感染性疾病。肠道是惠普尔养障体唯一已知的天然生态位。目前该细菌已经广泛发现在各种样本中,包括BALF、唾液、尿液、血液、粪便、淋巴结等。惠普尔养障体可以从口腔菌群中吸入,导致社区获得性和吸入性肺炎,严重者可能发生呼吸衰竭甚至死亡。
(1)流行病学:惠普尔养障体感染所致疾病常见于高加索人种,在亚洲和非洲人群中非常罕见。其发病率约为百万分之一。
(2)易感人群:HIV阳性患者、下水道工人、流浪汉等。易感人群细菌携带率以及载量显著高于普通人。近年来由于对惠普尔养障体肺炎认识程度的提高以及诊断技术的改进,病例报告的数量也在不断增加。因此该病的实际发生率高于预期。
(3)宿主:普遍认为惠普尔养障体没有重要的非人类宿主。
(4)临床表现:惠普尔养障体感染所致肺炎具有广泛的非特异性临床表现。疾病早期的患者可能会出现感染、发热、关节炎和关节痛的症状;疾病中期出现腹泻、吸收不良和体重减轻等综合症状;疾病晚期则可能累及各个生理系统,在80%~90%的病例中,第一个前驱体征是关节炎和/或关节痛。入院患者则多以呼吸急促和咳嗽为主诉。
(5)实验室检查及影像学:贫血、低白蛋白血症及ESR或CRP水平升高,胸部CT可能出现多种改变,包括磨玻璃影、肺结节、胸膜增厚和渗出性病变依据与肺脓肿非常相似的气液平等。
(6)诊断方法:常规实验室检查常出现非特异性结果,既往最常见的诊断方法是组织病理学和PCR。近年来BALF mNGS已被证明能够提供更全面的气道细菌感染情况,识别并筛查诱发肺炎的惠普尔养障体。
(7)治疗:目前推荐的治疗方案包括:头孢曲松(2 g qd) 或美罗培南(1 g tid),持续14天,后续口服复方磺胺甲噁唑(TMP-SMZ)2个月。若治疗过程中患者表现出对TMP-SMZ不耐受,则可使用多西环素。
3、真菌
1)肺孢子菌——肺孢子菌肺炎
肺孢子菌肺炎是由卡氏肺孢子菌引起的呼吸系统感染,是一种发生于免疫功能受损个体中的感染,可能会危及患者生命。
(1)流行病学:2012—2022年肺孢子菌肺炎发病率从2.2/10万增加至3.9/10万,30天死亡率为18.2%。
(2)易感人群:HIV阳性患者,血液病,实体器官移植患者。
(3)临床表现:具有非特异性。患者有进行性呼吸困难、低热等表现。
(4)影像学表现:双侧弥漫性间质浸润;伴有弥漫性斑片状实变和磨玻璃影。
(5)诊断:①乳酸脱氢酶(LDH)水平增加常作为HIV感染者中疑诊肺孢子菌肺炎的临床标志。②1,3-β-D-葡聚糖水平升高时,也应怀疑肺孢子菌肺炎。③DFA、qPCR检测。
(6)治疗:①首选TMP-SMX治疗,剂量为15~20 mg/(kg·d),分3次或4次给药。治疗持续时间一般为21天。目前临床也有采取TMP-SMX联合卡泊芬净治疗。②辅助治疗:动脉血气显示PaO2<70 mmHg或低氧血症,建议给予糖皮质激素辅助治疗。
肺孢子菌肺炎病例
患者男,80岁。主诉:呼吸困难4天,发热1天。于2021年2月5日入呼吸科。2020年11月发现重症肌无力(TA型),在我院神经内科住院,接受溴吡斯的明和甲泼尼龙治疗(最大剂量11片/天,规律减至4片/天)。
入院后相关检查:WBC 7.31×109/L,CRP 14.2 mg/L,IL-6 394.3 pg/ml。BALF分类计数:巨噬细胞56%,中性粒细胞32%,淋巴细胞12%,嗜酸性粒细胞0。G试验355 pg/ml。床旁ROSE发现肺孢子菌包囊,NGS测序结果亦提示耶氏肺孢子菌。
2)毛霉
毛霉病是由广泛存在于自然界中的毛霉目菌属导致的感染,感染肺部多为急进性感染,可蔓延至相邻结构或血行播散至其他器官。
(1)流行病学:全球发病率为1.2/10万,印度发病率为14/10万,是全球发病率的14倍。全球死亡率为57%。
(2)易感人群:主要为免疫抑制患者,如流感、新冠病毒感染、糖尿病、器官移植患者等。
(3)临床症状:具有非特异性。常伴有典型的肺炎表现伴咯血。
(4)影像学表现:①局灶性实变、肿块、胸腔积液、多发性结节;②晕轮征提示血管侵入性真菌感染;③反晕征在毛霉菌患者中较其他侵袭性霉菌感染更常见。④伴或不伴空气新月征的空洞病灶在新冠病毒感染后毛霉病中更常见。
(5)诊断:为尽快确诊,应在适当的临床情况中早期考虑毛霉病,并积极完善侵入性检查,通过组织病理学识别出具有毛霉目典型结构的微生物可能是感染的唯一证据。PCR检测可能有助于识别致病菌种。
(6)治疗:手术清创+抗真菌治疗+消除易感因素。
3)马尔尼菲篮状菌
(1)流行病学:2022年年中,34个国家报告了28.8万例马尔尼菲篮状菌病例,东南亚及中国南方地区(广东、广西、福建、云南)多见。马尔尼菲篮状菌为双相型真菌,在25°C时为霉菌形态,在37°C时为酵母菌形态。
(2)宿主:人类和竹鼠。
(3)传播途径:尚不明确,空气传播、直接接种可产生。
(4)易感人群:HIV阳性患者(89.9%),以及其他免疫受损患者(10.1%)。
(5)临床表现:约70%的马尔尼菲篮状菌感染患者会出现皮肤损伤,面部、胸部、四肢随丘疹中心坏死,呈现脐状丘疹外观。
(6)影像学表现:具有非特异性。可有磨玻璃改变、间质性浸润、肺大疱、空洞。
(7)治疗:①诱导治疗:中重度患者(多器官受累),可选用两性霉素B治疗2周;轻度患者(仅有皮肤损伤),可选用伊曲康唑治疗。②巩固治疗:对于任意患者,建议选用伊曲康唑进行10周巩固治疗。③维持治疗:对于免疫受损患者,建议继续维持治疗,伏立康唑可作为替代用药。
4、其他
1)诺卡菌
诺卡菌是一类有菌丝、无动力的需氧革兰氏阳性菌,在人类中可造成局部或全身性疾病,广泛存在于土壤、空气、污水和腐生物中。
(1)传播途径:多通过吸入受污染的粉尘感染,可传播至呼吸道或消化道,形成局部或经血行播散至脑、肝、肾等部位。
(2)易感人群:免疫功能受损患者(HIV感染、器官移植后慢性基础性肺病等)。
(3)临床表现:具有非特异性。
(4)影像学特征:多见单侧/双侧肺结节,也可见肺实变、肿块、胸腔积液、网状结节。
(5)诊断:根据患者的临床表现(易感因素、临床症状、CT表现)以及检查检验结果(M-ROSE、组织病理学、微生物学)进行判断。
(6)治疗:抗诺卡菌治疗,重建免疫功能,降低病死率。首选TMP-SMX,15 mg/(kg·d),静脉注射。备选方案:亚胺培南西司他丁500 mg静脉注射q6h+阿米卡星7.5 mg静脉注射q12h,3~4周,改为TMP-SMX口服。推荐疗程为3个月,长期使用免疫抑制者疗程为6个月。
2)弓形虫——肺弓形虫病
属于机会性病原体,见于免疫功能低下、免疫缺陷患者以及婴幼儿,引发肺弓形虫病。
(1)流行病学:全球输血患者患病率可达33%,接受干细胞移植患者死亡率可达43.5%。
(2)致病菌:刚地弓形虫,分为强毒株RH株、弱毒株Beverley株。
(3)传播途径:人畜共患。摄入生肉或熟肉中的囊肿;受感染猫科动物粪便污染基质中的卵囊;速殖子的先天性传播;输血传播。
(4)临床特征:免疫功能低下患者症状明显;非特异性呼吸道症状,如发热、呕吐、腹泻、皮疹等;肺外器官受累,包括肝脾肿大、颌下及颈后淋巴结肿大等。
(5)诊断:①病原学检查(确诊)。涂片染色,如姬氏染色,阳性率低,易漏检;动物接种分离法,培养7天,阴性传代3次以上。②血清学实验(辅助诊断),包括染色试验、间接血凝试验、间接免疫荧光抗体试验、PCR及DNA探针。
(6)治疗:在弓形虫增殖阶段,使用TMP-SMZ,联合乙胺嘧啶可增加疗效。孕妇感染首选螺旋霉素,佐用免疫增强剂。
3)炭疽杆菌——炭疽病
炭疽杆菌属于厌氧、革兰氏阳性、形成孢子、非运动的、杆状芽孢杆菌,外界环境抵抗力强,导致人畜共患疾病。
(1)流行病学:吸入型炭疽病死亡率为85%,摄入型炭疽病死亡率为74%。皮肤型炭疽病死亡率为46%,注射型炭疽病死亡率为33%。
(2)致病菌:炭疽杆菌,分为生物活性的植物形态和生物惰性的孢子形态。
(3)传播途径:人畜共患。接触濒死或已死亡动物(屠宰动物);接触受污染的动物产品(皮革、骨粉肥料);食用受污染的肉类;自注射(注射受污染的毒品);院内传播。
(4)临床表现:①吸入性炭疽:潜伏期1~7天;初始阶段轻度发热、疲劳、排痰性咳嗽和胸痛或腹痛。严重阶段则为高热,毒血症、呼吸困难和发绀,甚至休克、死亡。纵隔增宽是吸入性炭疽的典型表现。②胃肠道炭疽:潜伏期3~7天,病变可见于胃肠道的任何一点,发热、咽痛、吞咽困难、恶心、呕吐、厌食、腹泻等。可从血液、腹水和病变组织中分离出炭疽杆菌来明确诊断。③皮肤炭疽:潜伏期2~7天;最初可为瘙痒性皮疹,可逐渐进展为红斑和水肿包围的水疱,最后有焦痂形成。④注射性炭疽:是炭疽病的一种新型临床形式,软组织在注射部位被感染并导致毒血症和败血症。
(5)诊断:炭疽病的诊断组结合患者的基本情况和临床检查检验综合判断。基本情况包括患者的病史、症状、体征、旅居史、动物接触史等。临床检验检查包括血培养(金标准)、PCR、影像学(纵隔增宽、胸腔积液和实质浸润等)、BALF或活检标本等。
(6)治疗:炭疽病应尽早治疗。静脉给予抗菌药物联合治疗,青霉素G和阿莫西林是首选药物;可行抗毒素治疗;胸腔引流可以减少通气的必要性和持续时间;炭疽疫苗可扩展用于针对致命性肺炭疽的吸入免疫。
小结
对于ICU收治的重症肺炎患者,在常规抗感染治疗失败后,一定要警惕罕见病原体导致的感染,包括厌氧菌、非典型病原体、真菌、寄生虫等。少见病原体引起的重症肺炎,由于诊断困难,往往会延误治疗,此类患者病死率较高,因此早期快速精准诊断和个体化治疗尤为重要。
参考文献
[1] Martin-Loeches I, Torres A, Nagavci B, Aliberti S, et al. ERS/ESICM/ESCMID/ALAT guidelines for the management of severe community-acquired pneumonia[J]. Intensive Care Med, 2023, 49(6):615-632.
[2] Cavallazzi R, Furmanek S, Arnold FW, et al. The Burden of Community-Acquired Pneumonia Requiring Admission to ICU in the United States[J]. Chest, 2020, 158(3):1008-1016.
[3] Safiri S, Mahmoodpoor A, Kolahi AA, et al. Global burden of lower respiratory infections during the last three decades[J]. Front Public Health, 2023, 10:1028525.
[4] Torres A, Cilloniz C, Niederman MS, et al. Pneumonia[J]. Nat Rev Dis Primers, 2021, 7(1):25.
[5] Di Pasquale MF, Sotgiu G, Gramegna A, et al. Prevalence and Etiology of Community-acquired Pneumonia in Immunocompromised Patients[J]. Clin Infect Dis, 2019, 68(9):1482-1493.
[6] Ramirez JA, Musher DM, Evans SE, et al. Treatment of Community-Acquired Pneumonia in Immunocompromised Adults: A Consensus Statement Regarding Initial Strategies[J]. Chest, 2020, 158(5):1896-1911.
[7] Wu X, Sun T, Cai Y, et al. Clinical characteristics and outcomes of immunocompromised patients with severe community-acquired pneumonia: A single-center retrospective cohort study[J]. Front Public Health, 2023, 11:1070581.
[8] Santos L, Monteiro F, Marques M, et al. Lemierre's Syndrome: A Case Report[J]. Cureus, 2023 , 15(1):e34473.
[9] Viasus D, Gaia V, Manzur-Barbur C, et al. Legionnaires' Disease: Update on Diagnosis and Treatment[J]. Infect Dis Ther, 2022, 11(3):973-986.
[10] Garin N, Marti C, Skali Lami A, et al. Atypical Pathogens in Adult Community-Acquired Pneumonia and Implications for Empiric Antibiotic Treatment: A Narrative Review[J]. Microorganisms, 202, 10(12):2326.
[11] Marchello C, Dale AP, Thai TN, et al. Prevalence of Atypical Pathogens in Patients With Cough and Community-Acquired Pneumonia: A Meta-Analysis[J]. Ann Fam Med, 2016, 14(6):552-566.
[12] Lupia T, Corcione S, Shbaklo N, et al. Legionella pneumophila Infections during a 7-Year Retrospective Analysis (2016-2022): Epidemiological, Clinical Features and Outcomes in Patients with Legionnaires' Disease[J]. Microorganisms, 2023, 11(2):498.
[13] Gonçalves IG, Simões LC, Simões M. Legionella pneumophila[J]. Trends Microbiol, 2021, 29(9):860-861.
[14] Iliadi V, Staykova J, Iliadis S, et al. Legionella pneumophila: The Journey from the Environment to the Blood[J]. J Clin Med, 2022, 11(20):6126.
[15] Li S, Tong J, Li H, Mao C, et al. L. pneumophila Infection Diagnosed by tNGS in a Lady with Lymphadenopathy[J]. Infect Drug Resist, 2023, 16:4435-4442.
[16] Qin XC, Huang J, Yang Z, et al. Severe community-acquired pneumonia caused by Chlamydia psittaci genotype E/B strain circulating among geese in Lishui city, Zhejiang province, China[J]. Emerg Microbes Infect, 2022, 11(1):2715-2723.
[17] Dolmans RA, Boel CH, Lacle MM, et al. Clinical Manifestations, Treatment, and Diagnosis of Tropheryma whipplei Infections[J]. Clin Microbiol Rev, 2017, 30(2):529-555.
[18] Fang Z, Liu Q, Tang W, et al. Experience in the diagnosis and treatment of pneumonia caused by infection with Tropheryma whipplei: A case series[J]. Heliyon, 2023, 9(6):e17132.
[19] Pates K, Periselneris J, Russell MD, et al. Rising incidence of Pneumocystis pneumonia: A population-level descriptive ecological study in England[J]. J Infect, 2023, ;86(4):385-390.
[20] Dunbar A, Schauwvlieghe A, Algoe S, et al. Epidemiology of Pneumocystis jirovecii Pneumonia and (Non-)use of Prophylaxis[J]. Front Cell Infect Microbiol, 2020, 10:224.
[21] Grønseth S, Rogne T, Heggelund L, et al. Role of fungal burden in risk stratification of HIV-negative patients with Pneumocystis pneumonia: A 12-year, retrospective, observational, multicenter cohort[J]. Int J Infect Dis, 2023, 134:177-186.
[22] Özbek L, Topçu U, Manay M, et al. COVID-19-associated mucormycosis: a systematic review and meta-analysis of 958 cases[J]. Clin Microbiol Infect, 2023, 29(6):722-731.
[23] Cornely OA, Alastruey-Izquierdo A, Arenz D, et al. Global guideline for the diagnosis and management of mucormycosis: an initiative of the European Confederation of Medical Mycology in cooperation with the Mycoses Study Group Education and Research Consortium[J]. Lancet Infect Dis, 2019, 19(12):e405-e421.
[24] Cao C, Xi L, Chaturvedi V. Talaromycosis (Penicilliosis) Due to Talaromyces (Penicillium) marneffei: Insights into the Clinical Trends of a Major Fungal Disease 60 Years After the Discovery of the Pathogen[J]. Mycopathologia, 2019, 184(6):709-720.
[25] Narayanasamy S, Dougherty J, van Doorn HR, et al. Pulmonary Talaromycosis: A Window into the Immunopathogenesis of an Endemic Mycosis[J]. Mycopathologia, 2021, 186(5):707-715.
[26] Wang F, Han R, Chen S. An Overlooked and Underrated Endemic Mycosis-Talaromycosis and the Pathogenic Fungus Talaromyces marneffei[J]. Clin Microbiol Rev, 2023, 36(1):e0005122.
[27] Kanne JP, Yandow DR, Mohammed TL, et al. CT findings of pulmonary nocardiosis[J]. AJR Am J Roentgenol, 2011, 197(2):W266-72.
[28] Kanne JP, Yandow DR, Mohammed TL, Wu Y, Wang F, Wang C, Toxoplasma gondii in patients with lung infections by a duplex qPCR assay[J]. PLoS Negl Trop Dis, 2021, 15(12):e0010025.
[29] Hendricks K, Person MK, Bradley JS, et al. KaClinical Features of Patients Hospitalized for All Routes of Anthrax, 1880-2018: A Systematic Review[J]. Clin Infect Dis, 2022, 75(Suppl 3):S341-S353.
[30] Gates-Hollingsworth MA, Kolton CB, Hoffmaster AR, et al. Rapid Capsular Antigen Immunoassay for Diagnosis of Inhalational Anthrax: Preclinical Studies and Evaluation in a Nonhuman Primate Model[J]. mBio, 2022, 13(3):e0093122.
作者简介

谢菲
主任医师,博士,硕士研究生导师;解放军总医院呼吸与危重症医学部重症医学科主任;中华医学会呼吸病学分会危重症学组委员;中国医师协会呼吸医师分会危重症学组委员;中国医师协会急救复苏和灾难医学专业委员会危重病与人工生命支持学组委员;全军呼吸专业委员会危重症学组委员;北京市医学会呼吸病学分会呼吸危重症学组委员;主持国家自然科学基金、国家十三五重点研发计划、后勤科研重点项目等多项国家及省部级课题;第一完成人获得解放军总医院医疗成果一等奖、中国产学研创新成果一等奖,主要完成人获得军队科技进步一等奖。
本文转载自订阅号「重症肺言」(ID:RCCRC_0067)
原链接戳:不明原因发热的诊断思路及策略
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


