肿瘤治疗已经步入「个体化时代」
今天和大家一起讨论关于驱动基因阳性的非小细胞肺癌患者的规范化治疗。虽然靶向治疗已经进入我们的临床视野很多年,但是我们现在仍然要讨论规范化治疗。

肺癌可以称为精准医学的领跑者,肺癌是肿瘤精准诊疗的典范。到目前为止,肿瘤治疗已经步入「个体化时代」,之前我们把肺癌当成一个疾病,治疗非常单一,对于晚期肺癌来说只有化疗,对于早期肺癌而言也只能开刀,所以叫做「同病同治」。进入了个体化时代以后,发生了巨大的变化。我们说肺癌不是一个疾病,而是一组疾病,它是抑制性非常明显的一组疾病。现在的治疗方式叫做「同病异治」。有很多肺癌的治疗方式,不同的驱动基因、不同的免疫状态都有不同的治疗方案;还有一种方式叫做「异病同治」,如果有同一个基因变化的一组疾病,无论原发病长在什么器官,它都可以用一种药物进行治疗。这就是精准医学的个体化治疗时代带来的一系列的变化,严格意义上讲,这对医生的要求越来越高,我们已经完全超越了传统医疗的时代。
肺癌精准分型是肿瘤诊疗的典范

1984年,首次在肺癌中发现KRAS突变,距离现在将近40年的时间,到现在我们仍然在努力让KRAS变成一个可治疗的靶点。差不多是20年左右的时间,我们发现了EGFR的酪氨酸激酶抑制剂,真正进入肺癌的靶向治疗时代。这20年发生了非常巨大的变化,除了刚才讲到的EGFR这个驱动基因外,我们还发现了ALK、ROS-1、c-MET、BRAF等,驱动基因谱变得越来越广泛。肺癌的分型由过去单纯的病理组织学分类,进一步细分为基于驱动基因的分子亚型。
分子分型的广泛应用带来NSCLC的治疗规范革新
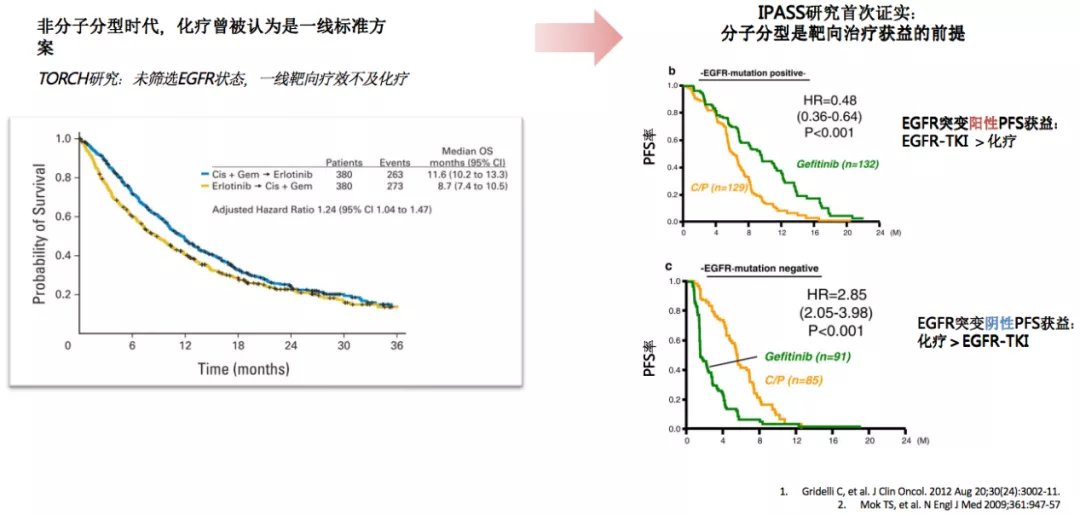
提到肺癌的精准医学或者是肺癌的分子靶向治疗,我们不得不去讨论一项重要的临床研究,IPASS研究。在IPASS研究之前,当时所有的化疗药物,包括三代的化疗药物,对晚期肺癌治疗的疗效达到了瓶颈。IPASS研究之前,TORCH研究中,未筛选EGFR状态,一线靶向治疗的疗效不及化疗。IPASS研究做了一个非常好的选择,选择了优势人群。在分析中我们看到,EGFR突变阳性的病人和标准的化疗相比,PFS率有明显获益,真正让部分肺癌病人进入了分子靶向治疗时代。IPASS研究首次证实,分子分型是靶向治疗获益的前提。
基于分子诊断的NSCLC诊疗可提升患者临床获益
近些年,NGS(二代测序)进入临床以后,病人的获益不断得到提升,提升来自于精准的分子诊断。NGS技术的发展与成熟,使NSCLC患者确诊后可及时接受伴随诊断检测——针对多个驱动基因、甚至更为广泛的疾病相关基因状态进行检测。
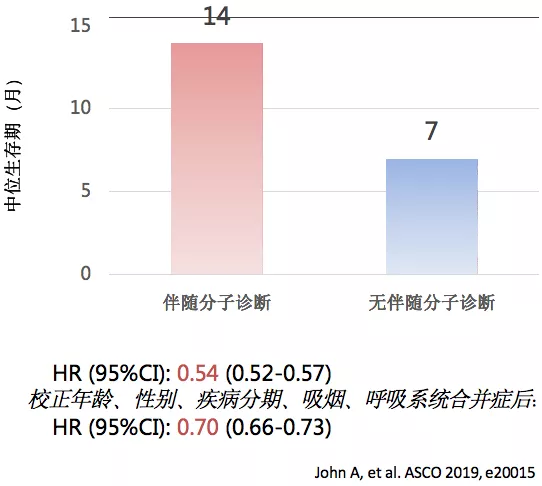
一项真实世界研究,纳入17143例IIIB/IV期NSCLC患者,14389名一线治疗时接受伴随分子诊断,另外2754名无伴随分子诊断,伴随分子诊断的中位生存期比无伴随分子诊断的高了一倍。这就告诉我们精准诊断对精准治疗至关重要。
CSCO指南:分子分型是NSCLC诊疗的重要环节
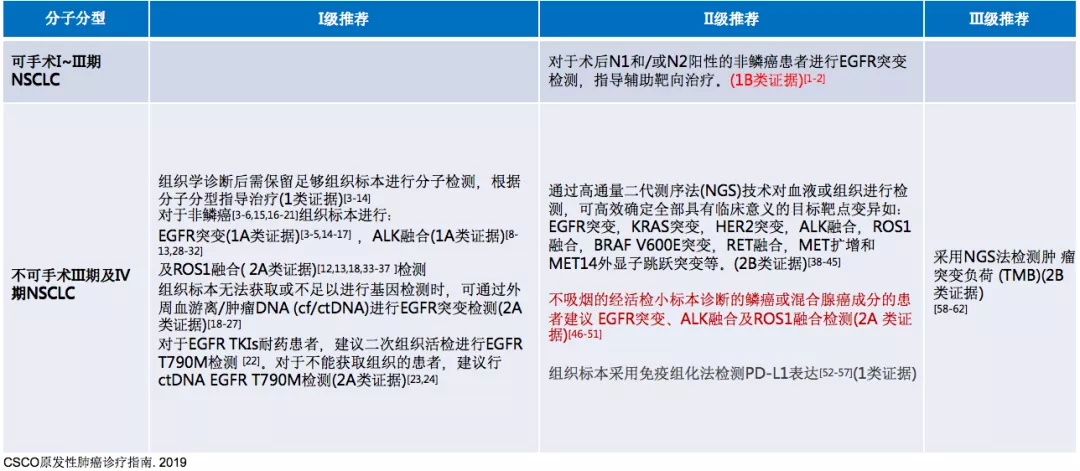
基于2019年《CSCO原发性肺癌诊疗指南》,和大家分享关于驱动基因阳性的非小细胞肺癌的治疗。如果说分子分型是治疗的重要环节,首先我们看看在CSCO指南中如何推荐。
对于可手术的I~III期NSCLC,没有一级推荐;现在有二级推荐的证据,即对于术后N1和/或N2阳性的非鳞癌患者进行EGFR突变检测,指导辅助靶向治疗(1B类证据)。
对于不可手术III期及IV期NSCLC,一级推荐一直非常重要,首先我们不仅要知道组织学诊断,更要知道它的分子分型,比如EGFR突变(1A类证据),ALK融合(1A类证据)及ROS1融合(2A类证据),这三个是最基本的。如果有条件能够知道更多的驱动基因的变化、免疫状态的变化更好。当组织标本无法获取或不足以进行基因检测时,可通过外周血游离/肿瘤DNA(cf/ctDNA)进行EGFR突变检测(2A 类证据)。对于EGFR TKIs耐药患者,指南仍然建议二次组织活检进行EGFR T790M检测。对于不能获取组织的患者,建议行ctDNA EGFR T790M检测(2A类证据)。
二级推荐中重点推荐NGS法,通过高通量二代测序法(NGS)技术对血液或组织进行检测,可高效确定全部具有临床意义的目标靶点变异。不吸烟的经活检小标本诊断的鳞癌或混合腺癌成分的患者建议EGFR突变、ALK融合及ROS1融合检测(2A类证据)。组织标本采用免疫组化法检测PD-L1表达(1类证据)。三级推荐中采用NGS法检测肿瘤突变负荷(TMB)(2B类证据)。
20年间分子靶向新药物、新方案不断涌现
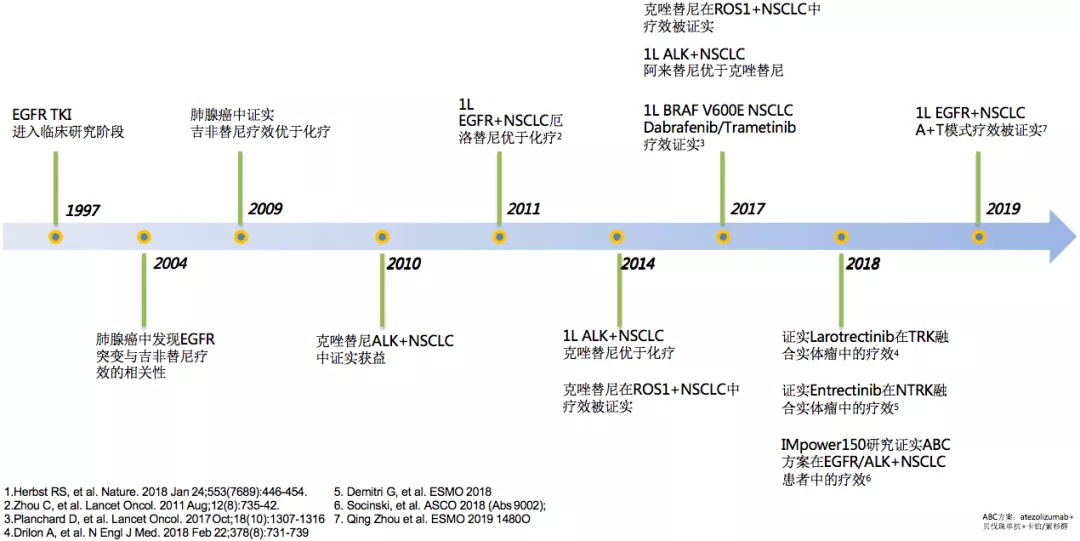
我们来回顾分子靶向治疗的20年间取得了哪些进步。1997年,EGFR TKI进入临床研究;2004年,肺腺癌中发现EGFR突变与吉非替尼疗效的相关性;2009年,肺腺癌中证实吉非替尼疗效优于化疗,从此靶向药物研发的道路就一发而不可收,新的药物像雨后春笋一样;比如ALK抑制剂,克唑替尼,一代EGFR-TKI厄洛替尼,埃克替尼等。在ALK的领域中,近几年不断有新药问世,比如阿来替尼、劳拉替尼等。还有一些新的靶点,比如NTRK等,都有相应的药物。
亚洲NSCLC患者分子靶向药物可治疗性更高
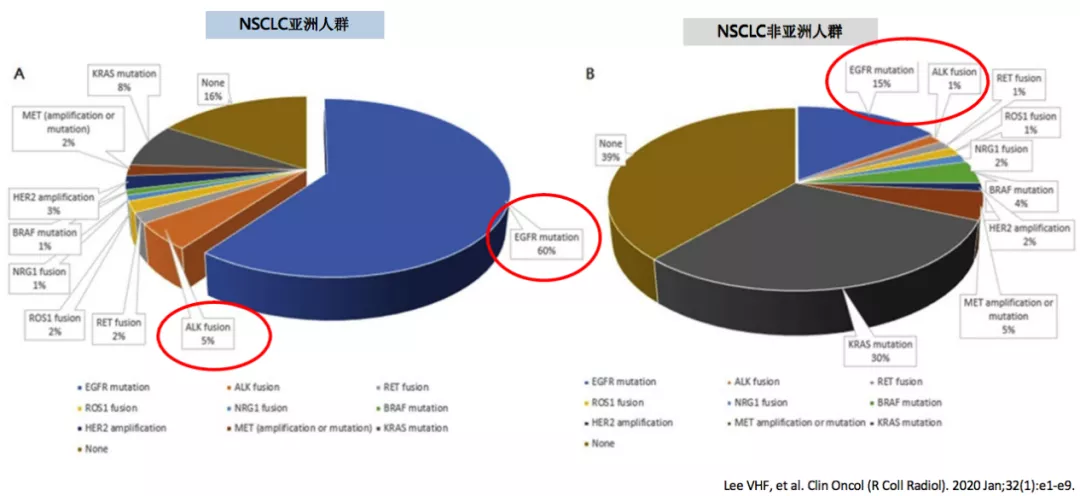
在分子靶向治疗领域里面,亚洲NSCLC患者分子靶向药物可治疗性更高,因为驱动基因的突变的发生率要比高加索人更高。总体而言,亚裔患者更多的可以通过靶向治疗获益。
如何针对不同分子分型患者进行标准治疗?
今天我们主要谈三个位点,EGFR突变、ALK融合、ROS1融合。和大家共同讨论指南推荐的一些重要的证据,和大家分享一些重要的临床研究,这些都是作为循证医学的重要进展。
CSCO指南:EGFR突变NSCLC患者治疗推荐
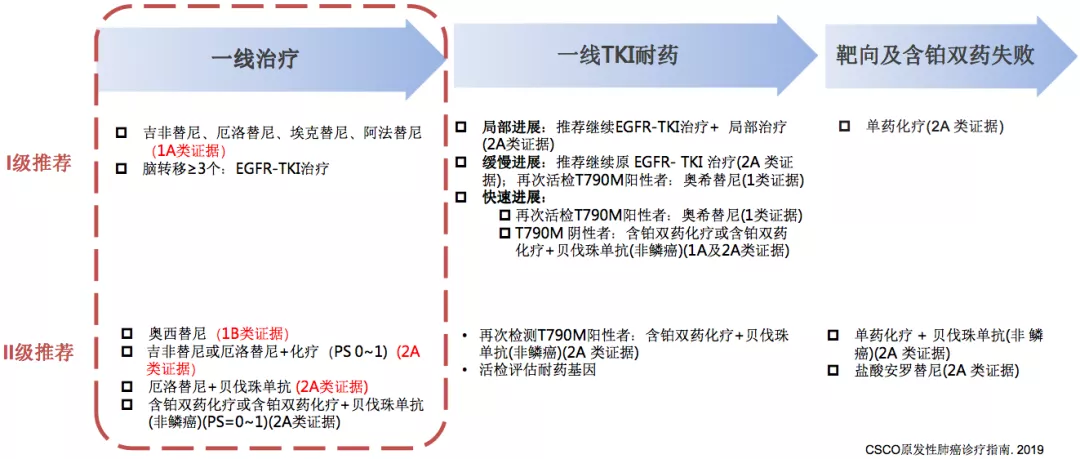
二代 vs. 一代EGFR-TKI,一线治疗的PFS总体相当
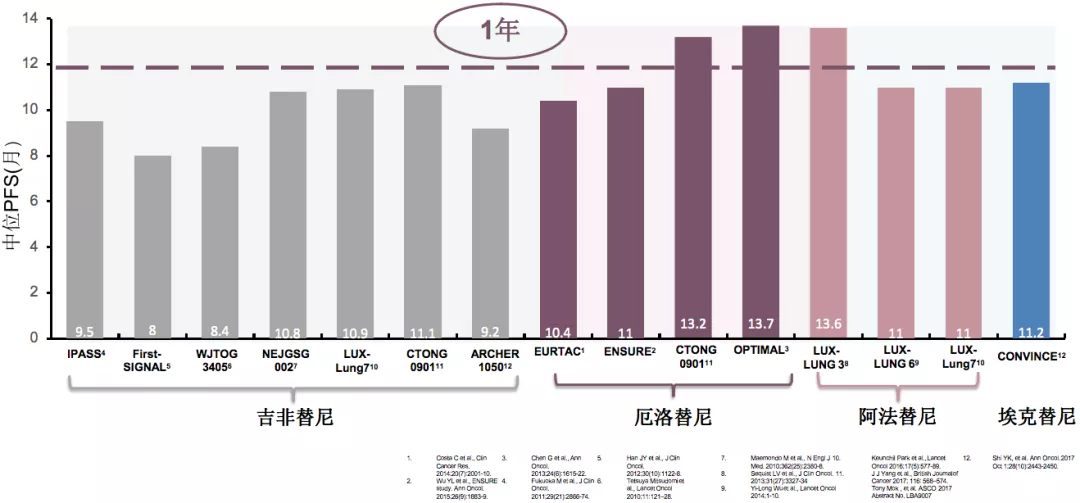
如果我们把一代、二代、三代药物的临床研究的数据相比,总体来说,单药一代TKI在PFS的提升上比较接近,单药二代TKI有所提升,但整体相差不多。
新药物、新方案是否应纳入一线规范治疗体系?
问题就在于:我们到底怎么在传统药物的基础上,比如在三个一代的EGFR-TKI的基础上,新药获批上市以后,或者新的治疗组合方式获批以后,是否应该纳入到规范治疗体系中?基本原则是什么?只要对病人有利、能够改善病人生存和生活质量的,就应该纳入到规范化治疗体系。接下来我们看一看这些药物和治疗方式是否值得推荐。
ARCHER1050:达克替尼对比吉非替尼一线治疗EGFR突变患者
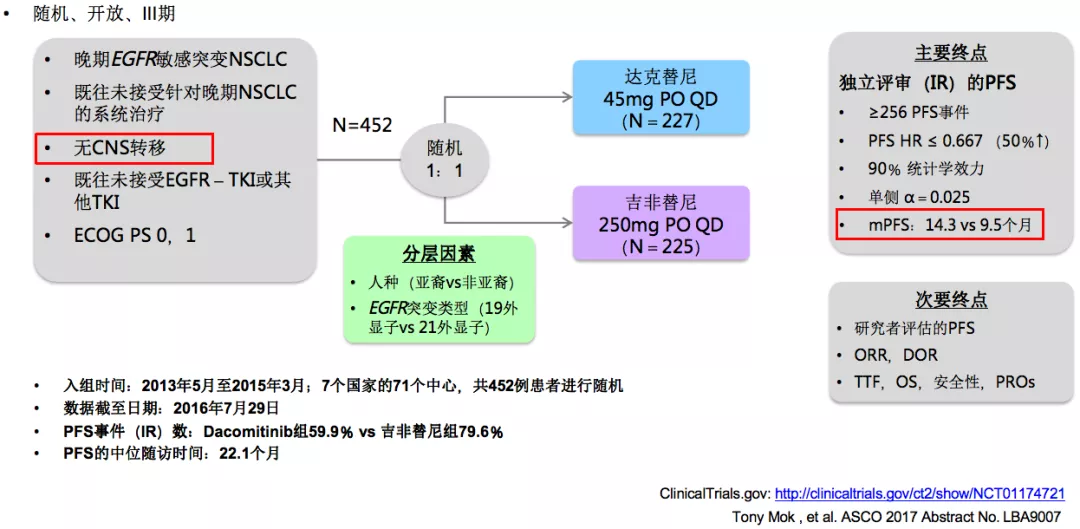
下面我们来看看重要的临床研究。首先是ARCHER1050研究,有关达克替尼对比吉非替尼一线治疗EGFR突变患者。这是一项随机、开放、III期临床研究,入组病人中无脑转移的病人。
ARCHER 1050亚组分析:中国患者PFS
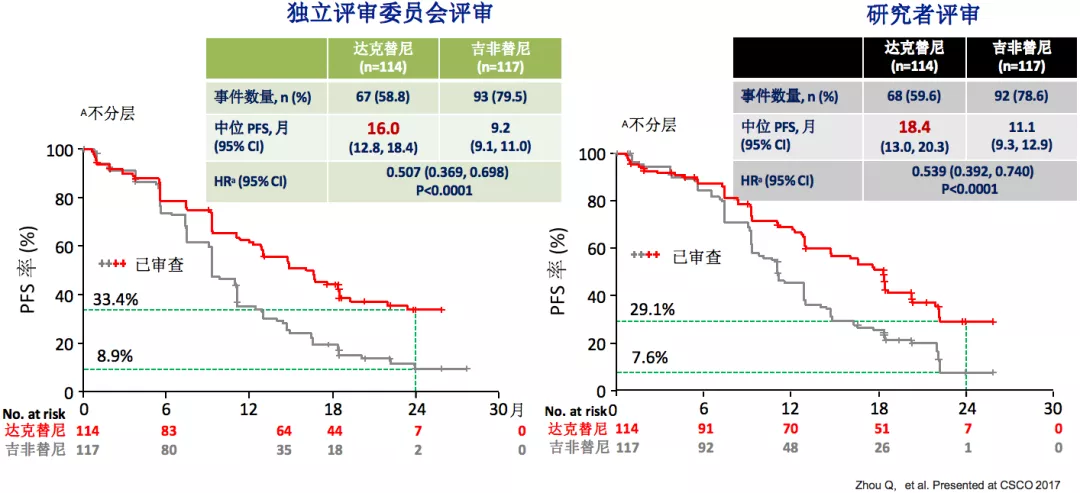
临床研究发现,中国人群的PFS亚组数据,无论是研究者评审,还是独立评审委员评审,相对比较接近,二代的达克替尼要比吉非替尼更好一点,PFS超过16个月。对于中国人群来说,二代的达克替尼比一代的吉非替尼使患者受益更多。
ARCHER 1050研究:21L858R获益不及19DEL
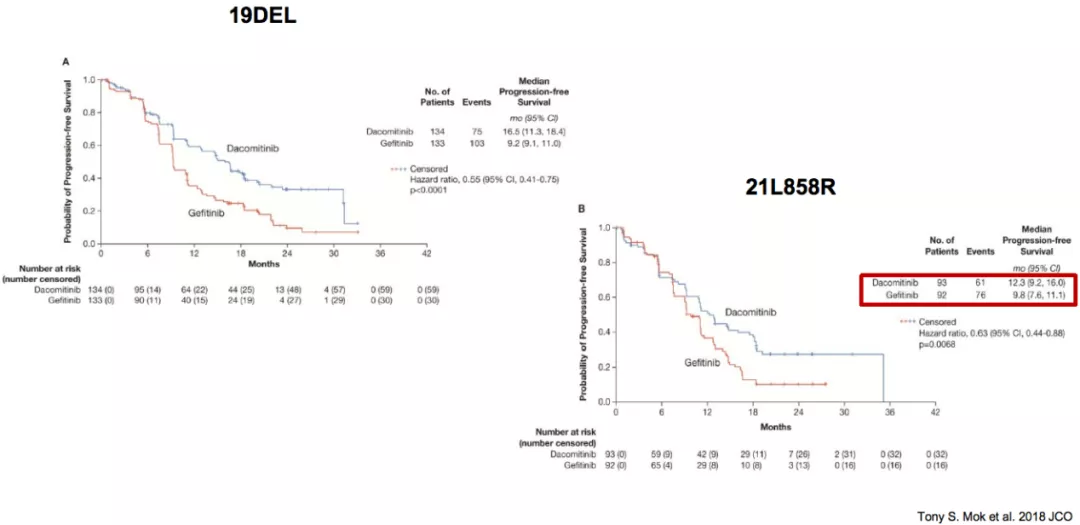
但如果把突变的亚型进行分析,发现在获益人群中,19DEL突变的病人从达克替尼的治疗中获益更多,而21L858R的获益不明显。
FLAURA:奥希替尼对比一代EGFR TKI一线治疗III期研究
接下来开看三代药物在一线的临床研究FLAURA:奥希替尼对比一代EGFR TKI一线治疗III期研究。这个研究从研究设计到研究结果的不断公布,备受关注。
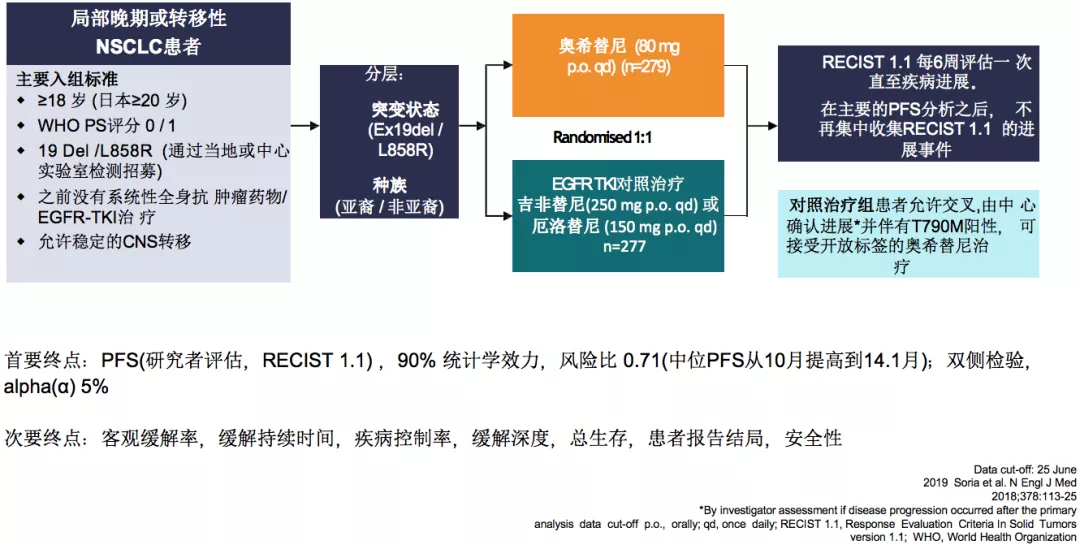
FLAURA:奥希替尼一线PFS更优,但亚裔结果欠佳
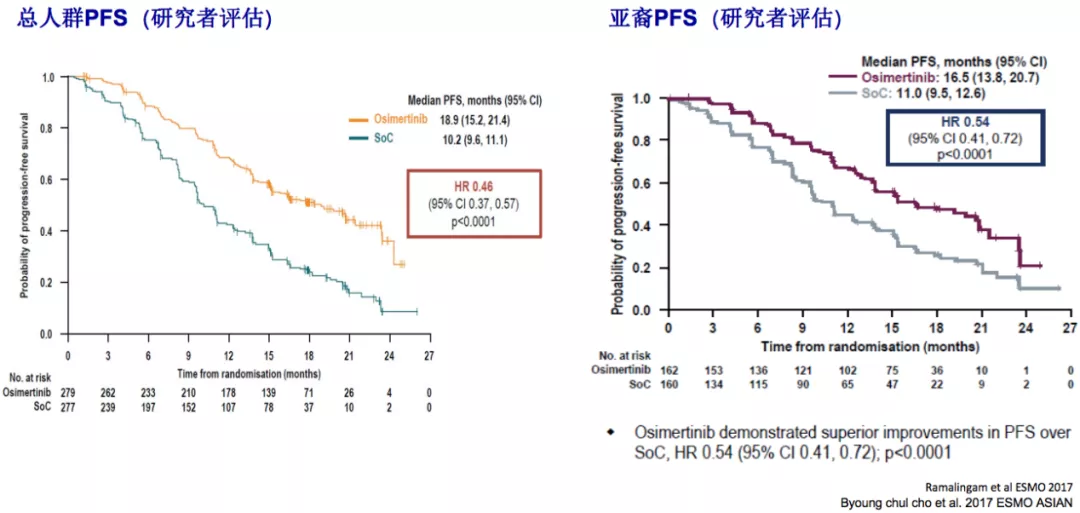
研究者评估的总体人群的PFS为18.9个月,亚裔人群的PFS为16.5个月。
FLAURA:21外显子突变治疗效果仍有待提高
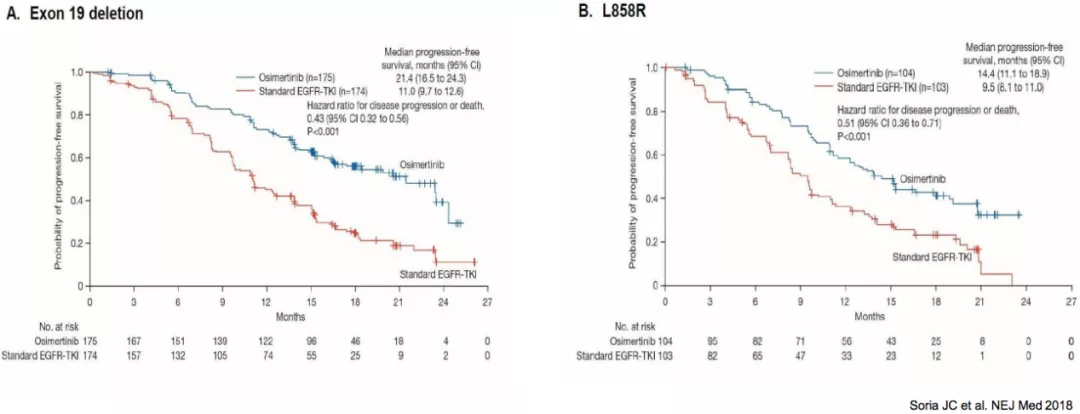
从突变亚型来看,21外显子突变的病人的PFS数据不如19DEL的PFS的数据。
FLAURA研究 OS结果
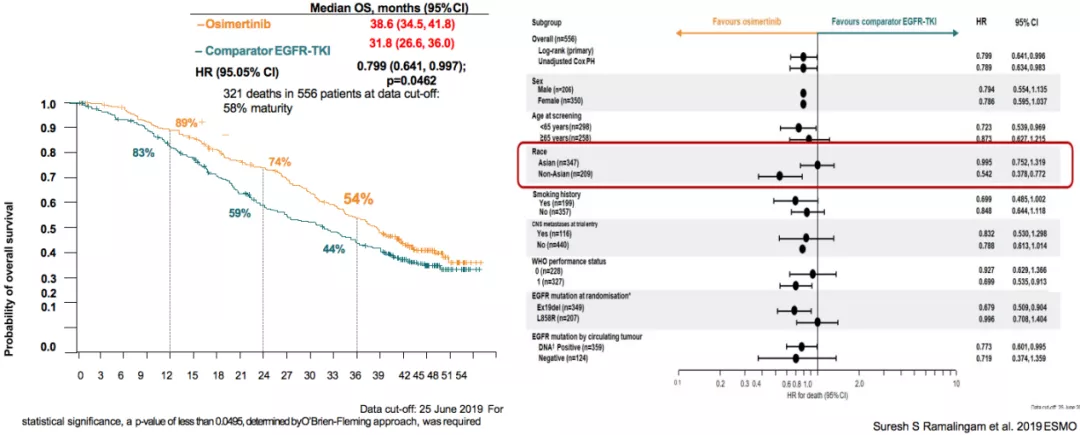
FLAURA研究的OS结果显示,一线使用奥西替尼的OS是38.5个月,而一代TKI是31.8个月。由此可见,如果把三代药物用于一线治疗,可以带来总生存的获益。
NEJ026研究:首个A+T一线治疗EGFR突变NSCLCIII期临床研究
我们再来讨论另外一种治疗方式,如果是两个好药放到一起,我们总会提出的问题就是1+1是否等于2或者是大于2 ?如果能够达成这样一个数学公式,我们就应该把这两种药物放到一起,尤其是1+1>2。这样的治疗方式就是所谓的A+T,就是在一线治疗使用EGFR TKI加上抗血管治疗,从机制上来说存在协同作用。
这是NEJ026研究,首个A+T一线治疗EGFR突变NSCLCIII期临床研究。
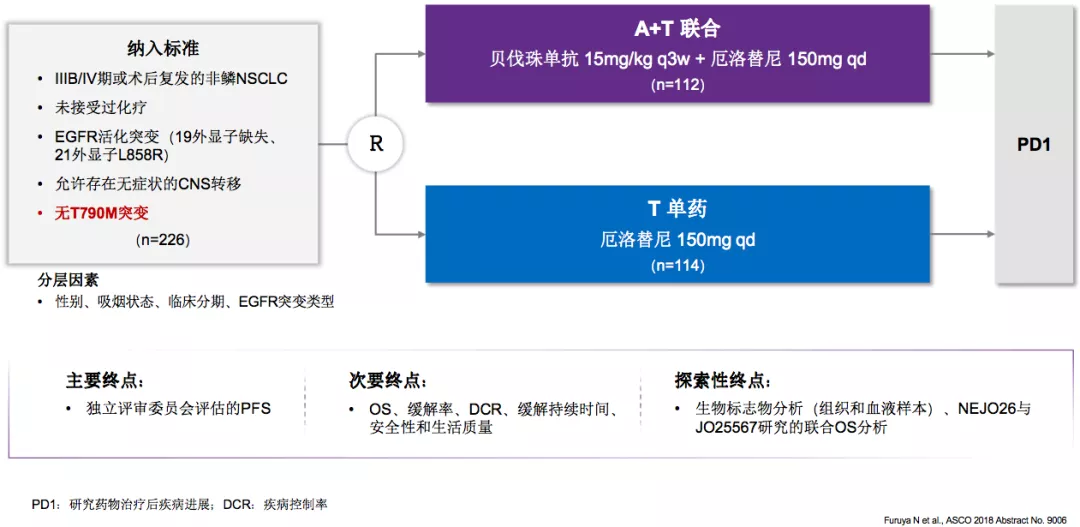
NEJ026研究:A+T组PFS显著提高
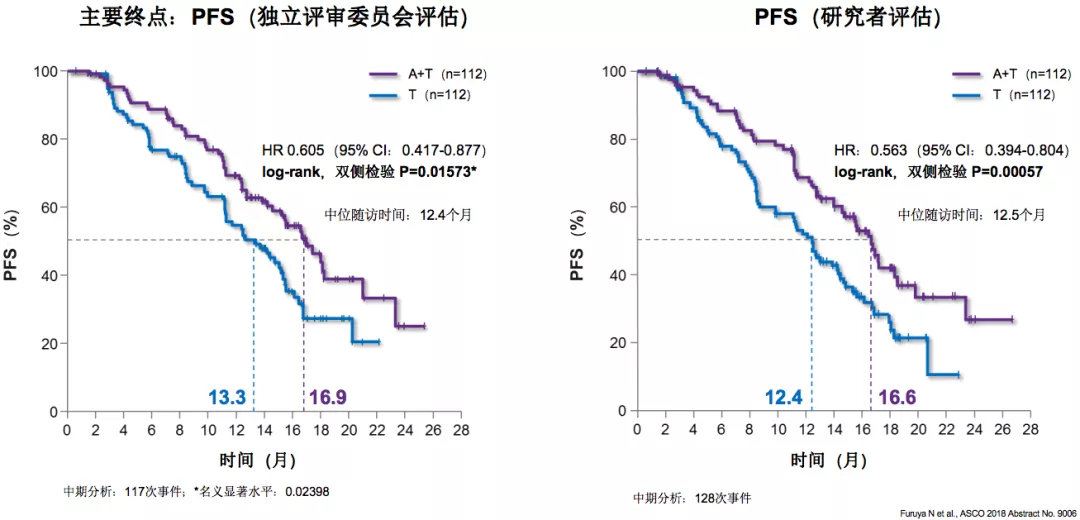
这个研究告诉我们,确实A+T的PFS要比单用靶向单药更好,独立评审委员会评估A+T组的PFS为16.9个月,T组为13.3个月,A+T组超越单药靶向3个多月的时间。我们期待这个研究能给我们更多的惊喜,比如A+T的方式能够带来总生存的改变,我们就会相信这个方式是有非常有生命力的,将来可能在规范化治疗中起着非常重要的作用。
NEJ026研究:不同EGFR突变类型亚组的PFS

如果把这两个突变的亚型分开,19外显子缺失和21外显子L858R分开,可以看到A+T模式在21外显子突变的病人获益更多。一直以来在TKI单药的治疗中,21外显子突变的疗效相对比较差,加上一个抗血管药物以后,反而比19外显子更好,这就有理由让我们相信A+T的模式,如果是21外显子突变,一线是否应该考虑A+T模式,我觉得这是非常有道理的。
ARTEMIS:贝伐珠单抗联合厄洛替尼一线治疗EGFR突变中国III研究
在中国的ARTEMIS研究和NEJ026研究非常相似,但有所不同的就是入组了中国的病人,我们中心也参加了这项临床研究。
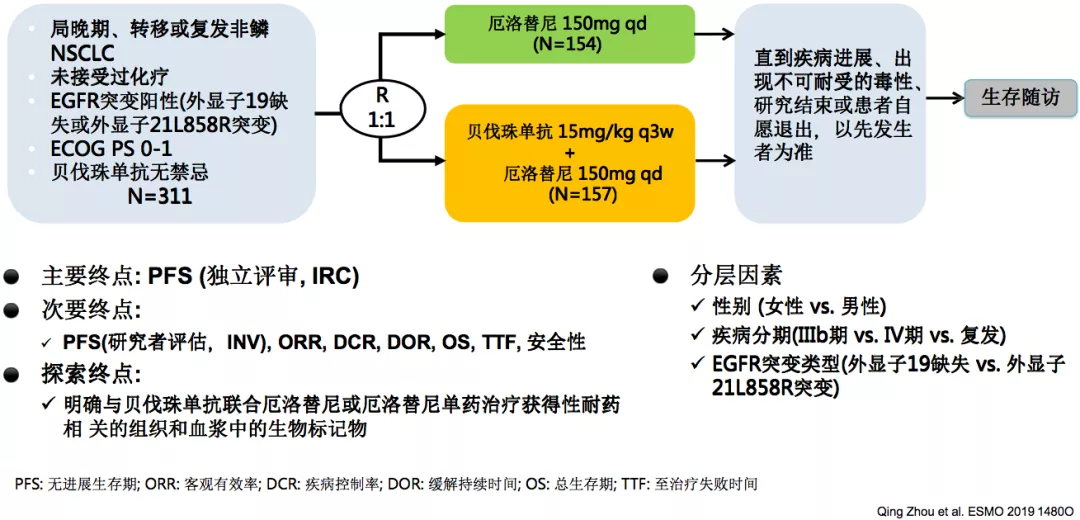
主要终点:独立评审PFS(ITT人群)

研究结果看上去比NEJ026的研究结果更好一些,A+T的中位PFS达到18个月,而且较对照组的PFS延长近7个月,疾病进展风险下降45%。
ARTEMIS:不同EGFR突变类型亚组PFS(ITT人群)
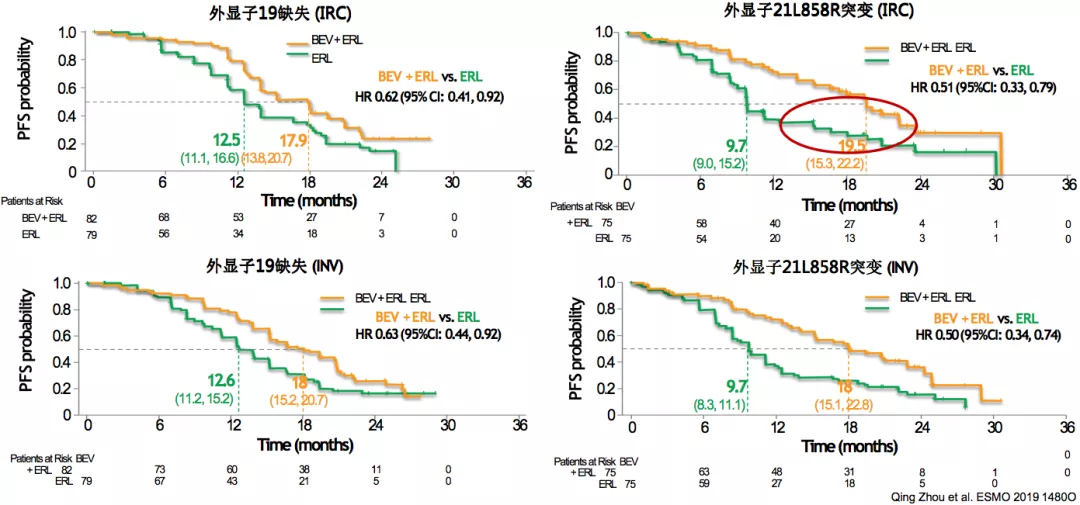
在此项研究中,我们看到了和NEJ026相似的趋势,21外显子突变的病人,获益更多。这两项研究都呈现了同样的结果,我们认为这是值得去关注的结果。
A+T显著提高21L858R患者PFS结果
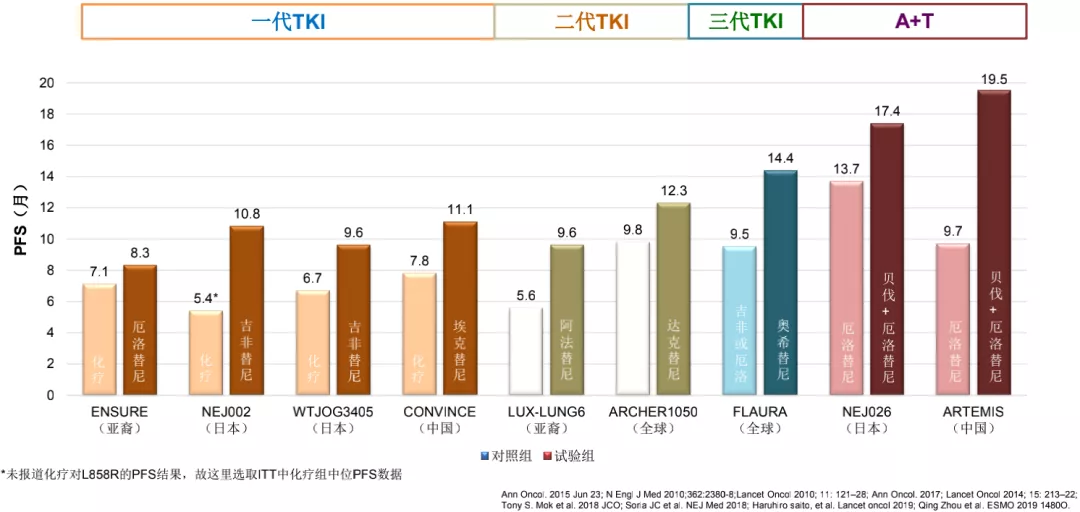
总体而言,把这些研究归纳到一起,我们可以看到A+T的模式显著提高21外显子突变患者的PFS。
CSCO指南:EGFR突变NSCLC患者治疗推荐

无论是多好的药物,它终将耐药,在一线靶向治疗耐药以后,CSCO指南这样推荐。首先,指南中把一线TKI耐药的模式分为三种进展模式,第一种叫局部进展,第二种叫缓慢进展,第三种叫快速进展。在这三种不同的方式里面指南都有不同的推荐,比如局部进展推荐继续EGFR-TKI治疗+局部治疗(2A类证据);如果是缓慢进展,也建议继续原EGFR-TKI治疗(2A类证据),但推荐一定要做T790检测,若呈阳性,就应该采用奥西替尼(1类证据);对于快速进展的病人,要及时进行T790检测,分为T790阳性和T790阴性两种情况。如果再进展以后,还是要考虑进一步的检测。
临床进展模式评估参考标准

缓慢进展型患者疾病控制较好,临床症状轻微,两种方案可供选择,维持原EGFR-TKI治疗,对于T790M患者可更换为三代EGFR-TKI(奥西替尼或已经上市或即将上市的三代药物)。
AURA系列研究逐步确立了奥希替尼的后线治疗地位

关于二线治疗循证医学证据还是挺多的,尤其是AURA系列的关于奥西替尼的研究,我们把这些研究证据归纳到一起,在二线使用奥西替尼的疗效几乎都超过60%以上,有些达到了70%。这是非常重要的一系列的临床研究结果,发表在《新英格兰医学杂志》和《柳叶刀》。
根据刚才提到的两个药物或者两个好的治疗方式叠加在一起,会相得益彰。沿着这个思路走下去,能否再加一个药物或者一种治疗方式,使结果好上加好。
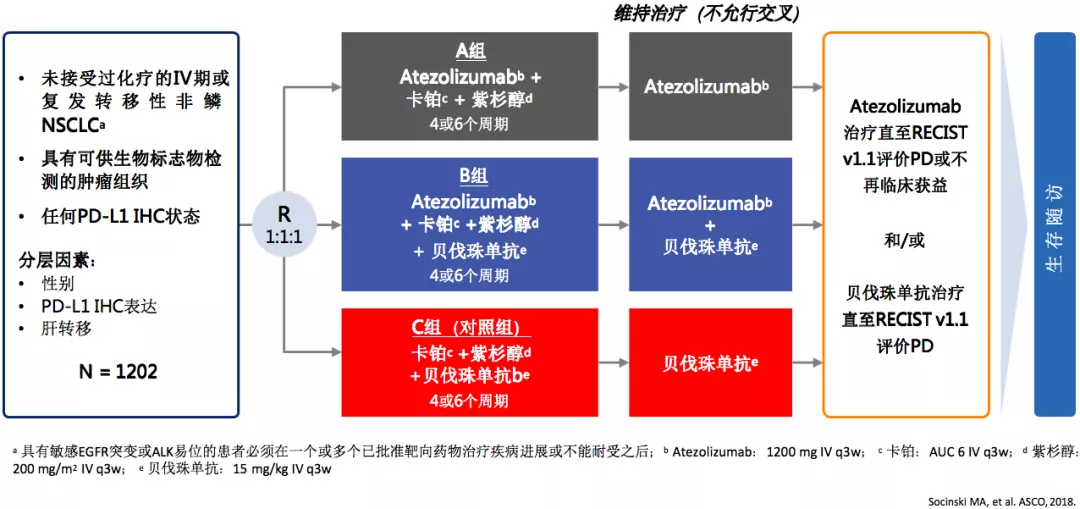
IMpower150研究:验证免疫治疗联合方案有效性与安全性
下面来看看IMpower150研究,如果化疗加上抗血管药物,再加上免疫治疗会不会更好。
EGFR/ALK+亚组数据:免疫治疗联合方案带来生存获益
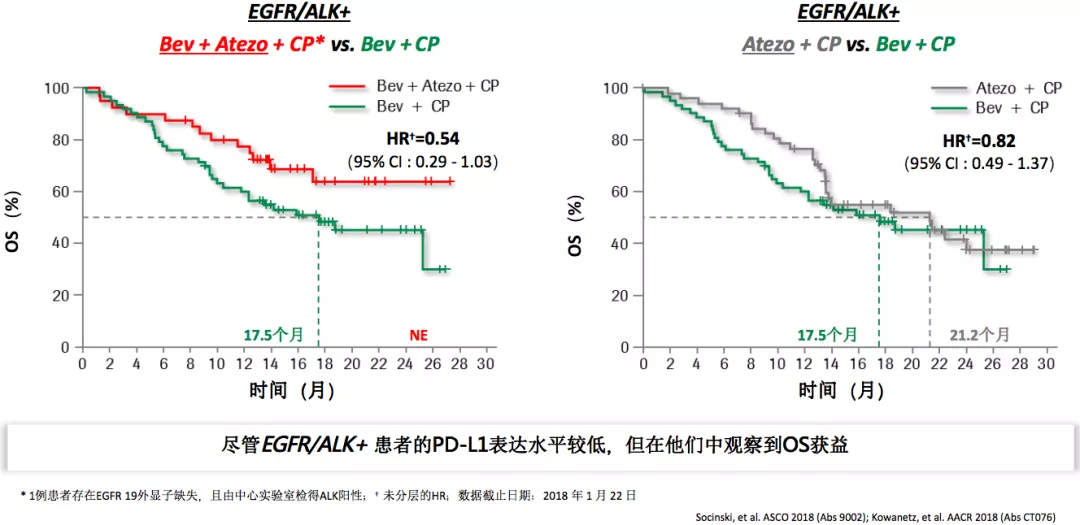
从这项研究中挑出来一组病人观察,即便是EGFR/ALK+的病人,抗血管药物加免疫治疗加化疗也是获益的。我们一定不会推荐驱动基因阳性的病人在一线使用免疫治疗或者加上抗血管药物、加上化疗。
但是这项研究给我们一些启示,如果驱动基因阳性的病人在TKI耐药以后,无论是一线、二线耐药以后,是否还有靶向、免疫或者化疗联合治疗的机会呢?我们觉得这个研究给我们很好的前瞻性的思考。
CSCO指南:EGFR突变NSCLC患者治疗推荐
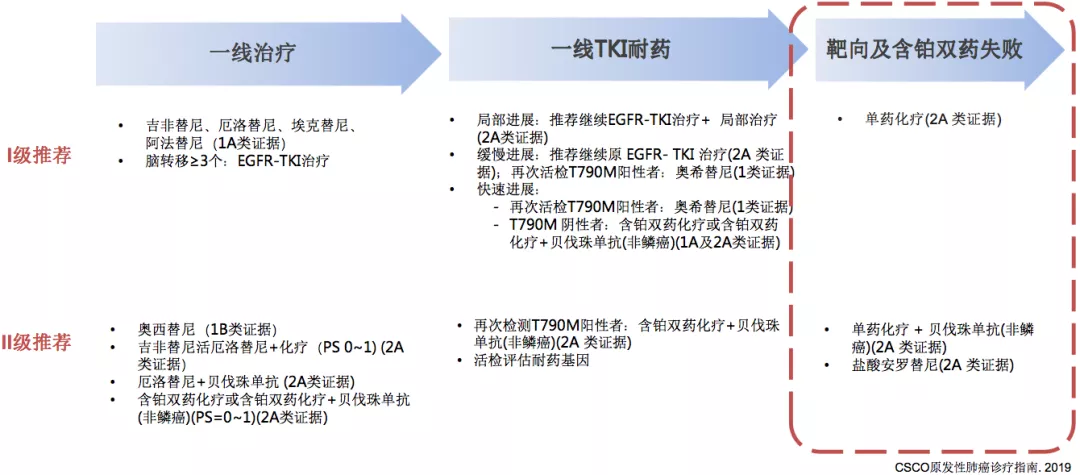
在一线耐药后,可以做相应的处理,接下来到了三线治疗怎么办?三线治疗的推荐非常单一,单药化疗(2A类证据);单药化疗+贝伐珠单抗(非鳞癌)(2A类证据)或者我们国内抗血管TKI 盐酸安罗替尼(2A类证据)。
ALTER0303研究:安罗替尼三线治疗晚期NSCLC可实现生存获益
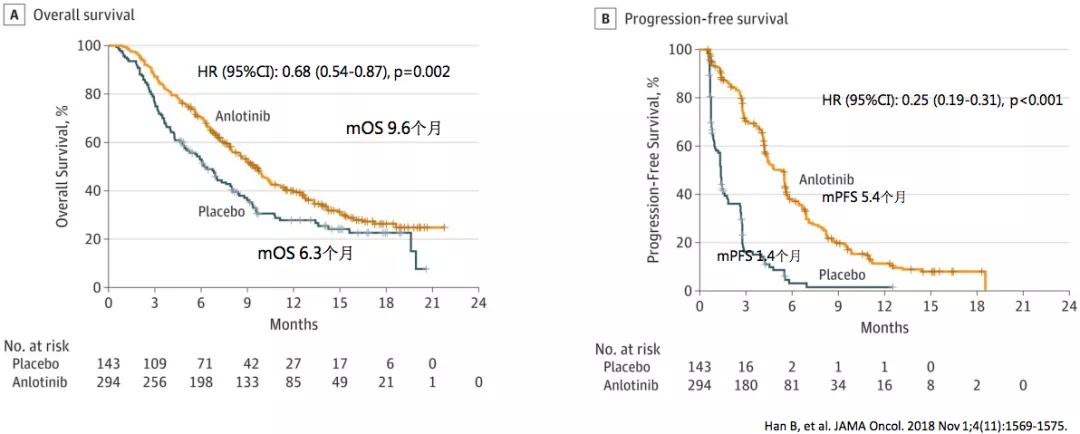
安罗替尼三线治疗的临床研究叫ALTER0303研究,这是多中心、双盲、随机化3期临床研究,纳入439例晚期NSCLC患者,至少接受1线化疗及TKI治疗后发生疾病进展的驱动基因阳性患者,以及接受至少2线化疗后进展的驱动基因阴性患者。受试者随机分为两组,分别接受安罗替尼(n=296)或安慰剂(n=143)治疗。在三线治疗中,安罗替尼和安慰剂相比,PFS和OS均明显获益,所以现在批准了非小细胞肺癌的三线治疗的适应症。
CSCO指南:ALK融合NSCLC患者治疗推荐

接下来我们讲另一个重要的驱动基因。对于EGFR突变的病人,我们说它是一个黄金突变,那么对于ALK融合的这部分病人来讲,我们把它俗称为钻石突变。因为这组病人,严格意义上讲,如果靶向治疗有效,他们已经迈进了慢性病的行列,因为多个研究包括真实世界的研究和一些回顾性研究表明,ALK融合阳性病人的部分中位OS已经超过7年。所以对于这部分病人来说,我们需要把这些病人挑选出来,并给予合适的治疗手段。因此,CSCO指南一线推荐阿来替尼(优先推荐)(1A类证据)、克唑替尼(1A类证据),二级推荐是含铂双药化疗或含铂双药化疗+贝伐珠单抗(非鳞癌)(2A类证据)。
一线方案选择:对于患者全程获益至关重要
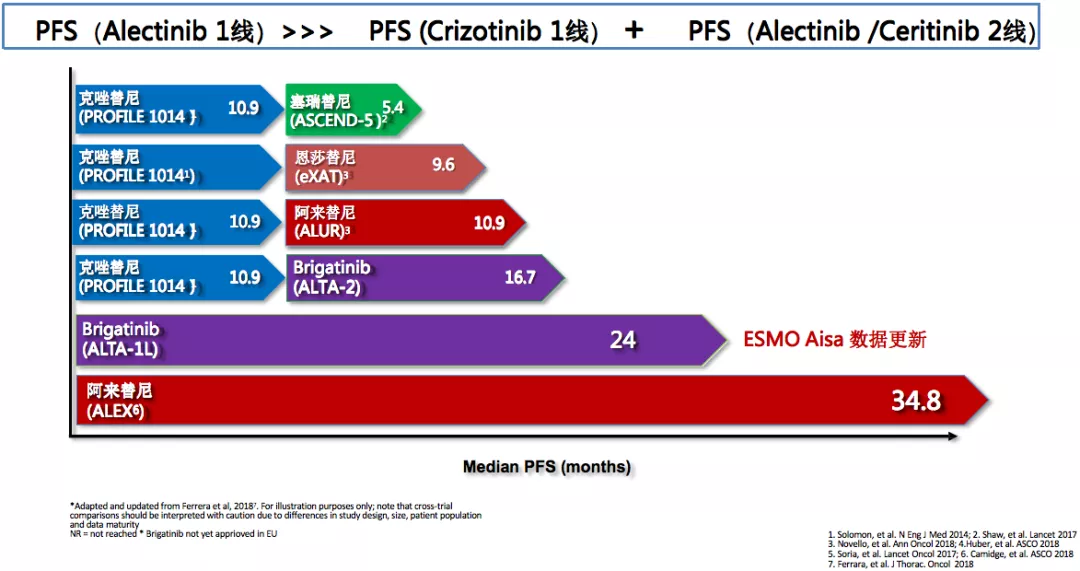
ALK融合虽然是一个小靶点,约5-6%的突变概率,但在药物研发上一点都不落后于EGFR,有很多的药物问世。如果把这些临床研究的数据归纳在一起,我们可以看到,无论是布吉替尼还是阿来替尼,二代的ALK TKI用于一线治疗,PFS获益更多。
克唑替尼治疗伴脑转移NSCLC疗效有限
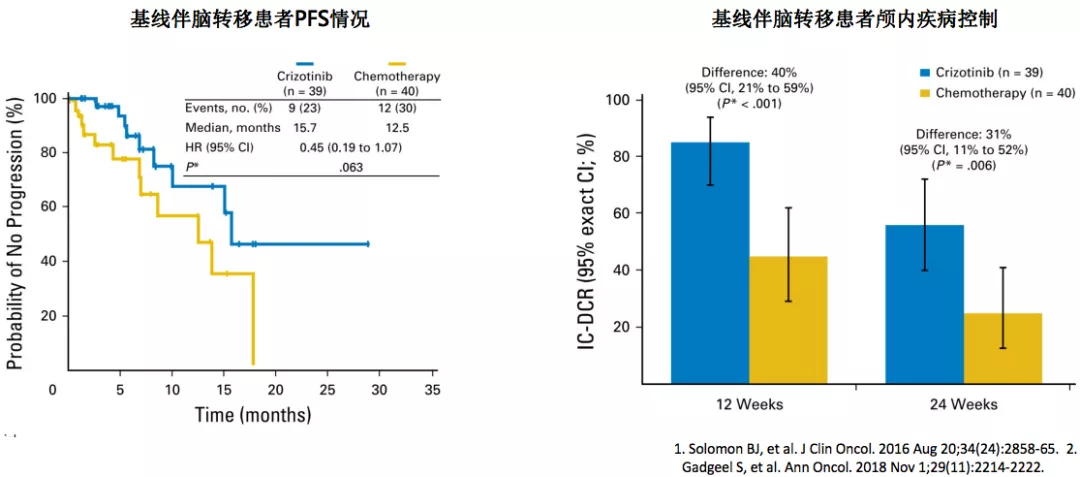
早先的临床研究告诉我们,在克唑替尼一枝独秀的年代,克唑替尼是当时唯一治疗ALK阳性病人的药物,因为没有其他的ALK抑制剂问世。但是经过这么多年,我们再把克唑替尼的一些重要的临床研究放到一起,和现在已经发表了新药物的临床研究来看,PROFILE-1014研究:相比化疗,克唑替尼可显著提高基线脑转移ALK+NSCLC患者颅内疾病控制率,但未能显著延长PFS。除此之外,克唑替尼治疗脑转移具有明显局限性:中枢神经系统组织穿透性差,且治疗后易发生耐药性突变。
ASCEND-4:塞瑞替尼对比化疗一线治疗脑转移疗效
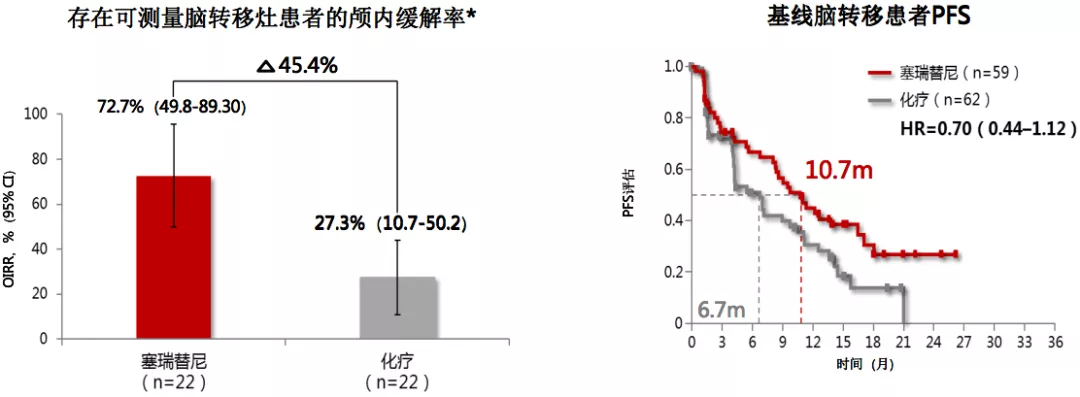
另一个二代药物的塞瑞替尼,和化疗一线治疗相比,治疗脑转移的疗效更好。但在临床研究中,40%以上塞瑞替尼治疗失败患者以脑转移为首发,这就给我们提出更高的要求,我们希望无论是一代或者二代药物都应该有很好的脑组织的浓度、脑脊液的浓度,对脑转移有很好的抑制作用。
ALEX:研究者评估的PFS
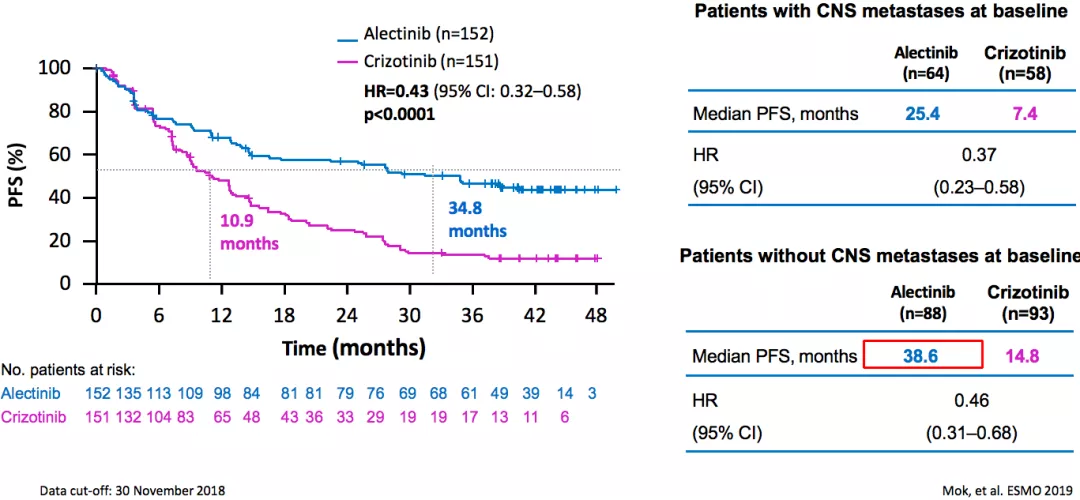
ALEX研究是阿来替尼的重要的临床研究。研究者评估的PFS,阿来替尼组为34.8个月,和对照组的10.9个月相比超越了太多。
阿来替尼 vs 克唑替尼:进一步降低总体/CNS进展风险
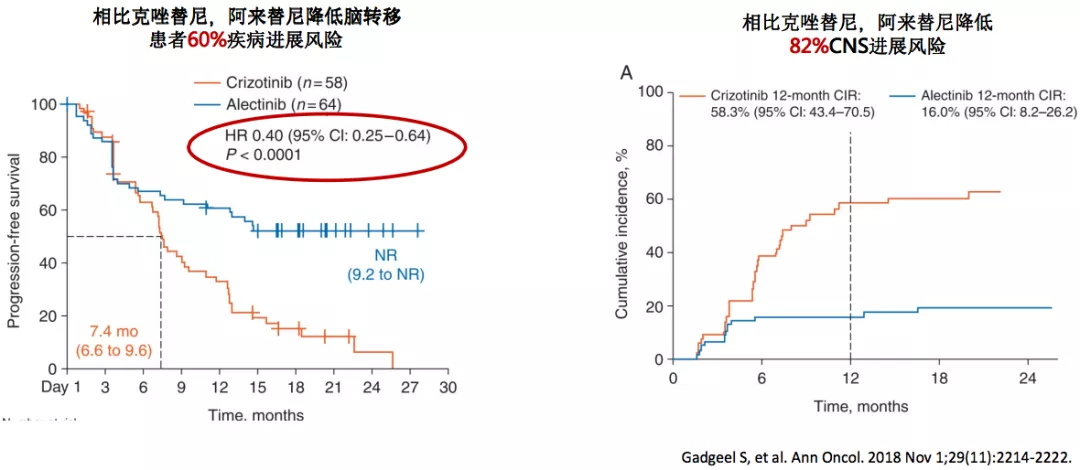
如果一个药物能很好的控制脑转移,它就可能会降低脑转移的风险。在ALEX研究中,阿来替尼和克唑替尼相比,阿来替尼能够降低脑转移患者的疾病进展风险。
2020 ASCO:ALEX-首个ALK-TKI间头对头做出OS明显获益的研究
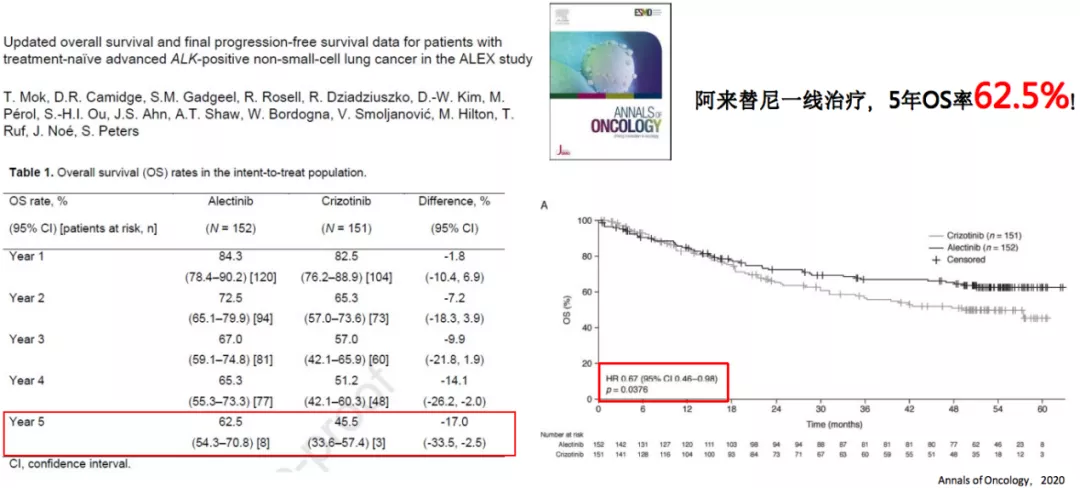
这是将要在今年的ASCO年会进行口头报告的一项重要结果,就是ALEX-首个ALK-TKI间头对头做出OS明显获益的研究。这个研究结果告诉我们,阿来替尼用于一线治疗,5年OS率达到62.5%。也就是如果一线治疗使用阿来替尼,5年以后还有62.5%的病人存活,而对照组克唑替尼的5年OS率为45.5%,阿来替尼高于克唑替尼将近20%,这是非常巨大的跨越。
ALESIA研究:亚裔人群中证实阿来替尼疗效优于克唑替尼
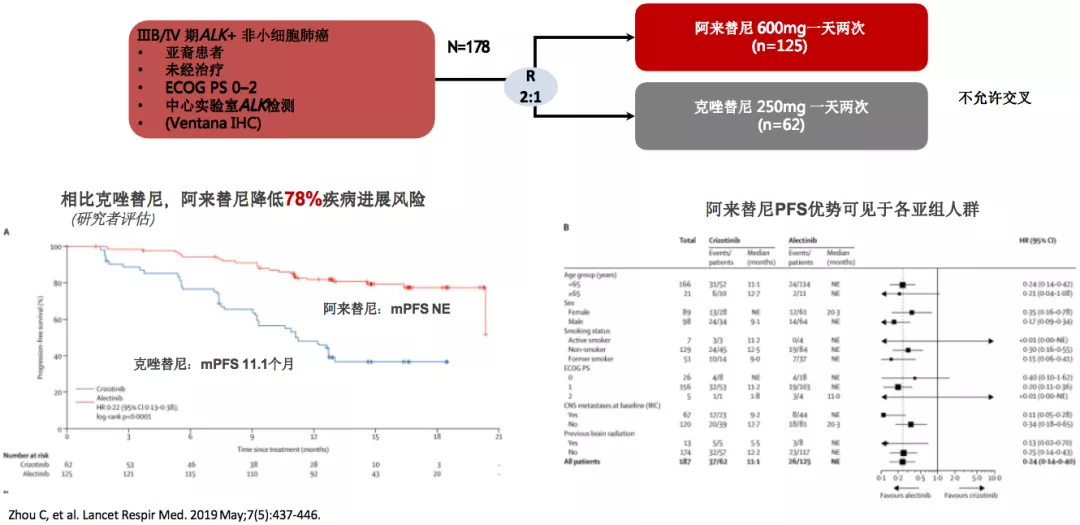
一项对于ALK融合亚裔人群的ALESIA研究。在这项研究数据首次公布的时候,阿来替尼的中位PFS还未公布,但克唑替尼为11.1个月。我相信我们也能够看到类似ALEX研究的趋势,具体数据要等待研究结果。
ALTA-1L回顾性数据:Brigatinib对比克唑替尼在亚裔和非亚裔人群中的疗效比较
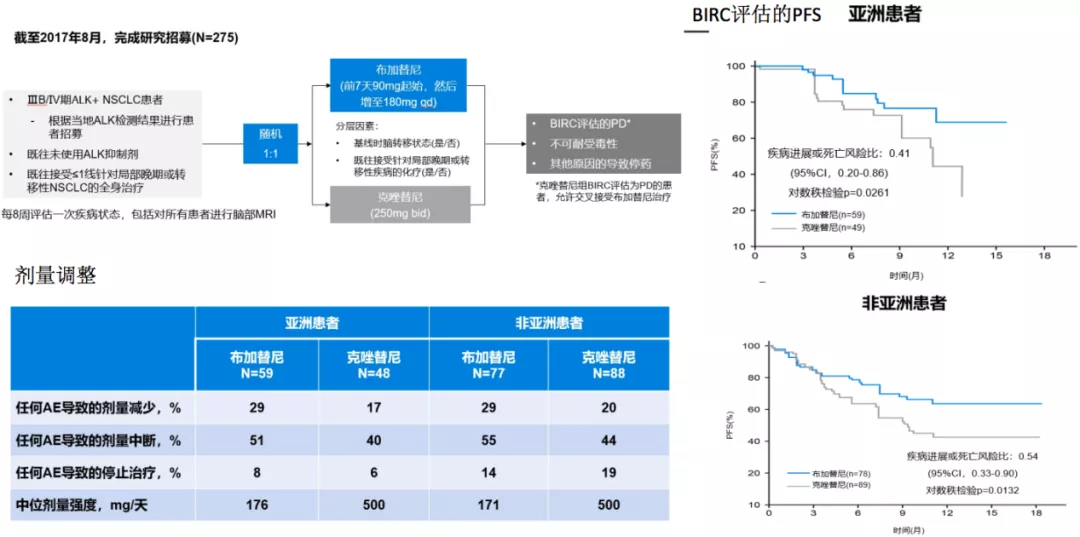
还有一个二代药物叫做Brigatinib,Brigatinib近期刚刚被FDA批准为ALK融合患者的一线治疗,总体而言,药物的丰富性给医生提供了更多的选择的可能性。
CSCO指南:ALK融合NSCLC患者治疗推荐
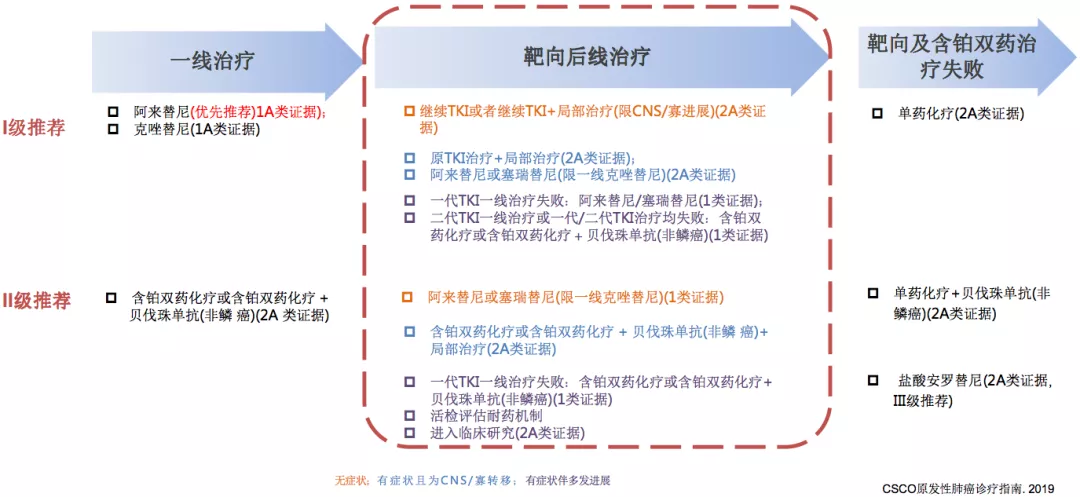
ALK-TKI耐药后应该如何处理,在CSCO指南中第一个推荐的就是继续TKI或者继续TKI+局部治疗(限CNS/寡进展)(2A类证据),这是对于靶向治疗后进展的病人。还有其他方式,比如换用其他的二代药物。
ALK-TKI和EGFR-TKI在这方面不同:
第一个不同,如果一代的EGFR-TKI失败以后,理论上讲不应该再换二代的EGFR-TKI治疗;
第二个不同,现在我们已知的EGFR-TKI基本上它们非常相似,但是已经上市的或者将要上市的其他二代的ALK-TKI,它们之间是不一样的。这就给我们提出更高的要求,在一线靶向治疗以后,我们更应该知道ALK阳性病人的耐药机制。如果一线使用的就是二代药物,耐药后我们应该鼓励做进一步的NGS检测,来知道确切的耐药机制,再去选择后线治疗药物,因为这些药物之间的耐药位点往往是不交叉的。下面我们来看一看相关的临床研究。
ALUR研究:数据更新结果(二线治疗)
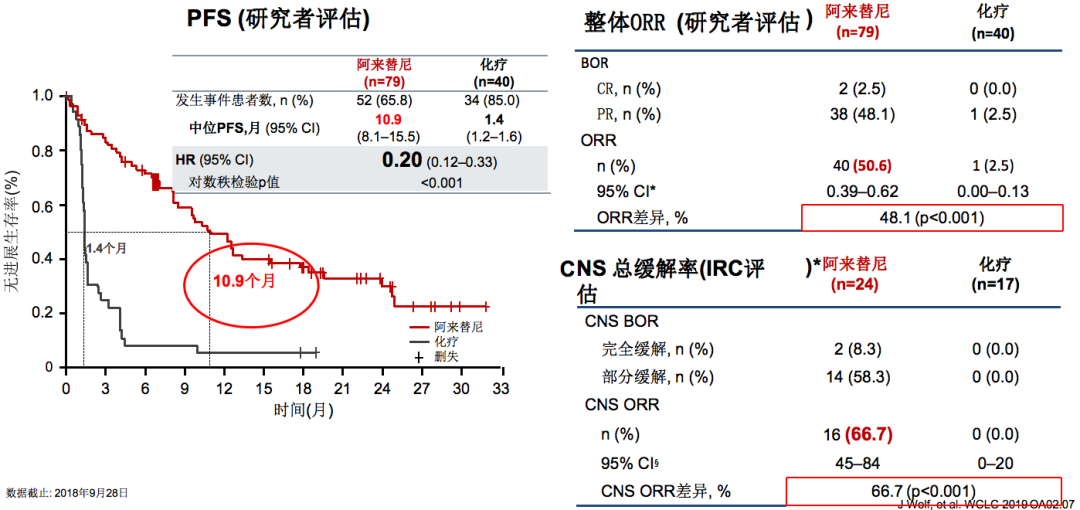
在ALUR研究(二线治疗)中,一线治疗如果使用的不是阿来替尼,一线进展以后,二线以后使用阿来替尼的中位PFS为10.9个月,这是一个很不错的结果。
阿来替尼二线治疗OS数据更新
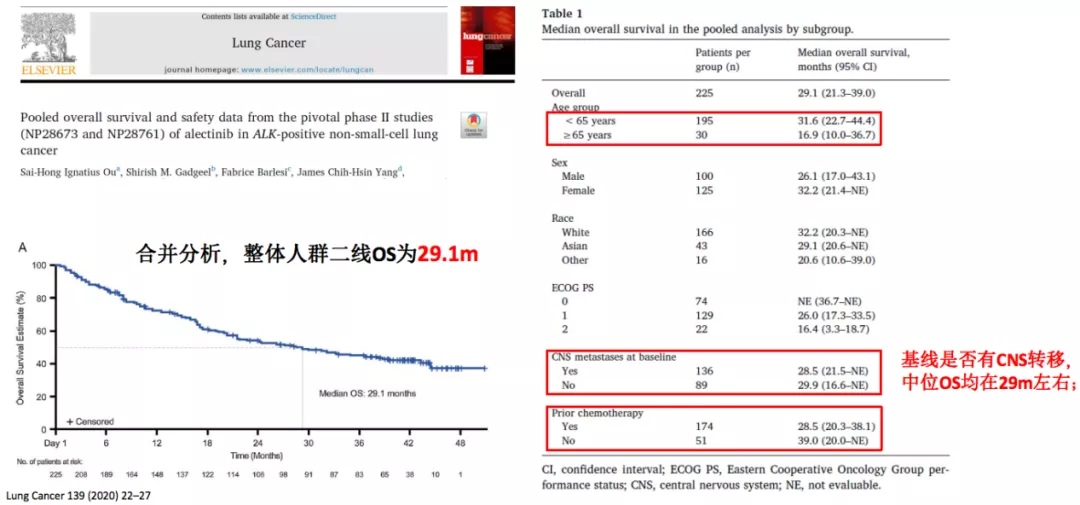
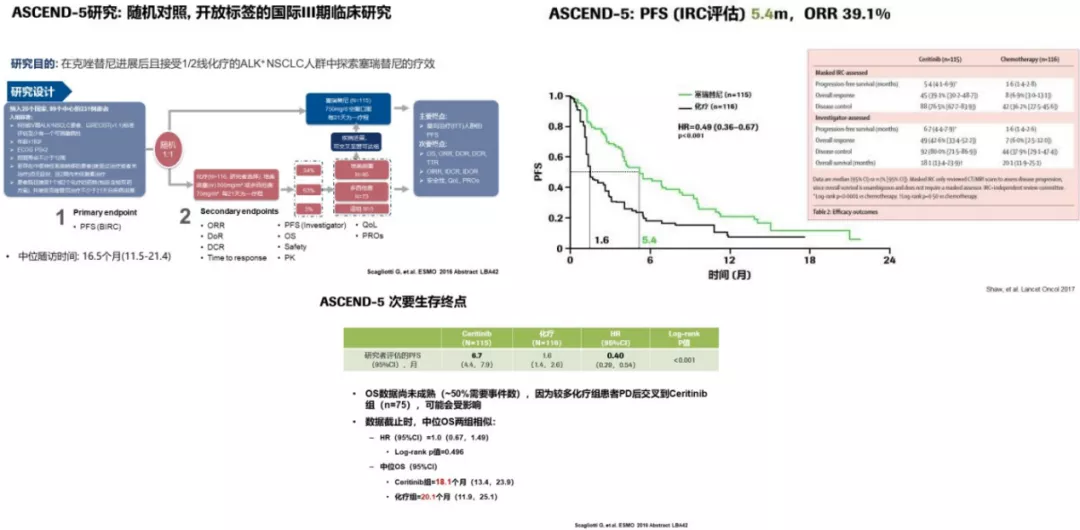
ASCEND-5研究:
一项有关塞瑞替尼的研究,我们同样可以看到了塞瑞替尼的中位OS也达到了18.1个月。
到了三线治疗以后,严格意义上讲和EGFR-TKI的治疗非常相似,比如单药化疗,单药化疗加上抗血管或者是加上其他药物。
CSCO指南:ROS1融合NSCLC患者治疗推荐
接下来是另外一个驱动基因,ROS1。ROS1大概占NSCLC的1-1.5%,大家千万不要小看这1~1.5%,对于中国人群来说,它就是一个相对比较庞大的数字。如果把这部分病人检测出来,病人会有非常好的生存获益,甚至会比其他的靶点有更好的生存获益。CSCO指南对于ROS1的推荐是这样,一线治疗的一级推荐克唑替尼(1类证据),二级推荐仍然是化疗或者联合抗血管。
二线治疗中,如果ROS1病人在一线使用克唑替尼进展以后,根据它的进展模式来做一些处理,比如局部进展进行局部处理,如果是系统的缓慢进展或者快速进展,就需要使用一些新的药物,但这些药物目前未在中国上市。
三线治疗以后,实际上就是单药化疗或者单药加上抗血管,这样的病人也鼓励参加新药的临床研究。目前在中国现在开展了很多的临床研究,尤其是这些少见的靶点,一方面为这些新的药物提供了很好的临床医学证据,同时也给这些病人带来了生存的机会。
克唑替尼用于ROS1融合NSCLC疗效初步获得证实
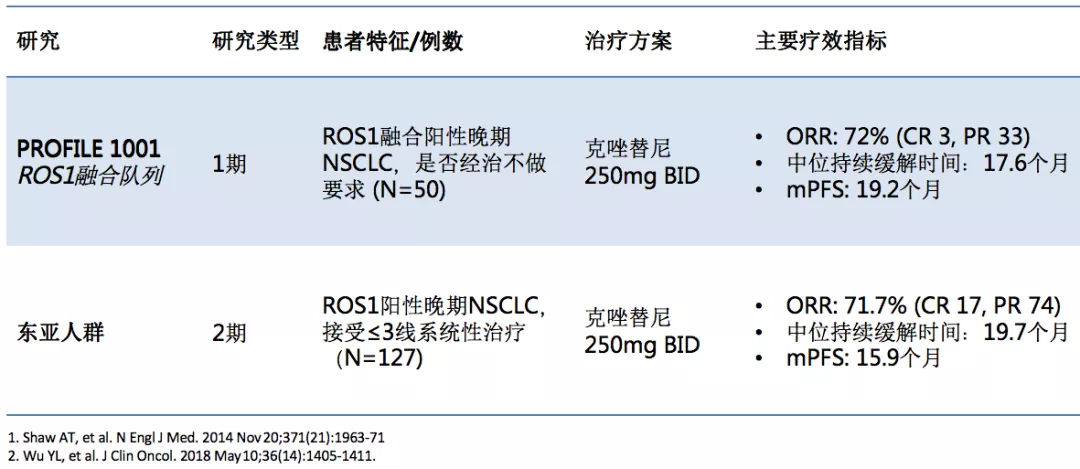
这是两项有关ROS1的重要的临床研究,第一个是PROFILE 1001 ROS1融合队列研究,1001研究是一项大型ALK和ROS1的研究,其中有一组病人是ROS1阳性的病人,ORR为72%,mPFS为19.2个月,这要比克唑替尼在ALK融合的病人表现更好一些。第二项研究是东亚人群,结果非常相似,ORR为71.1%,mPFS为15.9个月,接近16个月。总体而言,ROS1阳性的病人的一线治疗靶向治疗,克唑替尼是首选。
CSCO指南驱动基因阳性NSCLC
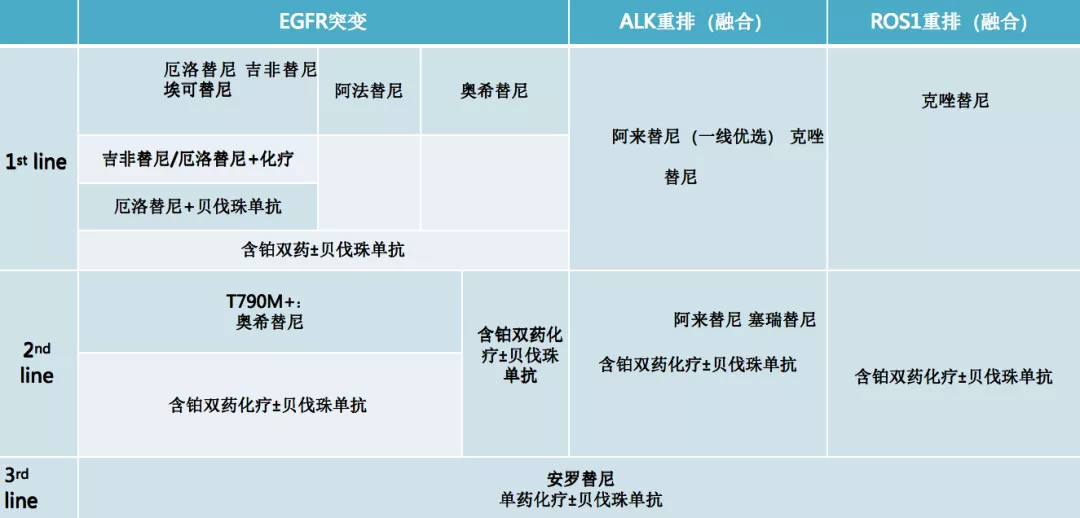
把CSCO指南中关于驱动基因阳性的非小细胞肺癌治疗进行总结,基本上这样来理解,在一线治疗上无一例外,都是推荐靶向治疗,至于靶向治疗怎么去组合,对于EGFR来说,选择1+3还是3放在前面,还是2+3,都有不同的选择。对于ALK来说,推荐了不同的靶向药物,比如阿来替尼、克唑替尼,还有一些其他的ALK抑制剂。对于ROS1,现在推荐克唑替尼。
在二线治疗中,实际上是根据病情来做相应的选择。对于三线治疗来说,格意义上讲三线没有非常好的标准治疗,比如化疗加上抗血管、化疗单药或者是抗血管的TKI(比如安罗替尼)的治疗,都可以作为推荐。
总体而言,驱动基因阳性的非小细胞肺癌,经过这些年的发展,无论是诊断这类病人的准确性、精确度以及药物的丰富性,都带来了革命性的变化,极大的改善了驱动阳性病人的生活质量和生存,这是我们所希望的。接下去需要努力的目标是要把这部分病人带进慢性化的行列。
总结
NSCLC的个体化诊疗日趋精细化,针对驱动基因类型进行规范治疗是实现临床获益最大化的重要基础;相关循证不断积累,持续推动了驱动基因阳性患者规范诊疗体系的更新。
EGFR突变患者
-一线治疗仍以一代/二代TKI为主,A+T方案成为一线新选择;
-三代TKI奥西替尼为T790M耐药突变的标准治疗方案;
-安罗替尼成为三线治疗新选择;
ALK融合患者
-阿来替尼以显著治疗优势取代了克唑替尼一线治疗标准方案;
-克唑替尼一线治疗失败,二线治疗以阿来替尼/塞瑞替尼治疗为主;
-Brigatinib等新型ALK-TKI有望为ALK融合患者提供更多治疗选择;
ROS1融合患者
-目前一线TKI仅推荐克唑替尼,靶向治疗选择较为有限;
-Entrectinib、Lorlatinib等TKI已在现有临床研究中显现出突破性进展,有望为此类患者提供更多治疗选择。
答疑与讨论
陈闽江:第一个问题,因为目前肺癌的治疗过程中也逐渐进入了一个精准治疗的时代,如何对病人选择个体化的更有效的方案越来越重要。我们作为呼吸科大夫或者肿瘤科大夫,做肺癌这方面为自己专业方向的大夫,其实更多的时候也借助于多学科的力量,采用多学科协作的方式来进行精准化治疗的选择。请问在您所在的医院对于科室以及整个医院之间开展MDT和多学科的建设方面,有哪些经验可以跟我们呼吸界的同道们分享?
宋勇:我们是比较早期在国内开展肺癌的MDT,大概在2004年就开始MDT多学科门诊。这么多年下来,我认为MDT方式尤其是在肿瘤领域里面,在中国得到了长足的进步。而且现在中国也有相应的指南和专家共识,在各个瘤种都得到了普遍的应用。
个人认为MDT确实会给病人带来更多的益处,主要在这几个方面,第一,每一个专业、每个医生的知识存在局限性,应该大家在一起对一个复杂的病例进行讨论。比如相对比较简单的一个小结节,实际上关于小结节也需要MDT,小结节现在是否存在风险,有风险的话是否进行手术,做手术采用什么样的方式去做,在手术以后,是否进行术后的随访以及治疗。
第二,从多学科的角度来分析病人的病情,就会给病人带来更科学、更合理的处理方式。我经常和进行MDT的教授在一起讨论,他们会提出一些问题,虽然是一个好的想法,但在具体运行过程中就不一定很顺畅,问题出在哪里?我觉得问题可能在于互相之间没有形成紧密的联系,存在专业的理解上的一些偏差,要确定好目标,一切都是为病人着想,这样的话,MDT会做得更好。
接下来就是MDT流程的问题,如何优化流程,如何对需要做MDT的病人进行讨论。我们现在分成两方面,一方面就是我们每周一下午进行MDT多学科门诊,面对面和病人在讨论、解决问题;另一方面,我们医院每个月可能会有1-2次的MDT学术讨论,学术讨论的内容可能是现实的病例,也可能是学科的进展,包括各个学科的新进展的经验分享和信息交流。在这一方面只要形成一个很好的模式,长期坚持下来,团队的合作就会越来越紧密,对病人的贡献也会越来越大。
陈闽江:近些年的靶向治疗给病人带来了很好的生存的预后,现在针对中国人最常见的EGFR突变位点来说,一代药物和三代药物相比可以看出三代药物在PFS上取得了比较好的优势。一代药物、二代药物和三代药物都已经进入了临床,一代药物只有9~11个月的PFS,在ARCHER研究中发现二代药物(达克替尼)的中位PFS能达到16个月,这与三代药物达到18.9个月相差已经非常短暂了。您在临床工作中,如何选择这几种药物的使用,您有什么建议?
宋勇:这个问题在不同的场合经常被大家提出来讨论,实际上如果我把大家的观点进行归纳,基本上可以这样理解。
第一,在三代药物并存的这样一个时代,无论使用哪一代药物用于一线治疗都是正确的。
第二,考虑两个因素,第一个因素就是所谓的药物可行性,由于不同的药物进入医保的时间、价格或者其他方面,可能会制约了病人的使用和选择;第二个因素就是我们现在已经发表的循证医学证据,到底给我们临床医生带来怎样的临床选择的信心。有些医生认为,仍然愿意从一代药物开始,一旦进展后,去选择三代药物,对于那些驱动基因阴性的病人选择其他治疗;也有些医生认为,二代药物的临床研究表明,它的PFS是相对比较长的,所以宁可从二代药物开始,所谓的2+3模式,这就是1+3、2+3;还有些医生认为,病人的经济条件好,而且病人也有需求,也可以使用三代药物用于一线治疗开始。
根据我的临床经验或者选择来看,使用三代药物用于一线治疗没有问题,二代药物用于一线治疗也没有问题。但是如果是病人在在诊断时出现了脑转移或者是脑膜转移的病人,或者是疾病负荷相对比较重的病人,我会把治疗顺序从二代或者是从三代药物一线治疗开始。总体而言,这个问题到目前为止是没有标准答案的。
陈闽江:其实还是要根据个体化来选择药物。在您的临床工作中会对怎样的病人选择A+T或者化疗联合靶向治疗呢?
宋勇:我们现在确实有一部分病人选择A+T模式或者化疗联合靶向治疗。如果在一线治疗前检测出是21外显子突变,我们可能会更多地考虑A+T模式。如果病人在一线治疗前,他的肿瘤负荷相对比较重,并且PS评分相对比较好,对生存的期望值相对较高,也可以考虑化疗联合TKI治疗。因为这些临床研究都告诉我们,和单药靶向治疗相比,都可能会带来PFS获益,有些研究是OS的获益。但不是所有的病人都采用这样的模式,要因人而异。
陈闽江:在这些临床研究的数据中看到,A+T或者化疗联合靶向治疗的方式并没有改变一代或者二代药物的耐药谱。在耐药监测方面,您如何看待应用血液的动态监测评估病人出现TKI的进展?血液优于影像的进展在临床实践中,有哪些意义以及提示?
宋勇:我认为采用外周血进行肿瘤的分子检测是一个不错的方法。
第一,这是一项无创操作,只需抽血;第二,可以是实时的、动态的。唯一的缺点是可能不如组织突变的丰度那么高,比如取肿瘤组织和外周血时,往往组织突变的丰度会高一些。但是外周血有一个好处,它克服了肿瘤瘤间的抑制性,可能释放出来的CTC是全肿瘤的信息。
总体而言,液态活检,问题在于如何使用好,第一,如果将来的检测敏感性进一步提高,会不会在这一点上取代所谓组织活检,这种可能性是存在的。当然,对于组织病理诊断,包括其他的信息分析,需要组织活检。第二,什么时候使用、如何使用,我们现在是这样选择的,如果是一个非常小的肿瘤负荷,能够拿到组织标本,尽量去做组织标本;对于一个肿瘤负荷相对较重,取组织非常困难,比如进展以后两肺弥漫性的转移,找不到一个合适的病灶进行穿刺,这时候液态活检的可能性就会更大一些。
有关血液优于影像学的进展,实际上是这样的。一些临床研究表明,液态活检可能会比影像学更早,包括耐药基因的出现,比如T790M突变等。但这并不意味着现在就要改变指南说一旦出现T790M突变,即便是影像学没有进展,也应该改方案去换药,因为现在没有足够的循证医学证据,仍然是基于目前的循证医学证据、基于我们目前的认识,所以指南推荐我们基于影像学的分析,我个人仍然是这样的观点。将来有可能会随着研究的进展改变,比如依靠液态活检来做治疗的选择。
陈闽江:液体活检是一个重要的检测指标,也是临床的参考,但是目前阶段治疗选择还是基于影像学的结果。现在有了三代药物,对于T790m突变的病人,有些是原发性的T790m突变,也有些病人是一代TKI耐药之后的T790m突变。对于这两类T790m突变可能具有有不同的意义,想请教您,原发性和耐药的获得性的T790m在治疗反应上和后续耐药机制上有哪些不同?
宋勇:严格意义上讲,目前还没有非常确定的答案,但是我可以谈谈我的看法。对于原发性T790m突变的病人,如果一线采用三代TKI治疗,往往PFS不一定会非常长。为什么到了一代TKI耐药后出现的T790m突变,再去做三代奥西替尼的治疗,它的二线PFS相对较长。可能是从肿瘤进化的角度不一样,因为继发性的T790m突变是在一代TKI压力之下所带来的这些改变;另外,从肿瘤的抑制性角度上来讲,一代TKI失败以后,出现的T790m的相对的突变丰度可能会更高一点。但不论原发性T790m还是继发的T790m,只要发生T790m突变,就应该考虑基于针对T790m的TKI,奥西替尼是一个非常好的选择,也包括其他的三代TKI。
陈闽江:现在随着分子检测技术的推进,我们也意识到EGFR突变是一大组突变病人的总和。除了单一突变的病人,也有些在临床中碰到EGFR位点的复合突变或者少见突变,比如861Q突变、719X突变等,针对这些复合突变或者少见突变的病人,您在治疗上有什么建议?
宋勇:随着检测的进步,我们就发现了越来越多的所谓的罕见突变、复合突变,复合突变可以是两个、三个或者更多。这样的结果便于我们理解病人对于EGFR-TKI治疗的反应性不同,以前我们不能理解,同样是EGFR突变的病人,为什么这个病人的PFS长,而另一个病人的PFS非常短,现在至少我们能够部分理解不同的原因在哪里。比如PFS较短的这些病人,可能一部分是合并突变的病人,可以合并TP53、合并MET或者合并BRAF等,也有非常少的病人既有EGFR突变,又有ALK融合,往往这样的病人,使用单一TKI治疗的PFS非常有限,所以我们就需要在这群病人里面做到精准选药。对于这些罕见突变,无论是达克替尼还是阿法替尼这种二代TKI具有优势。对于合并突变,比如合并TP53等,这些病人除了使用TKI治疗的传统模式以外,还可以考虑联合治疗,比如联合化疗、联合抗血管治疗,往往不仅会改善PFS,更有可能会改善它的总生存。因此,我们认为随着检测的进步,我们对病人的治疗也越来越精细了。
陈闽江:刚才您提到在临床工作中,会看到少许病人同时合并EGFR基因突变和ALK融合基因,对于这些病人在治疗上您是如何选择的?
宋勇:既有EGFR突变,又有ALK融合,这个比例大概在2-3%,这是一个小概率事件。但是一旦出现后,我们在治疗上就面临选择,使用哪个TKI作为一线治疗,或者是否考虑两个药物联合治疗。现在没有确定的标准,以前做过一些研究,进行过一些尝试,比如观察磷酸化水平,谁的磷酸化水平高,就选择什么。现在即便有了NGS以后,利用丰度来选择也不一定完全正确,但会给我们一些提示,比如我们做了NGS以后,发现EGFR的丰度明显高,而ALK融合的丰度相对低,我们就应该把EGFR-TKI用于一线治疗,当然反过来也是成立的。我看到的一些个案以及一些回顾性病例,现在越来越多的是把两个药物联合在一起同时使用。总体而言,指南、专家共识都没有特别明确的推荐,但是我觉得根据检测的信息来做选择具有一定的道理。
陈闽江:现在TKI联合化疗和联合抗血管生成治疗的数据都是来自于一代和二代药物,针对三代TKI(即奥西替尼)的联合治疗上,您有什么建议和经验吗?
宋勇:已经发表的三代药物联合治疗的循证医学证据非常少,甚至没有大型的临床研究结果。我们在临床的二线、三线治疗,比如二线T790M阳性的病人经过奥西替尼治疗以后,看上去他缓慢进展了,由于病人治疗的可选择性不多,我们就在不停用奥西替尼的基础上,如果病人PS状况好,可以加上化疗或者是加上抗血管生成药物,加上一个药物变成一个新的治疗组合以后,病情又得到了一定程度的控制,而且病人病情稳定的时间不错。我个人是基于二线、三线治疗,如果把三代药物用于一线治疗和化疗或抗血管联合,我个人还是希望更多临床研究能够给我们一些证据。
陈闽江:目前阿来替尼用于一线治疗取得了非常好的PFS,达到38个月,已经远远优于了克唑替尼这个一代药物,所以阿来替尼也在临床中被越来越多的医生作为一线治疗的选择。可否请您谈一谈,阿来替尼作为一线治疗,它的耐药机制以及如何克服阿来替尼的耐药?
宋勇:虽然阿来替尼上市的时间不长,但它在早期的临床研究,包括耐药机制的研究,都做了很多工作,我们对阿来替尼有相当多的了解。关于阿来替尼耐药以后的机制,目前在二代测序的时代,我们知道它有很多确定的耐药位点,这些位点一部分是对另外一些二代药物敏感,比如阿来替尼耐药以后,再使用Brigatinib,有些病人如果是特定位点,明显获益。还有一个所谓的一代和二代药物目前的终结者叫做劳拉替尼,耐药以后劳拉替尼目前几乎可以一网打尽。但问题在于,如果劳拉替尼耐药以后,肿瘤变得越来越复杂,往往肿瘤进化的脚步比我们追赶它的脚步还快一点。在劳拉替尼耐药以后出现了多个位点的变化,这时候我们是否能设计一个或者一组新的药物来对付这些新的突变位点,尤其是多位点,这是我们面临的挑战。
陈闽江:其实我们看到PFS越长的这些靶向药物,治疗强度越强的靶向药物,后续的耐药机制也相对更加复杂。所以目前在多学术讨论中有一种争论,是否应该先从抑制力比较弱的克唑替尼开始,后线再选用阿来替尼。针对这个问题,您在临床中是如何选择ALK抑制剂的排兵布阵的?
宋勇:有关ALK抑制剂的排兵布阵,我认为对于中国的临床医生来说,永远要考虑两个问题,第一个就是可行性,主要考虑这个药物有没有给中国获批,是不是能拿到,病人能否承受药物的价格;第二个就是安全性,我们希望安全的药物能够给病人带来更好的生活质量的改善;第三个是临床研究的数据,能够给病人带来多长的生存期,这些决定了用药的选择。目前我们的临床实践,都会使用一代药物、二代药物。就像刚才提到三代EGFR-TKI,如果是有脑转移或者有脑膜转移的病人,我们更多的会考虑二代药物,尤其是考虑阿来替尼,这时候即便是病人经济状况受限,我们也会把这个药物推荐给他,让他来做选择。因为确实阿来替尼对脑转移的疗效比一代药物更好。
陈闽江:您刚才提到阿来替尼对脑膜转移有它独到的优势,针对ALK阳性的病人出现脑膜转移,在治疗方面您还有其他的建议吗?
宋勇:脑膜转移是一个非常独特且棘手的临床问题,我相信每个临床医生遇到这样的病人都会觉得非常困难,因为脑膜转移直接带来的问题有以下几点,第一,进展快;第二,病人脑功能的影响非常明显;第三,会出现明显的临床症状;第四,生存时间非常短。如何让这样的病人在当下的治疗时代的生存期更长,我觉得第一点是选择一个具有高活性的药物;第二点就是做好局部处理,比如如何降低颅压高的病人;第三点,近些年我们在尝试做局部治疗,比如通过脑脊液给药,可以在脑脊液中给一些化疗药物,比如给予腺癌的病人非常小剂量的培美曲塞,大多数病人都取得了非常好的疗效,对于一些顽固性的颅压增高的病人,还可以做一些让脑脊液能够很好地被取出来或者被引流出来的装置,也能够很好的缓解症状。总体上讲,我认为脑膜转移的病人仍然是临床上最难解决的一个问题。
陈闽江:如果应用ALK抑制剂的病人在用药的过程中出现了药物的不良反应,导致肺间质纤维化,这时候应该如何处理?是应该换用其他的ALK抑制剂、停药换用化疗,还是加用激素处理肺间质纤维化的同时继续运用ALK抑制剂?您有什么建议?
宋勇:首先要和大家说的是,作为一个呼吸科医生,第一,我们看到出现肺间质病变并不害怕,因为我们整天都和肺间质病变打交道,大家都很熟悉;第二,分析肺纤维化的严重程度,现在免疫治疗时代也是这样,我们把肺间质病变也分成一、二、三、四级,同样我觉得也适用于靶向药物带来的一些肺损害。这时不管肺纤维化是轻还是重,首先应该把药停下来做观察;其次,根据病情的严重程度来决定是否使用激素,或者是其他的抗纤维化治疗,有两个抗肺纤维化的药物在中国已经上市。问题在于如果病人用非常有效,出现肺纤维化,病人又没有其他的治疗,将来怎么办?在肺纤维化得到控制以后,原来的药物能否使用?我个人觉得如果是比较轻的一二级的肺间质改变,可以考虑用回来,我觉得没有绝对的禁忌症,因为这时候就需要权衡利弊。如果这个药物对病人至关重要,只有这个药才能挽救他的生命,我们应该尝试把药用过来。
在不同的ALK-TKI甚至在EGFR-TKI之间做切换,会不会减轻病情?比如这个药物可以出现肺间质改变,而另外一个药可能在这个病人上不会出现,没有办法回答这个问题,但是我觉得应该根据病人的严重程度,如果是三四级的病人,千辛万苦把他抢救回来,这时候不应该再考虑TKI治疗,甚至包括换药,我个人也是不主张,这时候就要面对现实,换用其他的治疗或者甚至完全没有办法,那也只能是姑息治疗。
陈闽江:最后一个关于靶点的问题,靶向药物联合抗血管生成治疗或者联合化疗更多的提及于EGFR-TKI的联合治疗中。对于ALK抑制剂,因为二代药物本身可以达到一个很好的PFS和疗效,所以也较少提到联合治疗治疗的问题。您对ALK抑制剂的联合化疗或者联合抗血管生成治疗这一类的治疗方案,有怎样的建议或者我们在临床工作中有什么可以探索的方向吗?
宋勇:这确实是一个非常好的问题,也是一个值得大家讨论和思考的话题,同样也是一个非常好的研究思路。大家一定会问为什么EGFR有这样的研究,但ALK没有?
我认为有两个方面原因,第一,从历史的角度来看,EGFR这类药物问世较早,尤其是一代药物的优点和缺点都很明显,所以我们要去弥补它的缺陷,在这个地方就加上了联合治疗,尤其是在最早靶向药物开始研发的时候,它就是和化疗在一起,只不过那时候没有选择病人,没有看到阳性结果。后来发现突变是疗效的关键因素,所以之后的临床研究都做出了阳性结果。
第二,为什么ALK没有太多的联合治疗的临床研究?因为ALK钻石突变的病人生存时间很长,使用一代药物后一段时间,再进展后加上二代药物,病人的生存期都很长,所以就比较少的想到联合治疗。但这是否意味着ALK融合的病人就不需要联合治疗?我觉得有可能需要,也许这样的病人加上了联合治疗,他的生存可能会更好,但是目前我个人观点应该是放在二线或三线治疗,不一定放在一线治疗。如果是探索性的研究,在一线把一个ALK抑制剂加上抗血管或者加上化疗,我认为是很好的思路,但是作为临床实践来说,还要等待很相当一段时间。
陈闽江:最后一个问题关于免疫治疗,也是您刚才提到的IMpower150研究。在真实世界中,针对这些基因突变阳性的病人在靶向治疗进展之后,化疗肯定是一个需要考虑的选择。您在临床过程中对我们的选择有什么推荐?是化疗联合免疫、化疗联合抗血管还是化疗联合免疫加抗血管,像IMpower150研究一样采取一个四联的方案,请您向我们介绍一下您的经验,可以吗?
宋勇:随着靶向治疗的不断进展,尤其是使用过三代药物,无论是EGFR和ALK TKI耐药以后的病人所面临的现实问题,如果可以挽救病人,我们应该怎么做?现在最新的研究成果,免疫治疗对这些病人来说,还有没有机会使用,我觉得确实是要回答这个问题。IMpower150研究不在于它本身,这项研究结果会对这部分病人有非常好的参考价值。如果我来做选择题,无论是EGFR或者ALK,一代药物或者二代药物放在一线,或者三代药物放在一线,进展以后再用靶向药物,再进展以后,首先我会考虑化疗,其次在这个基础上我会考虑联合抗血管,如果PS评分好,可以化疗联合抗血管,这时候是否加入免疫治疗,我认为如果有条件我不排斥。如果在这时候不使用化疗和抗血管治疗,仅仅使用免疫单抗单药的治疗,我个人不主张,获益的可能性相对较小。我们需要做的是加法,让它们在机制上相互协同、相互补充,比如免疫和抗血管是互补的;化疗可以让新抗原得到更多的释放,对免疫治疗有一定的促进。所以我个人认为,如果病人的经济状况许可,PS评分又好,我宁可把抗血管、化疗和免疫加到一起,尤其是出现肝转移的病人,我更倾向于三种治疗方式的联合。
参考文献
[1]Ashely J.Vargars,Nature Review Cancer 2106;16:525-537
[2]Forde PM, et al. Expert Rev Anticancer Ther. 2013 June ; 13(6): 745–758
[3]Aisner DL, et al. Clin Cancer Res. 2018 Mar 1;24(5):1038-1047
[4]Gridelli C, et al. J Clin Oncol. 2012 Aug 20;30(24):3002-11.
[5]Mok TS, et al. N Engl J Med 2009;361:947-57
[6]John A, et al. ASCO 2019, e20015
[7]CSCO原发性肺癌诊疗指南.2019
[8]Herbst RS, et al. Nature. 2018 Jan 24;553(7689):446-454.
[9]Zhou C, et al. Lancet Oncol. 2011 Aug;12(8):735-42.
[10]Planchard D, et al. Lancet Oncol. 2017 Oct;18(10):1307-1316
[11]Drilon A, et al. N Engl J Med. 2018 Feb 22;378(8):731-739
[12]Demitri G, et al. ESMO 2018
[13]Socinski, et al. ASCO 2018 (Abs 9002);
[14]Qing Zhou et al. ESMO 2019 1480O
[15]Lee VHF, et al. Clin Oncol (R Coll Radiol). 2020 Jan;32(1):e1-e9.
[16]ClinicalTrials.gov:http://clinicaltrials.gov/ct2/show/NCT01174721
[17]Tony Mok , et al. ASCO 2017 Abstract No. LBA9007
[18]Zhou Q,et al. Presented at CSCO 2017
[19]Tony S. Mok et al. 2018 JCO
[20]Ramalingam et al ESMO 2017
[21]Byoung chul cho et al. 2017 ESMO ASIAN
[22]Soria JC et al. NEJ Med 2018
[23]Suresh S Ramalingam et al. 2019 ESMO
[24]Furuya N et al., ASCO 2018 Abstract No. 9006
[25]Ann Oncol. 2015 Jun 23
[26]N Engl J Med 2010;362:2380-8
[27]Lancet Oncol 2014; 15: 213–22
[28]Janne PA, et al. N Engl J Med. 2015 Apr 30;372(18):1689-99.
[29]Yang JC, et al. J Clin Oncol. 2017 Apr 20;35(12):1288-1296.
[30]Goss G, et al. Lancet Oncol. 2016 Dec;17(12):1643-1652.
[31]Mok TS, et al. N Engl J Med. 2017 Feb 16;376(7):629-640.
[32]Mok TS, et al. 2017 ASCO Abstract 9005.
[33]Han B, et al. JAMA Oncol. 2018 Nov 1;4(11):1569-1575.
[34]Solomon, et al. N Eng J Med 2014
[35]Shaw, et al. Lancet 2017
[36]Novello, et al. Ann Oncol 2018
[37]Huber, et al. ASCO 2018
[38]Camidge, et al. ASCO 2018
[39]Ferrara, et al. J Thorac. Oncol 2018
[40]Gadgeel S, et al. Ann Oncol. 2018 Nov 1;29(11):2214-2222.
[41]Certinib FDA review, 2014
[42]Data cut-off: 30 November 2018
[43]Mok, et al. ESMO 2019
[44]Annals of Oncology,2020
[45]Lung Cancer 139 (2020) 22–27
[46]Shaw AT, et al. N Engl J Med. 2014 Nov 20;371(21):1963-71
[47]Wu YL, et al. J Clin Oncol. 2018 May 10;36(14):1405-1411.
专家介绍

宋勇
东部战区总医院呼吸与危重症医学科主任、肺癌中心主任、南京大学呼吸病学研究所所长;专业技术三级、中央军委保健委员会会诊专家;南京大学、南方医科大学、第二军医大学、南京医科大学博士研究生导师;解放军医学会呼吸内科专业委员会副主任委员;中华医学会呼吸分会全国委员(中华医学会呼吸分会肺癌学组委员);江苏省医学会呼吸病分会副主任委员兼肺癌学组组长;南京医学会呼吸分会主任委员;中国临床肿瘤协会(CSCO)理事、中国抗癌协会肺癌专业委员会常委;《Translational Lung Cancer Research》杂志(PubMed、SCI收录)主编、《中华医学杂志》编委、《医学研究生学报》副主编等国内外学术期刊编委等。


