临床资料
患者男,53 岁,因「咳嗽、咯血、发热 1 个月余」于 2017 年 10 月 18 日收入复旦大学附属中山医院呼吸科。
患者于 2017 年 9 月初受凉后出现阵发性咳嗽、咳痰,初为黄黏痰,1 d 后为棕红色血痰,伴发热,体温最高达 39 ℃。就诊于当地医院,查血红蛋白(Hb)114 g/L,白细胞计数(WBC)10.05×109 /L,中性粒细胞百分比 88.6%;C 反应蛋白(CRP)218.3 mg/L,降钙素原(PCT)0.12 ng/mL;白蛋白(ALB)33 g/L,钠(Na+)138 mmol/L,钾(K+)3.41 mmol/L,尿素氮(BUN)6.7 mmol/L,肌酐(Cr)51.7 µmol/L,多次痰涂片找抗酸杆菌(–),结核杆菌(TB)DNA(–),半乳甘露聚糖抗原试验(GM 试验)、β-D-葡聚糖试验(G 试验)结果均为阴性。2017 年 9 月 12 日查胸部 CT,报告「右肺上下叶炎症伴右肺上叶多发空洞形成」。先后予左氧氟沙星+头孢他啶、哌拉西林/他唑巴坦治疗,效果差,病情逐渐加重。病程期间痰培养发现黑曲霉,于 2017 年 9 月 18 日及 21 日分别行支气管镜检查和经皮肺穿刺,肺组织活检病理报告右肺上叶炎症性改变,肺泡组织部分萎陷,间质纤维组织增生伴纤维化,部分透明变性,局部呈肉芽肿性炎,部分肺泡腔内见较多纤维素性坏死组织伴较多急、慢性炎细胞浸润,抗酸染色(–)、阿尔辛蓝过碘酸希夫染色(–);肺泡灌洗液 GM 试验 2.4(+)。当地医院临床诊断「侵袭性肺曲霉病(IPA)」,加用伏立康唑静脉应用,1 d 后因「全身瘙痒伴红色皮疹」停用,治疗方案调整为米卡芬净+美罗培南。患者仍反复发热、大咯血。2017 年 10 月 12 日复查胸部 CT,结果示右肺上下叶病灶较前明显进展,左肺上叶尖后段新发少许炎性改变。持续米卡芬净治疗无效,2017 年 10 月 18 日患者为进一步诊治转入我科。
发病以来,患者神志清,夜间睡眠较差,逐渐出现纳差,体重 1 个月内减轻约 5 kg。患者患强直性脊柱炎 20 余年,曾药物治疗(具体不详);近几年病情稳定,停用药物 1 年以上;平素活动、进食少,消瘦,身高 163 cm,体重 40 kg。
体格检查:T 38 ℃,P 98 次/min,R 22 次/min,BP 126/68 mm Hg(1 mm Hg=0.133 kPa),体重 35 kg,SpO2 98.5%,全身浅表淋巴结未触及肿大,双肺闻及散在湿啰音,心脏、腹部检查未见异常。
入院化验及辅助检查:血常规:Hb 110 g/L,WBC 3.14×109/L,中性粒细胞计数(N)11.2×109/L,总淋巴细胞计数(TLC)1.0×109/L;血沉(ESR)73 mm/1 h;CRP 90.5 mg/L;PCT 0.14 ng/mL;前白蛋白(PA)0.1 g/L,ALB 28 g/L;BUN 3.7 mmol/L,Cr 34 µmol/L;电解质:Na+ 132 mmol/L,K+ 4.3 mmol/L;肝功能、出凝血功能、心肌酶谱、肿瘤标志物均正常;中性粒细胞胞浆抗体(核周型)阳性,抗核抗体颗粒 1∶100,HLA-B27 阳性;细胞免疫检查示 Th 淋巴细胞计数、CD4+/CD8+基本正常;呼吸道病原体 9 联检(嗜肺军团菌、肺炎支原体、Q 热支原体、肺炎衣原体、腺病毒、呼吸道合孢病毒、甲型流感病毒、乙型流感病毒、副流感病毒)、Tspot、痰涂片(抗酸、细菌)、痰培养(结核、细菌)均无异常。痰真菌培养(+),后多次查痰培养、痰涂片提示黑曲霉,GM 试验阳性。
临床诊断
(1)急性侵袭性肺曲霉病(AIPA),合并细菌感染不除外;(2)强直性脊柱炎(稳定期)。
继续给予卡泊芬净 50 mg 1 次/d(qd)、美罗培南 1 g 每 8 h 1次(q8h,3 d 后停用),止血(包括垂体后叶素、氨甲苯酸等),以及强化营养支持(包括补充白蛋白、间断输注悬浮红细胞、增加进食、补充电解质和水溶性维生素)等治疗。
患者在上述方案治疗下仍反复发热、大咯血,咳嗽、咳痰未缓解。2017 年 10 月 25 日(图 1a~c)复查胸部 CT,提示肺部病灶进展。自入院至 2017 年 11 月 6 日,Hb、ALB、BUN、Cr 持续降低,其中 Hb 最低降至 89 g/L,ALB 降至 31 g/L,BUN 最低降至 3.2 mmol/L,Cr 最低降至 21 µmol/L;血钾最低降至 2.5 mmol/L(表 1)。11 月 8 日(图 1d~f)复查胸部 CT,提示肺部病灶进展,右肺上叶实变伴空洞形成,两肺散在渗出性病变,左肺新出现渗出病灶,考虑可能合并细菌感染,在原有方案基础上加用抗细菌治疗,疗程为 10 d。
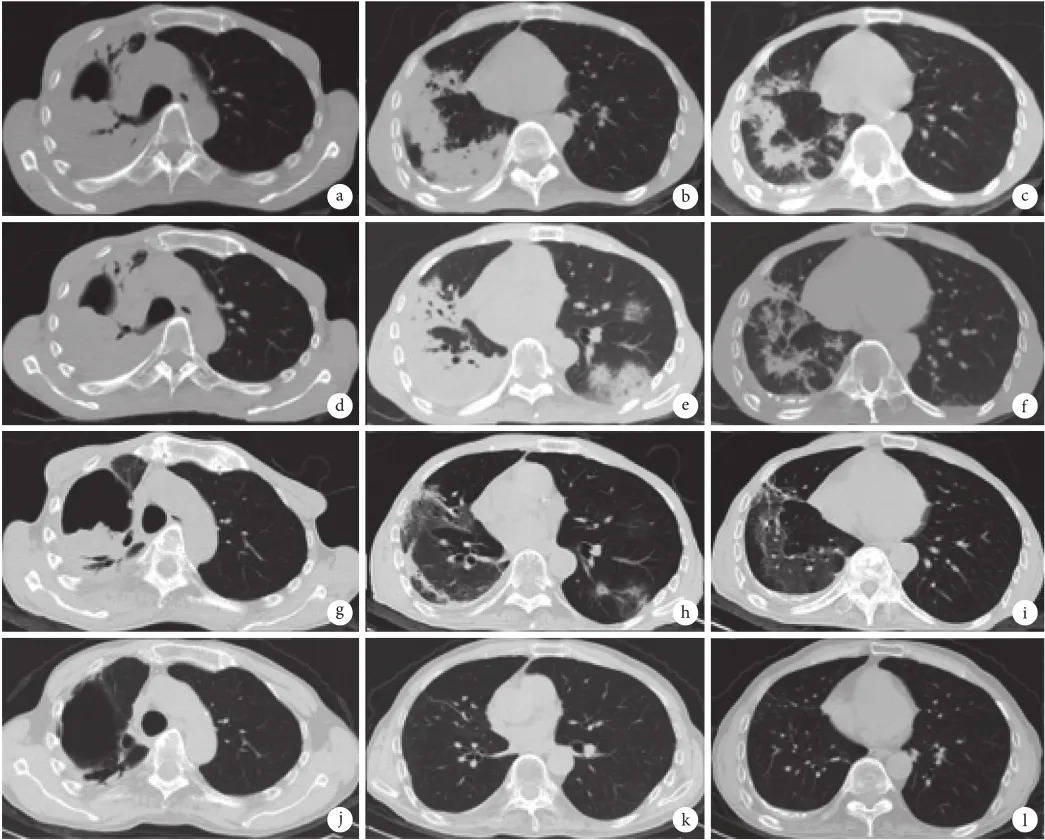
图1:胸部 CT 检查像
a~c. 2017 年 10 月 25 日。右肺上、下叶实变影伴空洞形成。d~f. 2017 年 11 月 8 日。右肺实变影增多,左肺新出现渗出病灶。g~i. 2017 年 11 月 21 日。双肺病灶有明显吸收。j~l. 2018 年 11 月 21 日。双肺炎症吸收,余少许陈旧灶,右上肺大疱,皮下脂肪较前明显增加。a、d、g、h. 上肺野;b、e、h、k. 中肺野;c、f、i、l. 下肺野。
表1:实验室检查指标和皮下脂肪厚度变化
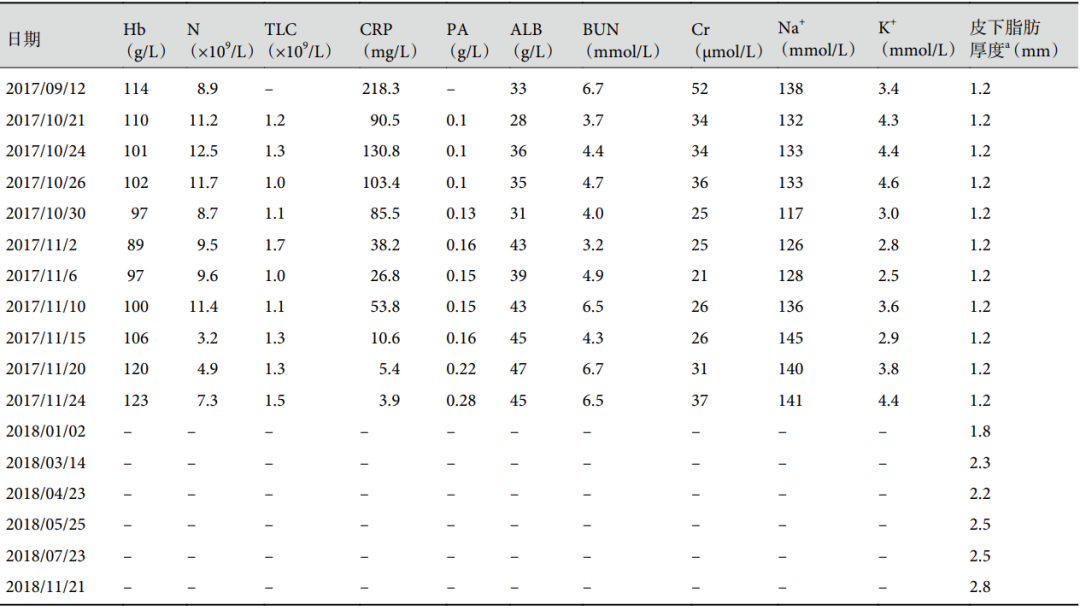
a:皮下脂肪厚度经胸部 CT 于第四肋下缘前正中线处测得
在持续抗真菌、抗细菌、止血、强化营养支持治疗后,患者自 11 月 10 日起,Hb、PA、ALB、BUN、Cr 均逐渐回升,低钾血症逐渐纠正。自 11 月 13 日起体温降至正常,咳嗽、咳痰较前减轻,仅偶有少量咯血。11 月 16 日停用卡泊芬净,改用口服伏立康唑 0.2 g 2 次/d,为出院做准备,同时给予甲泼尼龙 12 mg qd 预防过敏反应,并密切观察,患者无不适。2017 年 11 月 21 日复查胸部 CT(图 1g~i):双肺病灶较前有明显吸收好转。口服伏立康唑减量为 0.2 g qd。
11 月 28 日出院,出院前检查:Hb 123 g/L,WBC 8.91×109/L,N 7.3×109/L,TLC 0.9×109/L,ESR 12 mm/1 h,CRP 3.9 mg/L,PCT 0.03 ng/mL,PA 0.28 g/L,ALB 45 g/L,BUN 6.5 mmol/L,Cr 37 μmol/L。出院医嘱:口服伏立康唑 0.2 g qd。
出院后多次门诊随访,伏立康唑应用 9 个月后停药,患者一般情况好,偶有咳嗽、咳白痰,无发热、咯血,体重增加 7 kg,体脂明显增加(表 1),期间多次复查胸部 CT,结果提示两肺炎症持续吸收、好转,最终表现为稳定的慢性或陈旧灶(图 1j~l);WBC、N、TLC 正常,CRP、PCT、ESR 无明显异常,PA、ALB、总胆固醇及尿素、Cr 正常。
讨论
肺曲霉病是由感染或吸入曲霉菌属引起的一组急、慢性肺部疾病,因宿主免疫状态不同而有不同表现,免疫功能受损者易感染,常见类型有 IPA、慢性坏死性肺曲霉病、慢性肺曲霉病、过敏性支气管肺曲霉病[1]。IPA 多发生在原有肺部慢性病或严重基础疾病的基础上,特别是应用大量糖皮质激素或免疫抑制剂的情况下,因人体免疫功能低下而引起感染。此例患者尽管有强直性脊柱炎病史,但病情长期稳定,至少一年余未用糖皮质激素或免疫抑制剂等治疗,故不存在传统意义上的免疫功能抑制状态。患者长期进食少,消瘦,9 月初起病时 Hb、Alb、K+均低于正常值,故尽管无完整的营养学数据,也可判断患者长期处于营养不良状态。以往对 165 例侵袭性真菌病的易感因素分析显示,低白蛋白血症是侵袭性真菌病的常见高危因素[2];另外在 1 例毛霉病报道中,营养不良也是重要的诱发因素[3],故考虑营养不良可能是此例 IPA 的主要诱发因素。
患者起病急,表现为反复咯血、发热 1 个月,起病后炎症指标迅速升高,胸部影像学示肺段渗出、实变伴空洞形成,多次痰涂片、痰培养均发现黑曲霉,支气管肺泡灌洗液 GM 试验(+),故临床诊断为 AIPA[1]。
美国感染病学会(IDSA)2016 年的曲霉病治疗指南推荐伏立康唑为 IPA 的首选治疗,不建议以米卡芬净或卡泊芬净等棘白菌素类作为首选治疗[4]。该例患者在外院因静脉应用伏立康唑后出现「全身瘙痒伴红色皮疹」而改用棘白菌素类药物治疗。考虑伏立康唑的安全性和耐受性较好,严重过敏反应更多与注射用辅料(如磺丁基醚 β-环糊精钠)有关,并非药物本身,故患者营养状况明显改善、症状明显好转、肺内病灶明显吸收后,在适当应用糖皮质激素和密切观察的基础上改用伏立康唑口服,患者未再出现不良反应[5]。
发病初期患者应用抗真菌药物治疗 1 个月后临床症状、一般情况及胸部 CT 等均无改善且病情不断加重,故对于 IPA 患者,单纯抗感染治疗可能难以起效。疾病状态下,膳食摄入低于机体消耗,加之起病前长期存在营养不良,故患者发病后蛋白质和能量缺乏持续加重,且可能同时伴随其他多种营养素的缺乏,严重影响机体免疫功能,可导致胸腺、脾和淋巴结等部位的 T 淋巴细胞减少、功能减退;B 淋巴细胞数目相对正常,但抗体的生成减弱;吞噬细胞及补体系统的功能也受到影响[6]。故营养不良状态下容易发生感染,感染后单纯抗感染药物很难有效发挥作用,患者的发病和早期的治疗反应也佐证了该观点。营养、免疫、感染三者之间互相影响,互为因果,营养状况差、免疫功能差、严重感染可形成恶性循环,因此对营养状态进行合理评价和针对性治疗应成为该类患者综合治疗的核心。
临床常用营养状况评价主要包括病史采集、体格测量(如体重、皮褶厚度测量)、生化指标。生化指标主要涵盖两个方面:(1)营养成分及其代谢产物测定:血浆 ALB、PA、Hb、BUN、Cr(尿肌酐清除率和肌酐身高指数可更好地用于评估营养状况)等;(2)免疫功能评价:TLC、迟发性超敏反应、外周血 T 细胞亚群等[7]。另一方面,营养不良还常出现内环境紊乱,以电解质紊乱为常见,如低钾血症,影响组织细胞的正常代谢,在营养不良及内环境紊乱的条件下,机体难以正常发挥免疫功能[6, 8]。
患者病情缓解前,进食少、睡眠差,反复大咯血,加上感染持续加重、药物不良反应等,其营养状况不断恶化。起病初,生化指标仅轻度异常,但 6 周后(即入院时)已出现明显的体重下降、体脂消耗(表1,图 1a~c),PA 极低,Hb、ALB 明显降低,Cr 下降至 35 µmol/L 左右(表 1);7 周后(入院 1 周),Cr 继续下降,BUN 也降低(表 1);虽然外周血 T 细胞亚群基本正常,但 TLC 降低;此外,由于营养不良和垂体后叶素的使用,患者还出现低钾血症,血钾浓度最低降至 2.5 mmol/L(表 1)。胸部 CT 病灶不断进展及出现新发感染病灶(图 1a~f)。入院后在强化营养支持及减少垂体后叶素用量治疗后,上述状况在 9 周后(入院 3 周)得以改善,患者病情逐渐缓解。首先低钾血症得到纠正,内环境逐渐恢复稳定,其他营养生化指标先后恢复,其中 PA 最早出现明显上升,随后 Hb、ALB、BUN 上升,Cr 则在较长一段时间后也逐渐上升。在上述基础上,临床症状和肺内病灶也开始迅速改善(图 1g~j);随访一段时间后,体重增加 7 kg,体脂也明显增加(表 1,图 1j~l)。说明一般营养状况差是患者发病、治疗效果不佳的重要因素。
综上所述,营养不良可影响组织代谢、内环境稳态和免疫功能,因此纠正营养不良是防治 IPA 的重要环节。但目前对于肺曲霉病,IDSA、ERS 等指南均重点强调传统免疫抑制等高危因素,推荐以抗真菌治疗为主要手段,鲜有关于一般营养不良、内环境紊乱和免疫功能低下之间关系的阐述,或是强调营养支持治疗的描述[4, 9],而后者是维持机体正常代谢、内环境稳态和免疫功能的基础,是抗真菌药物发挥良好疗效的重要保障。本文希望提高该方面的认识,加强相关循证医学证据的研究。
利益冲突:本文不涉及任何利益冲突。
参考文献略。
本文转载自公众号「中国呼吸与危重监护杂志」
引用本文:王亚丽,胡莉娟,朱蕾. 营养不良患者急性侵袭性肺曲霉病一例的诊治体会. 中国呼吸与危重监护杂志, 2021, 20(5): 349-352. doi: 10.7507/1671-6205.202011011
本文完
排版:Jerry


