据国家卫生健康委员会官方网站,3月29日0—24时,31个省(自治区、直辖市)和新疆生产建设兵团报告新增本土病例1565例,本土无症状感染者7090例[1]。
由于这一波疫情主要由传播快、隐匿性强,但致病力有所减弱的奥密克戎突变株(Omicron)引起,因此新冠肺炎患者临床症状表现出新的特点[2]。
除此之外,在去年年底和今年年初,国家药监局(NMPA)先后批准安巴韦单抗/罗米司韦单抗[3]和奈玛特韦片/利托那韦片(Paxlovid)[4],用于治疗轻型和普通型且伴有进展为重型高风险因素的新冠患者,让我们有了治疗新冠的特效药。
在以上因素的推动下,时隔近1年之后,国家卫生健康委员会办公厅和国家中医药管理局办公室发布了《新型冠状病毒肺炎诊疗方案(试行第九版)》(以下简称第九版《诊疗方案》)[2]。
关于印发新型冠状病毒肺炎诊疗方案(试行第九版)的通知截图
与上一版相比[5],第九版《诊疗方案》至少在五个方面做了较大的更新:发现更迅速,排除更便捷;轻型病例集中隔离,无需入院;纳入中和抗体组合安巴韦单抗/罗米司韦单抗和小分子药物Paxlovid;修订完善中医治疗的内容;解除隔离及出院标准放宽,出院后监测时间缩短。
接下来,我们就一起来看看第九版《诊疗方案》的主要更新内容。
发现更迅速,排除更便捷
早在今年的3月11日,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组就印发了《新冠病毒抗原检测应用方案(试行)》[6],制定了推进“抗原筛查、核酸诊断”的监测模式,以及在核酸检测基础上增加抗原检测作为补充的决定。
抗原检测与核酸检测一样,都是直接检测病毒的方法。只不过与核酸检测相比,抗原检测的速度更快,操作更方便。虽然准确度较核酸检测低,但是抗原检测仍旧是一种感染早期的有效筛查手段。
因此,第九版《诊疗方案》增加了抗原检测作为核酸检测的补充,这会进一步提高早发现病例的能力。
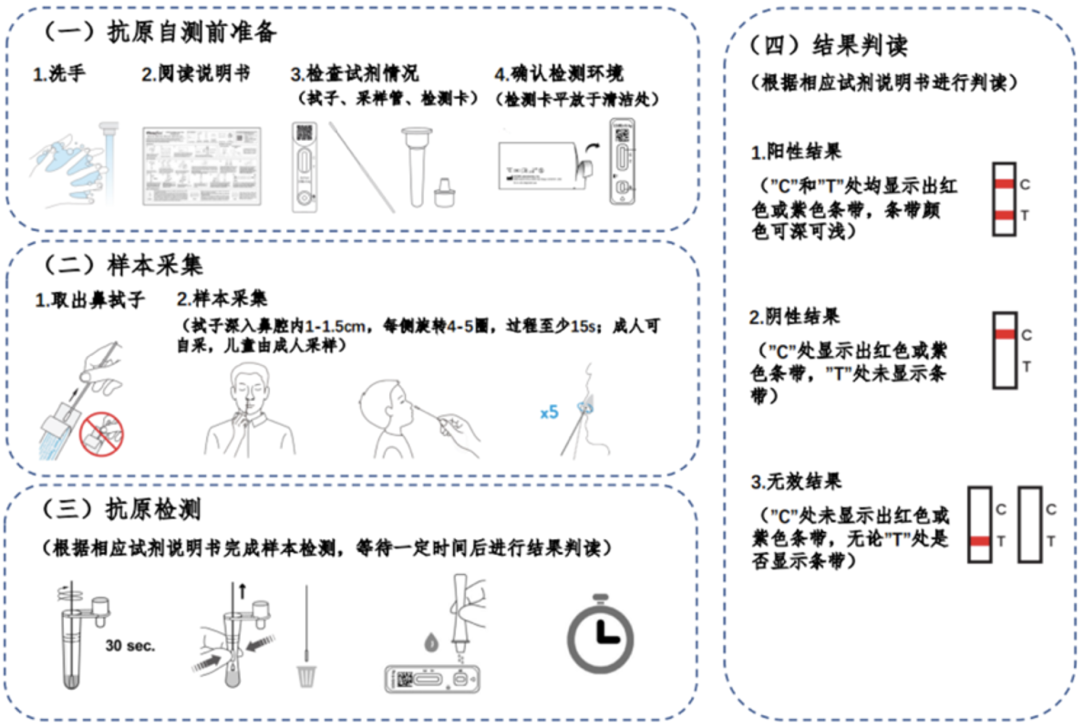
国务院联防联控机制综合组绘制的抗原检测流程[7]
据了解,截至3月16日,NMPA已批准13个新冠病毒抗原检测试剂产品[8,9]。需要指出的是,新冠病毒核酸检测阳性才是确诊的首要标准。
在病例的发现与报告这一块儿,第九版《诊疗方案》还直接删除了抗体检测流程,只要连续两次核酸检测阴性(采样时间至少间隔24小时),就可排除疑似病例诊断。
轻型病例集中隔离,无需入院
自去年年底在南非现身以来,传播能力更强的奥密克戎突变株[10,11]已经取代德尔塔变异株(Delta),成为全球主要流行毒株。
好消息是,由于新冠疫苗的接种[12]和TMPRSS2切割奥密克戎突变株S蛋白的能力下降[13],奥密克戎突变株感染者的临床症状更轻,住院率和死亡率也降低[14,15]。第九版《诊疗方案》在介绍新冠临床特点时指出:曾接种过疫苗者及感染奥密克戎突变株的患者,以无症状及轻症为主。
正是基于以上原因,第九版《诊疗方案》首次提出了对病例实施分类收治的策略。具体来说,轻型病例实行集中隔离管理,做好对症治疗和病情监测,如果患者病情加重,再转到定点医院治疗;普通型、重型、危重型病例和有重型高危因素的病例,在定点医院集中治疗。
纳入唯一的国产抗病毒药物
第九版《诊疗方案》抗病毒治疗这块儿有了非常大的更新。
由于临床证据不足,上一版推荐的所有抗病毒药物(α-干扰素、利巴韦林、磷酸氯喹和阿比多尔)全部被删除。第九版《诊疗方案》推荐了Paxlovid(奈玛特韦片/利托那韦片)和中和抗体组合安巴韦单抗/罗米司韦单抗。作为中国首个且唯一一个获批的自主知识产权抗新冠特效药,安巴韦单抗/罗米司韦单抗被推荐让人眼前一亮。
之前我们已经介绍过,安巴韦单抗/罗米司韦单抗组合由于独特且互补的抗病毒机制[16-18],以及单次静脉给药1000mg/1000mg之后,血药浓度可迅速达到300-400ug/ml,最大血药浓度(423+318)μg/ml,为体外针对奥密克戎BA.1及BA.2 IC50的数百倍[16,19,20],对目前所有已知变异株保持治疗效果。
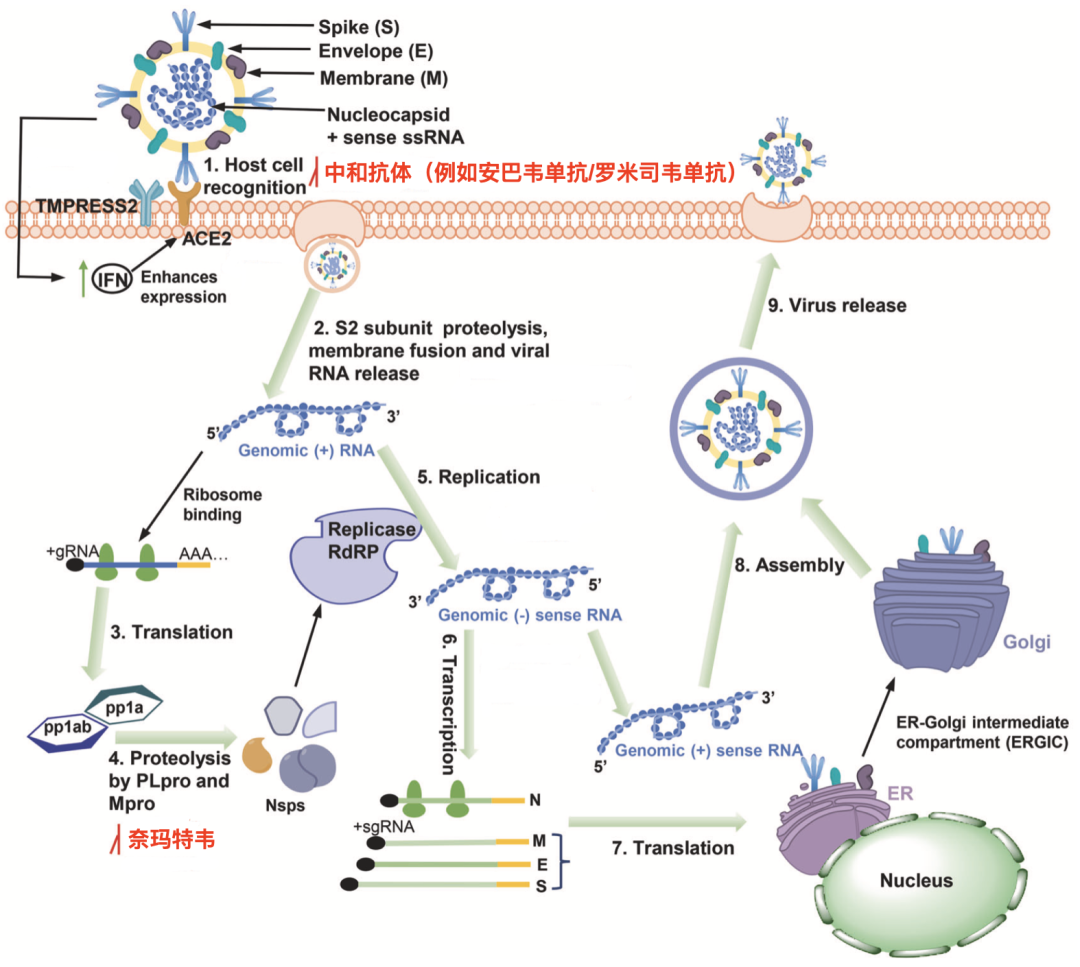
中和抗体和小分子药物的作用位点[21]
此外,上一版的“静注COVID-19人免疫球蛋白”和“康复者恢复期血浆”被第九版《诊疗方案》纳入抗病毒治疗的范畴。不过,由于这两种抗病毒疗法相关数据有限,我们这里就不做详细介绍。接下来我们重点介绍Paxlovid和安巴韦单抗/罗米司韦单抗,了解一下二者的异同。
首先是适用人群。
根据第九版《诊疗方案》,Paxlovid的适用人群为发病5天以内的轻型和普通型,且伴有进展为重型高风险因素的成人和青少年(12-17岁,体重≥40kg);安巴韦单抗/罗米司韦单抗的适用人群为轻型和普通型,且伴有进展为重型高风险因素的成人和青少年(12-17岁,体重≥40kg)患者。不难看出,安巴韦单抗/罗米司韦单抗的应用时间窗更长。
关于重型/危重型高危人群,第九版《诊疗方案》也做了一项重要调整,那就是将患者年龄从大于65岁,下调为大于60岁。也就是说,接受这两种抗病毒药物治疗的人群扩大了。
此外,高危人群还包括:有心脑血管疾病(含高血压)、慢性肺部疾病、糖尿病、慢性肝脏、肾脏疾病、肿瘤等基础疾病者;免疫功能缺陷(如艾滋病患者、长期使用皮质类固醇或其他免疫抑制药物导致免疫功能减退状态);肥胖(体质指数≥30);晚期妊娠和围产期女性;以及重度吸烟者。
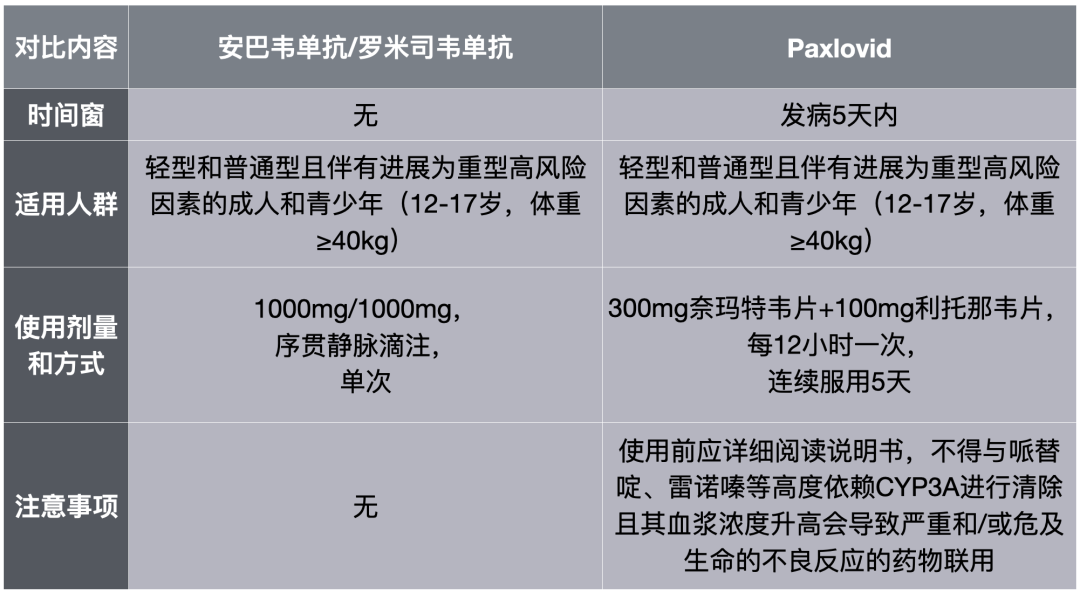
第九版《诊疗方案》中Paxlovid和安巴韦单抗/罗米司韦单抗的异同
再来看用法和用量。
Paxlovid的是300mg的奈玛特韦片与100mg的利托那韦片同时服用,每12小时一次,连续服用5天;安巴韦单抗/罗米司韦单抗的是两种抗体的剂量分别为1000mg,以不高于4ml/min的速度序贯静脉滴注。从用法上看,Paxlovid是口服,要比安巴韦单抗/罗米司韦单抗的注射方便,不过安巴韦单抗/罗米司韦单抗仅需注射一次即可。
此外,值得一提的是,安巴韦单抗/罗米司韦单抗的可结晶段(Fc)是经过修饰改造的。这一改造使安巴韦单抗/罗米司韦单抗的半衰期达到普通抗体的2-3倍,从21天延长到46-76天[22,23];还会显著增加靶器官(肺部)的药物分布,提高肺部抗体浓度[24]。这或许能给患者提供长久的保护。
最后再看两种药物使用时的注意事项。
第九版《诊疗方案》指出,使用Paxlovid前应详细阅读说明书,不得与哌替啶、雷诺嗪等高度依赖CYP3A进行清除且其血浆浓度升高会导致严重和/或危及生命的不良反应的药物联用;而安巴韦单抗/罗米司韦单抗没有这种药物相互作用的注意事项。从这个角度来说,中和抗体的临床使用更便捷,且具有不可替代性。
需要指出的是,从两种药物的适用人群不难看出,需要接受这两种抗病毒药物治疗的患者是有进展为重型高风险因素的患者,而这些患者恰好最有可能使用高度依赖CYP3A进行清除的药物,这也给Paxlovid的临床使用带来一定的不便。
美国国立卫生研究院(NIH)新冠肺炎治疗指南小组更新的新冠肺炎治疗指南,也列出了不能与Paxlovid同时使用,或需要调整剂量的药物[25]。

NIH对Paxlovid合并用药的建议
因此,在临床实践中,治疗轻型和普通型且伴有进展为重型高风险因素的患者时,不仅需要考虑患者的发病时间,还需要根据患者的用药情况,谨慎选择抗病毒药物。
解除隔离及出院标准放宽,出院后监测时间缩短
第九版《诊疗方案》将解除隔离管理及出院标准中的“连续两次呼吸道标本核酸检测阴性(采样时间至少间隔24小时)”,修改为“连续两次新型冠状病毒核酸检测N基因和ORF基因Ct值均≥35(荧光定量PCR方法,界限值为40,采样时间至少间隔24小时),或连续两次新型冠状病毒核酸检测阴性(荧光定量PCR方法,界限值低于35,采样时间至少间隔24小时)”。
第九版《诊疗方案》指出,国内有关研究表明,处于恢复期的感染者在核酸Ct值≥35时,样本中未能分离出病毒,密切接触者未发现被感染的情况。因此将之前版本的Ct值下调到35,这实际上意味着解除隔离及出院标准放宽了。
此外,第九版《诊疗方案》还将上一版的“出院后继续进行14天隔离管理和健康状况监测”,修改为“解除隔离管理或出院后继续进行7天居家健康监测”。

电子显微镜下的新冠病毒(图源:NIAID-RML)
总的来说,结合奥密克戎突变株流行的新特点,以及抗病毒药物的进展,第九版《诊疗方案》做了重大调整。
这版方案让新冠感染者的发现更迅速,疑似病例的排除也变得更便捷;轻型病例集中隔离,无需入院,会优化我国医疗资源,让有重症风险因素或重症患者接受更好的治疗;新推荐的国产中和抗体安巴韦单抗/罗米司韦单抗,由于治疗窗口期长,且不存在药物相互作用,临床使用更便捷,可以用于更多患者的抗病毒治疗。
最后,我们以第九版《诊疗方案》的一段话收尾,“接种新型冠状病毒疫苗可以减少新型冠状病毒感染和发病,是降低重症和死亡发生率的有效手段,符合接种条件者均应接种。符合加强免疫条件的接种对象,应及时进行加强免疫接种”。
期待新冠疫情早日结束。
参考文献
[1].http://www.nhc.gov.cn/xcs/yqfkdt/202203/5cec89d7d07140f69d81a5d3b543005f.shtml
[2].http://www.gov.cn/zhengce/zhengceku/2022-03/15/5679257/files/49854a49c7004f4ea9e622f3f2c568d8.pdf
[3].https://www.nmpa.gov.cn/yaowen/ypjgyw/20211208212528103.html
[4].https://www.nmpa.gov.cn/yaowen/ypjgyw/20220212085753142.html
[5].http://www.gov.cn/zhengce/zhengceku/2021-04/15/5599795/files/e9ce837932e6434db998bdbbc5d36d32.pdf
[6].http://www.gov.cn/xinwen/2022-03/11/content_5678610.htm
[7].http://www.gov.cn/xinwen/2022-03/11/5678610/files/1508e97853344697af0608c13c369962.pdf
[8].https://www.nmpa.gov.cn/yaowen/ypjgyw/20220316102707175.html
[9].https://www.nmpa.gov.cn/zwfw/sdxx/sdxxylqx/qxpjfb/20220316214740149.html
[10].Burki T K. Omicron variant and booster COVID-19 vaccines[J]. The Lancet Respiratory Medicine, 2021.
[11].Nishiura H, Ito K, Anzai A, et al. Relative reproduction number of SARS-CoV-2 Omicron (B. 1.1. 529) compared with Delta variant in South Africa[J]. Journal of clinical medicine, 2022, 11(1): 30.
[12].Johnson A G. COVID-19 Incidence and Death Rates Among Unvaccinated and Fully Vaccinated Adults with and Without Booster Doses During Periods of Delta and Omicron Variant Emergence—25 US Jurisdictions, April 4–December 25, 2021[J]. MMWR. Morbidity and Mortality Weekly Report, 2022, 71.
[13].Shuai H, Chan J F W, Hu B, et al. Attenuated replication and pathogenicity of SARS-CoV-2 B. 1.1. 529 Omicron[J]. Nature, 2022: 1-1.
[14].Maslo C, Friedland R, Toubkin M, et al. Characteristics and outcomes of hospitalized patients in South Africa during the COVID-19 Omicron wave compared with previous waves[J]. JAMA, 2021.
[15].Wolter N, Jassat W, Walaza S, et al. Early assessment of the clinical severity of the SARS-CoV-2 omicron variant in South Africa: a data linkage study[J]. The Lancet, 2022.
[16].Liu L, Iketani S, Guo Y, et al. Striking antibody evasion manifested by the Omicron variant of SARS-CoV-2[J]. Nature, 2022, 602(7898): 676-681..
[17].Piccoli L, Park Y J, Tortorici M A, et al. Mapping neutralizing and immunodominant sites on the SARS-CoV-2 spike receptor-binding domain by structure-guided high-resolution serology[J]. Cell, 2020, 183(4): 1024-1042. e21.
[18].Corti D, Purcell L A, Snell G, et al. Tackling COVID-19 with neutralizing monoclonal antibodies[J]. Cell, 2021.
[19].Zhang Y, Hao X, Ma J, et al. Phase 1 safety and pharmacokinetics studies of BRII-196 and BRII-198, SARS-CoV-2 spike-targeting monoclonal antibodies[J]. medRxiv, 2021.
[20]. Iketani S, Liu L, Guo Y, et al. Antibody evasion properties of SARS-CoV-2 Omicron sublineages[J]. Nature, 2022: 1-1.
[21].Yan W, Zheng Y, Zeng X, et al. Structural biology of SARS-CoV-2: open the door for novel therapies[J]. Signal Transduction and Targeted Therapy, 2022, 7(1): 1-28.
[22].Zhang Y, Hao X, Ma J, et al. Phase 1 safety and pharmacokinetics studies of BRII-196 and BRII-198, SARS-CoV-2 spike-targeting monoclonal antibodies[J]. medRxiv, 2021.
[23].Robbie G J, Criste R, Dall'Acqua W F, et al. A novel investigational Fc-modified humanized monoclonal antibody, motavizumab-YTE, has an extended half-life in healthy adults[J]. Antimicrobial agents and chemotherapy, 2013, 57(12): 6147-6153.
[24].Shah DK, Betts AM. Antibody biodistribution coefficients: inferring tissue concentrations of monoclonal antibodies based on the plasma concentrations in several preclinical species and human. MAbs. 2013;5(2):297-305. doi:10.4161/mabs.23684
[25].https://www.covid19treatmentguidelines.nih.gov/therapies/statement-on-paxlovid-drug-drug-interactions/
本文内容来源自「奇点网」,作者:BioTalker


